Молекулярная физика и термодинамика. Физические основы молекулярно-кинетической теории (МКТ) газов презентация
Содержание
- 2. 1. Основные положения МКТ 1. Вещество имеет дискретную структуру, состоит из частиц, которые разделены промежутками. 2.
- 3. 2. Масса и размеры молекул Относительной молекулярной массой (μr) называется отношение массы m0 молекулы данного вещества
- 4. Оценим массу молекулы воды (m0)
- 5. 3. Состояние системы. Внутренняя энергия системы. Равновесным состоянием системы называется такое состояние, при котором все параметры
- 6. 4. Основное уравнение МКТ Идеальный газ – это достаточно разреженный газ, расстояния между молекулами газа во
- 7. Число молекул, достигающих площадки ∆S: Молекула при соударении со стенкой сообщает ей импульс: Поскольку ударяется N
- 8. 5. Температура Температура – мера термодинамического равновесия тел. Температурная шкала Цельсия: Температура – мера средней кинетической
- 9. Из сравнения основного уравнения МКТ и уравнения Клайперона: - Постоянная Больцмана - кинетическая энергия
- 10. 6. Закон Авогадро. Закон Дальтона Закон Авогадро: при одинаковых давлениях и температурах концентрация молекул у всех
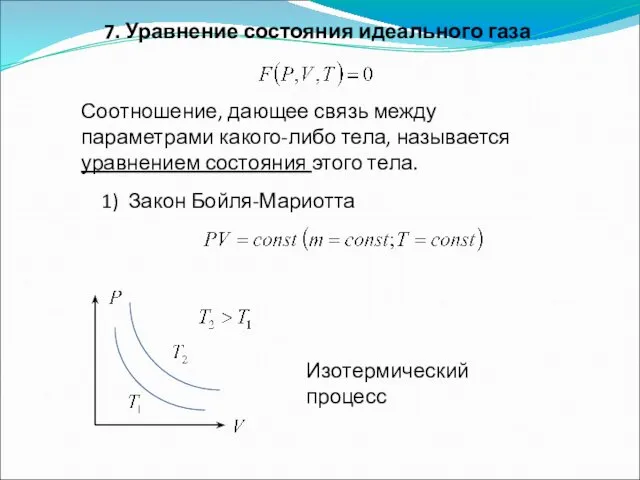
- 11. 7. Уравнение состояния идеального газа Соотношение, дающее связь между параметрами какого-либо тела, называется уравнением состояния этого
- 12. 2) Закон Гей-Люссака Изобарический процесс 3) Закон Шарля Изохорический процесс
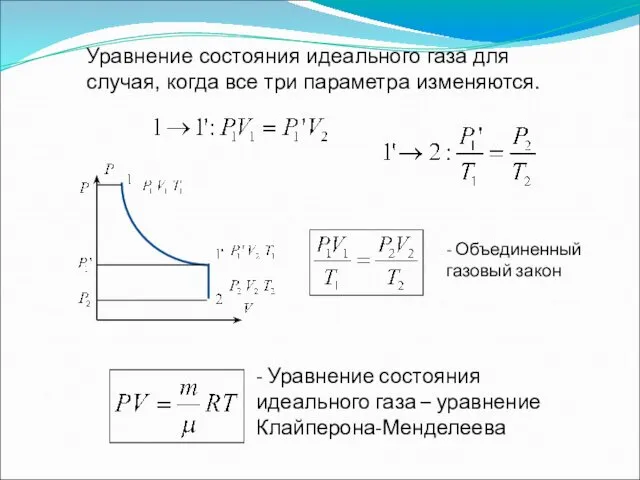
- 13. Уравнение состояния идеального газа для случая, когда все три параметра изменяются. - Объединенный газовый закон -
- 14. 8. Средняя квадратичная скорость движения молекул -средняя квадратичная скорость движения молекул m – масса одной молекулы
- 15. Распределение молекул по скоростям Экспериментальная проверка распределения Максвелла Барометрическая формула Распределение Больцмана Опыты Перрена Средняя длина
- 16. Распределение молекул по скоростям Закон Максвелла описывается некоторой функцией f(υ), называемой функцией распределения молекул по скоростям.
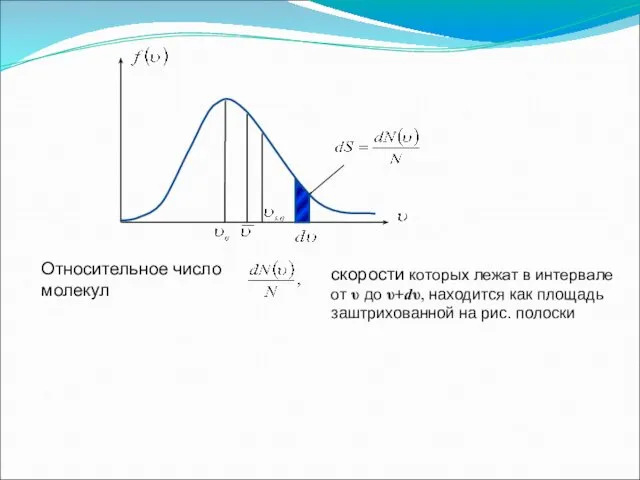
- 17. Относительное число молекул скорости которых лежат в интервале от υ до υ+dυ, находится как площадь заштрихованной
- 18. Т.к. Найдем значение наиболее вероятной скорости υв , продифференцировав выражение (1) по аргументу υ и приравняв
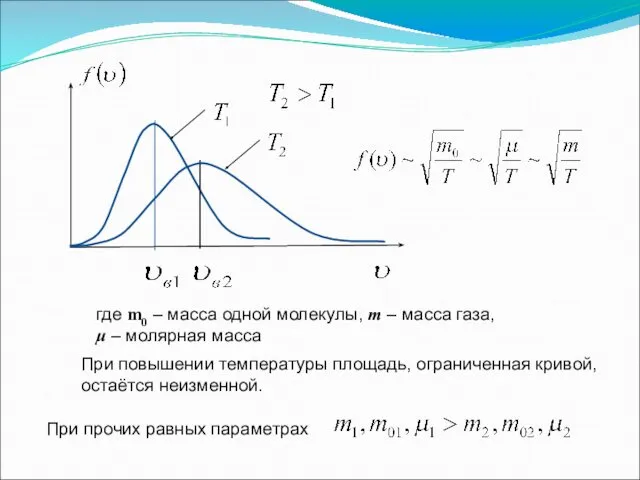
- 19. При повышении температуры площадь, ограниченная кривой, остаётся неизменной. При прочих равных параметрах где m0 – масса
- 20. Cреднее значение скорости Каждому интервалу соответствует количество молекул - сумма значений скоростей всех N молекул. Средняя
- 21. Средняя арифметическая скорость Средняя квадратичная скорость Наиболее вероятная скорость Скорости, характеризующие состояние газа:
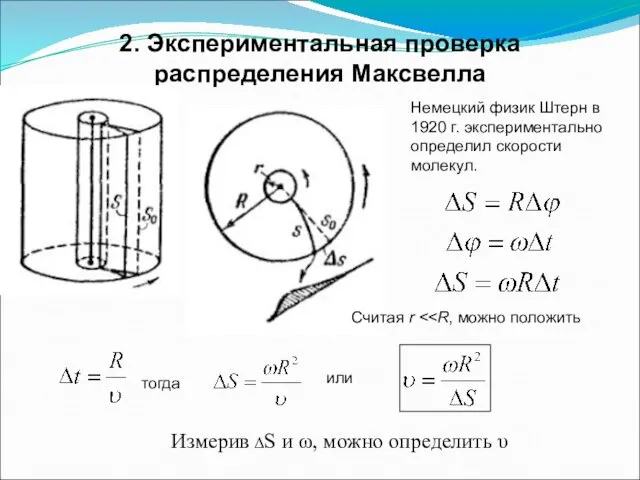
- 22. 2. Экспериментальная проверка распределения Максвелла Немецкий физик Штерн в 1920 г. экспериментально определил скорости молекул. Считая
- 23. Молекулярный пучок ловушка Опыт Ламмерта (1929 г.) t1 – время за которое молекулы пролетают расстояние между
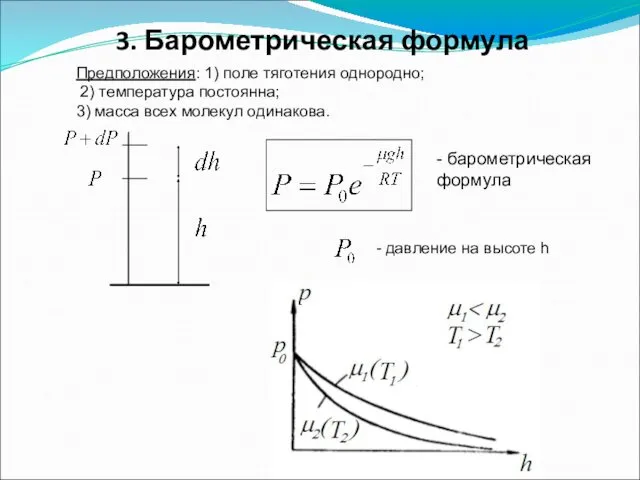
- 24. 3. Барометрическая формула - давление на высоте h - барометрическая формула Предположения: 1) поле тяготения однородно;
- 25. 4. Распределение Больцмана Заменив в барометрической формуле получим закон изменения числа молекул в единице объема с
- 26. 5. Опыты Перрена Перрен (1909 г.) – опыты по определению числа Авогадро. Рассмотрим слой, находящийся над
- 27. 6. Средняя длина свободного пробега Между двумя последовательными столкновениями молекулы проходят некоторый путь l, который называется
- 28. Явления переноса в термодинамически неравновесных системах Диффузия Теплопроводность Вязкость К явлениям переноса относятся теплопроводность (обусловлена переносом
- 29. С макроскопической точки зрения перенос массы вещества подчиняется закону Фика: масса вещества ΔM, переносимая за время
- 30. Согласно кинетической теории газов: - средняя длина свободного пробега средняя скорость движения молекул, d – эффективный
- 31. 2. Теплопроводность. Перенос энергии в форме теплоты подчиняется закону Фурье: Количество теплоты q, которое переносится в
- 32. 3. Внутреннее трение (вязкость). Механизм возникновения внутреннего трения между параллельными слоями газа (жидкости), движущимися с различными
- 33. Физические основы термодинамики Первое начало термодинамики. Работа газа при изменении его объема. Число степеней свободы молекулы.
- 34. 1. Первое начало термодинамики Внутренняя энергия может изменяться за счет двух различных процессов: Совершения над телом
- 35. 2. Работа газа при изменении его объема Элементарная работа, совершаемая газом при перемещении поршня на расстояние
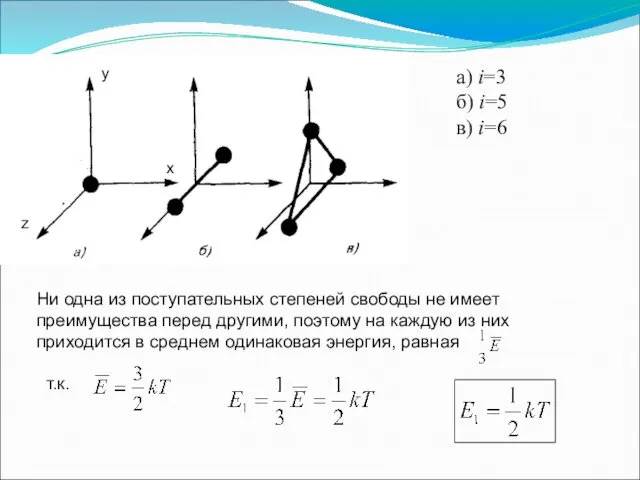
- 36. 3. Число степеней свободы молекулы Средняя энергия поступательного движения молекулы: Числом степеней свободы механической системы называется
- 37. y x z а) i=3 б) i=5 в) i=6 Ни одна из поступательных степеней свободы не
- 38. 4.Теплоемкость идеального газа Теплоемкостью тела называется величина, равная количеству тепла, которое нужно сообщить телу, чтобы повысить
- 39. Уравнение Майера молярная теплоемкость при постоянном давлении показатель адиабаты При нагревании газа при постоянном давлении его
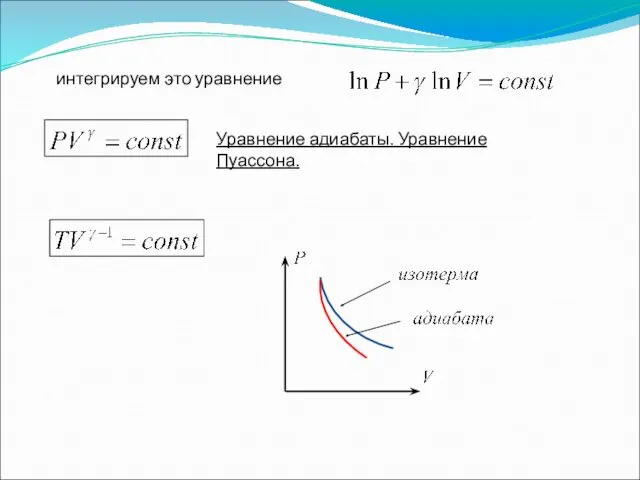
- 40. 5. Адиабатический процесс Адиабатическим называется процесс, протекающий без теплообмена с внешней средой. (1) Подставляем в (1)
- 41. интегрируем это уравнение Уравнение адиабаты. Уравнение Пуассона.
- 42. Политропическим называется такой процесс, при котором давление и объем идеального газа связаны соотношением: Изобарический процесс Изотермический
- 43. 6. Работа, совершаемая идеальным газом при различных процессах Рассмотрим случай Работа, совершаемая идеальным газом при любом
- 44. Для изотермического процесса: n=1 Для адиабатического процесса: Работа, совершаемая газом при изотермическом процессе При изобарическом процессе:
- 45. Реальные газы Отклонение газов от идеальности Уравнение Ван-дер-Ваальса Экспериментальные изотермы
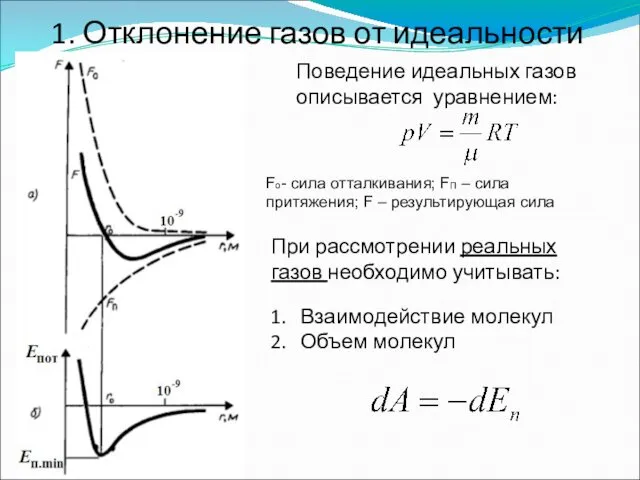
- 46. 1. Отклонение газов от идеальности Поведение идеальных газов описывается уравнением: При рассмотрении реальных газов необходимо учитывать:
- 47. Критерием различных агрегатных состояний вещества является соотношение величин En.min и kT En.min - наименьшая потенциальная энергия
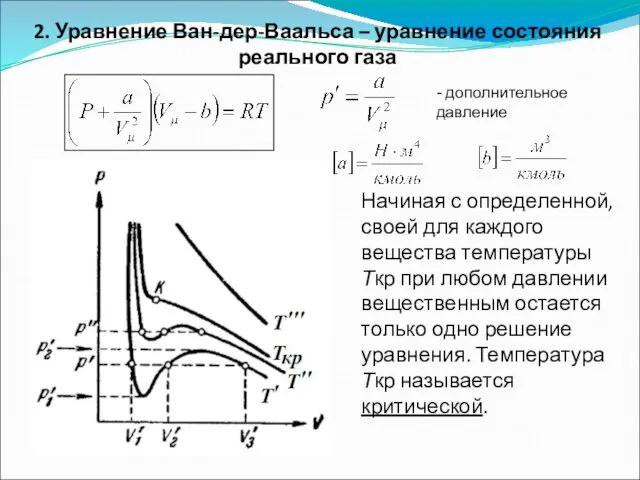
- 48. 2. Уравнение Ван-дер-Ваальса – уравнение состояния реального газа Начиная с определенной, своей для каждого вещества температуры
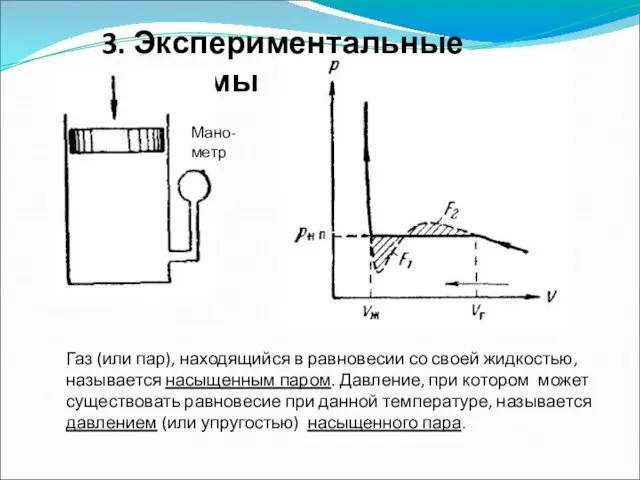
- 49. 3. Экспериментальные изотермы Мано-метр Газ (или пар), находящийся в равновесии со своей жидкостью, называется насыщенным паром.
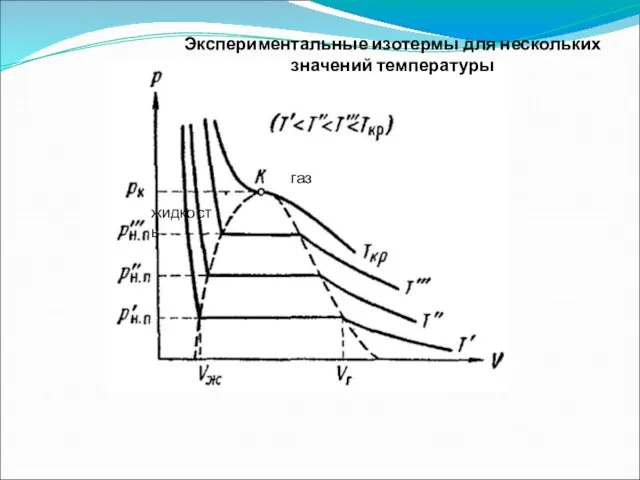
- 50. Экспериментальные изотермы для нескольких значений температуры газ жидкость
- 51. Внутренняя энергия реального газа Эффект Джоуля-Томсона Ожижение газов
- 52. 1. Внутренняя энергия реального газа Внутренняя энергия реального газа - кинетическая энергия движения молекул; - взаимная
- 53. 2. Эффект Джоуля-Томсона Пропуская газ по теплоизолированной трубке с пористой перегородкой, Джоуль и Томсон обнаружили, что
- 54. При адиабатическом расширении газа: U+pV - энтальпия – величина, которая сохраняется в условиях опыта Джоуля-Томсона Работа
- 55. Расчет для моля газа Из уравнения Ван дер Ваальса для газа до расширения: Внутренняя энергия до
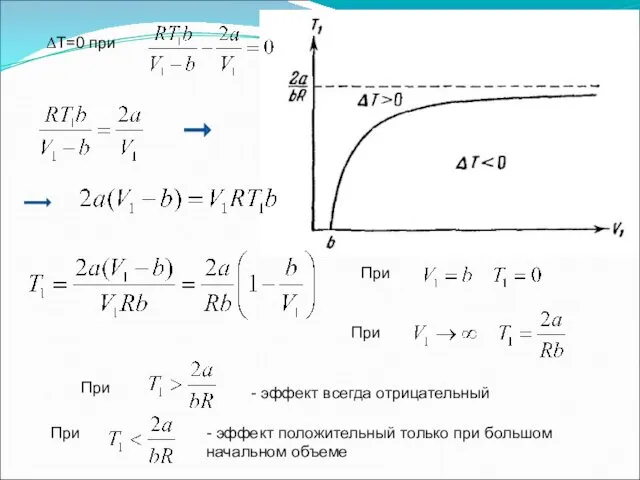
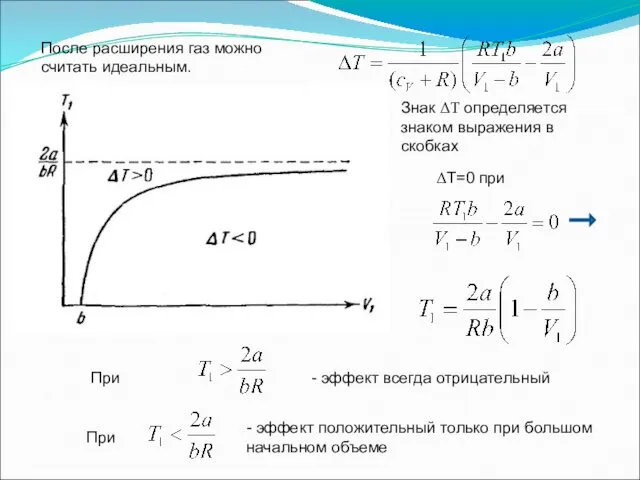
- 56. Преобразуем третье слагаемое: подставим Преобразуем: Знак ΔТ определяется знаком выражения в скобках
- 57. ΔТ=0 при При При При - эффект всегда отрицательный При - эффект положительный только при большом
- 58. Знак ΔТ определяется знаком выражения в скобках ΔТ=0 при При - эффект всегда отрицательный При -
- 59. Обратимые и необратимые процессы. Коэффициент полезного действия тепловой машины. Второе начало термодинамики. Цикл Карно. Коэффициент полезного
- 60. 1. Обратимые и необратимые процессы. Коэффициент полезного действия тепловой машины Обратимым процессом называется такой процесс, который
- 62. Скачать презентацию













































 Полупроводниковые схемы памяти. (Лекция 14)
Полупроводниковые схемы памяти. (Лекция 14) Моя педагогическая династия.
Моя педагогическая династия. Экологические взаимодействия живых организмов
Экологические взаимодействия живых организмов Сложные предложения с различными видами связи (вводный урок). 9 класс
Сложные предложения с различными видами связи (вводный урок). 9 класс О подводных жителях
О подводных жителях Применение ИКТ в образовательном процессе
Применение ИКТ в образовательном процессе Бізнес-модель по реалізації хліба
Бізнес-модель по реалізації хліба Тема =Базовая форма =Треугольник=. Складывание фигур =Лисенок=Щенок=
Тема =Базовая форма =Треугольник=. Складывание фигур =Лисенок=Щенок= Внутреннее устройство ПК
Внутреннее устройство ПК Экскурсия Улицы родного села.
Экскурсия Улицы родного села. Проектно- исследовательская деятельность в экологическом образовании старших дошкольников
Проектно- исследовательская деятельность в экологическом образовании старших дошкольников Стратегическое планирование и технологии программно-целевого управления
Стратегическое планирование и технологии программно-целевого управления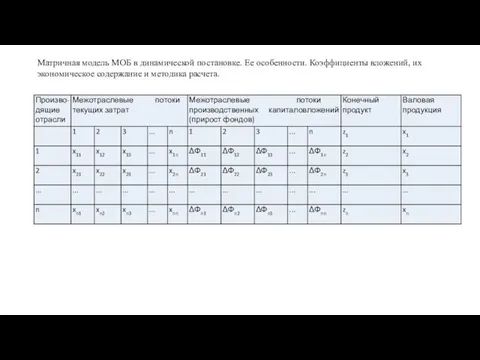 Матричная модель МОБ в динамической постановке
Матричная модель МОБ в динамической постановке Технология и организация производства продукции и услуг
Технология и организация производства продукции и услуг Диагностика, техническое обслуживание рулевого управления автомобиля ВАЗ-2107
Диагностика, техническое обслуживание рулевого управления автомобиля ВАЗ-2107 Отчет об участии в акции Всероссийский экологический урок Сделаем вместе!
Отчет об участии в акции Всероссийский экологический урок Сделаем вместе! Проект на тему Семья (средняя группа)
Проект на тему Семья (средняя группа) Cистема управления персоналом государственной и муниципальной службы
Cистема управления персоналом государственной и муниципальной службы Высокоточные системы навигации. Лекция №1.2
Высокоточные системы навигации. Лекция №1.2 Проектная работа профессии голубого неба
Проектная работа профессии голубого неба Женщины-спортсменки 20 века
Женщины-спортсменки 20 века Нарушения мышления
Нарушения мышления Олефиновые углеводороды как сырье для органического синтеза. Реакции олефинов. Способы производства олефинов. Лекция 4
Олефиновые углеводороды как сырье для органического синтеза. Реакции олефинов. Способы производства олефинов. Лекция 4 Дорожное движение. Для 3-х летних малышей
Дорожное движение. Для 3-х летних малышей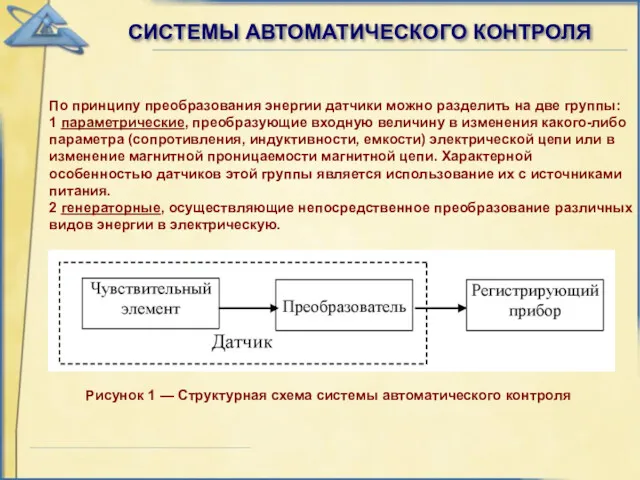 Системы автоматического контроля
Системы автоматического контроля Мероприятие ко Дню Победы
Мероприятие ко Дню Победы To say, to tell, to speak, to talk
To say, to tell, to speak, to talk интеллектуальная игра по географии Крестики-нолики
интеллектуальная игра по географии Крестики-нолики