Слайд 2

Определение:
Алкены – это непредельные углеводороды с общей формулой CnH2n,в молекулах которых
между атомами углерода имеется одна двойная связь.
Пример . CH2 = CH2 (C2H4)
CH3 – CH =CH –CH3 (C4H8)
Атомы углерода при двойной связи находятся в состоянии sp2 –гибридизации.
Слайд 3

Номенклатура алкенов.
Названия углеводородов ряда этилена образуются путем изменения суффикса –ан
соответствующего предельного углеводорода на –ен или – илен.
CH3─ CH3 →CH 2=CH2
Этан этен или этилен
CH3─ CH2 ─CH3 → CH2 =CH ─CH3
Пропан пропен или пропилен
Слайд 4

Гомологический ряд алкенов
Слайд 5

Изомерия и номенклатура.
1.Изомерия положения двойной связи ( π-связи) .
Так из формулы
бутана можно вывести формулы двух непредельных изомеров:
СH3 – CH2 – CH2 – CH3
⁄ \
1 2 3 4 1 2 3 4
CH2 =CH – CH2 – CH CH3 – CH = CH – CH3
бутен-1 бутен-2
Слайд 6

Пространственная изомерия.
Так например , из-за двойной связи в молекулах алкенов атомы
и группы атомов (радикалы ) не могут свободно вращаться вокруг своей оси .Поэтому они в пространстве могут располагаться в двух разных положениях по отношению к двойной связи.
СH3 – CH = CH – CH3
⁄ \
CH3 CH3 CH3 H
\ ⁄ \ ⁄
C =C C = C
⁄ \ ⁄ \
H H H CH3
бутен-2 ( цис- форма ) бутен-2 ( транс- форма)
Слайд 7

Получение алкенов.
1.Термический крекинг алканов при 400-700 oС:
C8H18 ––> C4H8 +
C4H10;
октан бутен бутан
2.Дегидрирование алканов : C4H10 ––> C4H8 + H2; (t, Ni)
бутан бутен
3. Дегидратация спиртов : С2Н5ОН ––> С2Н4 + Н2О (при нагревании в присутствии концентрированной серной кислоты)
Слайд 8
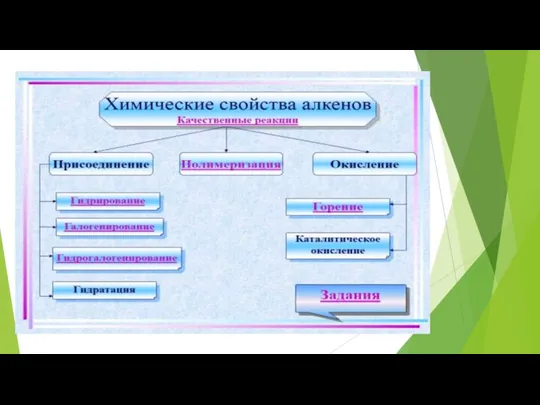
Слайд 9

Реакции присоединения по месту
разрыва двойной связи.
1.Реакция гидрирования. CH2 =CH2
+H2 → CH3 −CH3
Этен Этан
2.Реакция галогенирования. CH2 =CH2 + Cl2 → CH2Cl – CH2Cl
Этен 1,2 - дихлорэтан
3 Реакция гидратации. CH2 = CH2 + HOH → CH3 – CH2OH
этен этанол
4.Реакция гидрогалогенирования . СH2 = CH2 + HCl→CH3- CH2Cl
этен хлорэтан
Слайд 10

В случае несимметричной молекулы
алкена :









 Круг Монтессори
Круг Монтессори Конференция
Конференция Безработица. Причины, формы и последствия безработицы
Безработица. Причины, формы и последствия безработицы Обувные товары
Обувные товары Профильная подготовка учащихся по химии Диск
Профильная подготовка учащихся по химии Диск Презентация к уроку по теме: Чудо Земли Хлеб
Презентация к уроку по теме: Чудо Земли Хлеб Великие люди
Великие люди Проект бюджета Одинцовского муниципального района Московской области на 2017 год и плановый период 2018 и 2019 годов
Проект бюджета Одинцовского муниципального района Московской области на 2017 год и плановый период 2018 и 2019 годов Исправление ширины рельсовой колеи на СП (кривая по ординатам)
Исправление ширины рельсовой колеи на СП (кривая по ординатам) Инициативное предложение Капитальный ремонт крыши Дома культуры в пгт.Мирный
Инициативное предложение Капитальный ремонт крыши Дома культуры в пгт.Мирный Странгуляционная асфиксия
Странгуляционная асфиксия Первая помощь. Основы реанимации
Первая помощь. Основы реанимации Антигистаминные средства
Антигистаминные средства Презентация по лексической теме Зимующие птицы
Презентация по лексической теме Зимующие птицы 20230927_kombin_urok
20230927_kombin_urok Профессия: учитель английского языка
Профессия: учитель английского языка Оценка формирования сварного шва при лазерной сварке в различных средах
Оценка формирования сварного шва при лазерной сварке в различных средах Моя будущая профессия - учитель
Моя будущая профессия - учитель Хронология завода ООО КСС-завод г. Новосибирска
Хронология завода ООО КСС-завод г. Новосибирска Урок по географии 7 класс. Южная Америка. Проверочная работа.
Урок по географии 7 класс. Южная Америка. Проверочная работа. Святые источники Сергия Радонежского в Подмосковье- виртуальное паломничество
Святые источники Сергия Радонежского в Подмосковье- виртуальное паломничество Викторина Знатоки космоса
Викторина Знатоки космоса Синтоизм
Синтоизм Внеклассное мероприятие Необычные церкви и соборы мира
Внеклассное мероприятие Необычные церкви и соборы мира Инновационный менеджмент
Инновационный менеджмент Повторение и обобщение знаний по теме Строение вещества
Повторение и обобщение знаний по теме Строение вещества Как помогать детям учиться
Как помогать детям учиться Вода в атмосфере
Вода в атмосфере