Содержание
- 3. Судьба всосавшихся аминокислот 1) используются на биосинтез белков 2) превращаются в липиды, углеводы 3) окисляются до
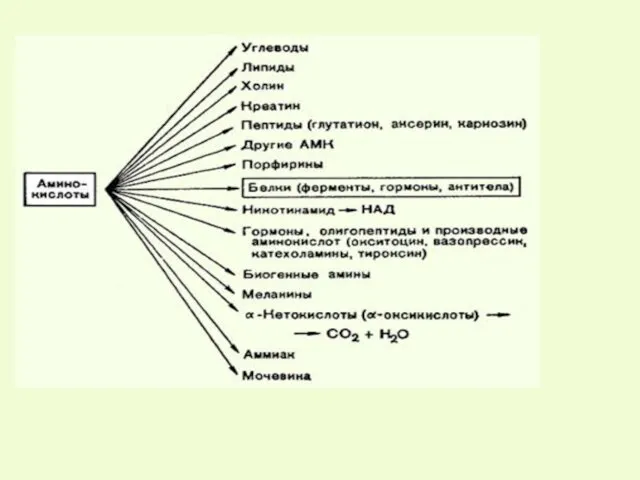
- 4. Синтез креатина Состоит из 2 стадий, используются 3 аминокислоты (аргинин, глицин, метионин) I стадия (в почках)
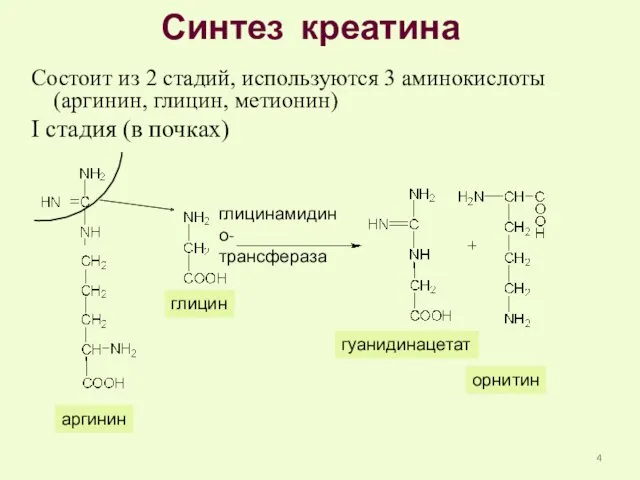
- 5. II стадия (в печени) метилтрансфераза +S- аденозилгомоцистеин гомоцистеин цистеин
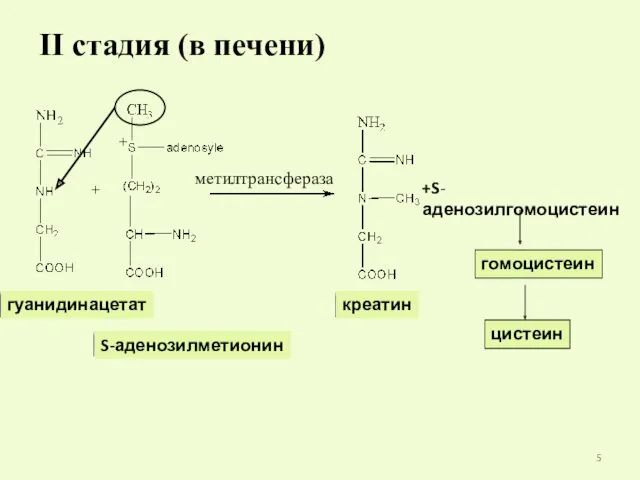
- 6. SАМ- S-аденозилметионин
- 7. SАМ - S-аденозилметионин Это активный метионин, который является донором метильных групп в синтезе различных соединений- креатина,
- 8. Синтез креатина Миоциты скелетных мышц получают АТФ для мышечного сокращения аэробным путем в дыхательной цепи митохондрий.
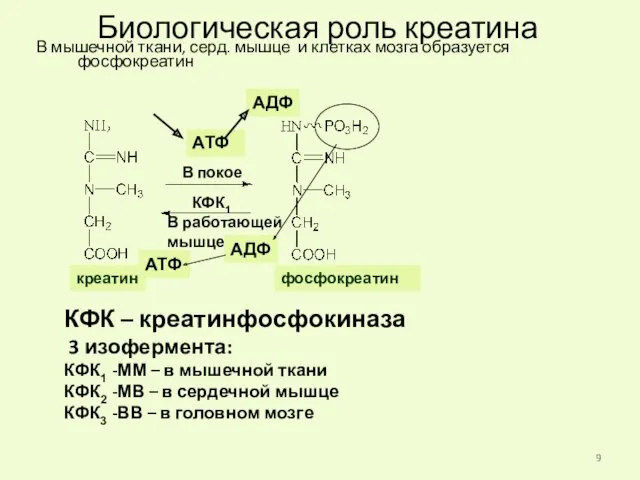
- 9. Биологическая роль креатина В мышечной ткани, серд. мышце и клетках мозга образуется фосфокреатин креатин АТФ АДФ
- 10. фосфокреатин Относится к группе фосфагенов – соединений, резервирующих высокоэнергетические фосфаты. Они поддерживают в мышцах, сердечной мышце,
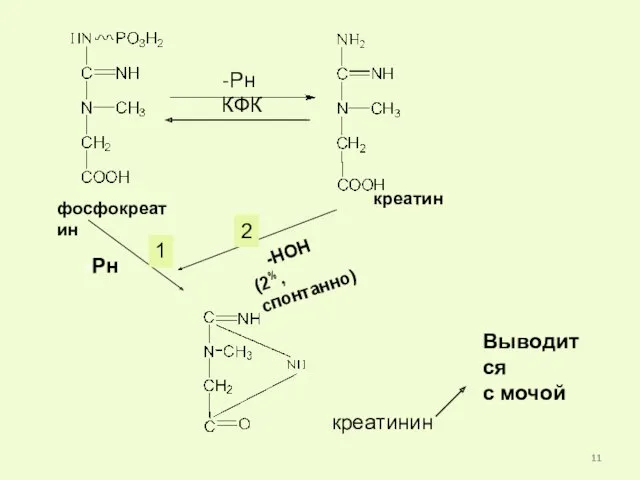
- 11. фосфокреатин Рн КФК Выводится с мочой креатин 1 2 -Рн -НОН (2%, спонтанно) креатинин
- 12. Содержание креатина В плазме крови 15,25 – 76,25 мкмоль/л (0,15 – 0,76 мМ) При повышении более
- 13. Повышение креатина наблюдается при параличах, мышечных дистрофиях, миопатиях. При этом наблюдается нарушение образования фосфокреатина, что ведет
- 14. В норме креатин выделяется с мочой у беременных женщин, а также у детей. Выделение креатинина с
- 15. Креатинин является беспороговым веществом, т.е. он не подвергается реабсорбции. При заболеваниях почек , сопровождающихся нарушением выделительной
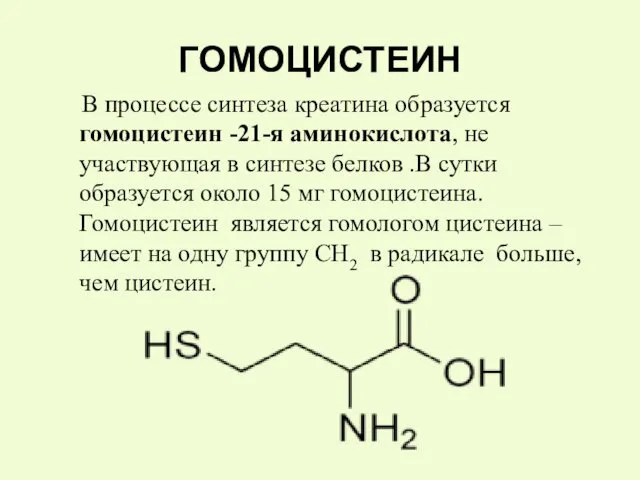
- 16. ГОМОЦИСТЕИН В процессе синтеза креатина образуется гомоцистеин -21-я аминокислота, не участвующая в синтезе белков .В сутки
- 17. ГОМОЦИСТЕИН Повышение ГЦ вызывает повреждение стенки сосудов – «царапание» (не ХС!). Организм устраняет их путем образования
- 18. ГОМОЦИСТЕИН Бетаин –триметилглицин ( в переводе свекла) может функционировать как альтернативный донор метильных групп в превращении
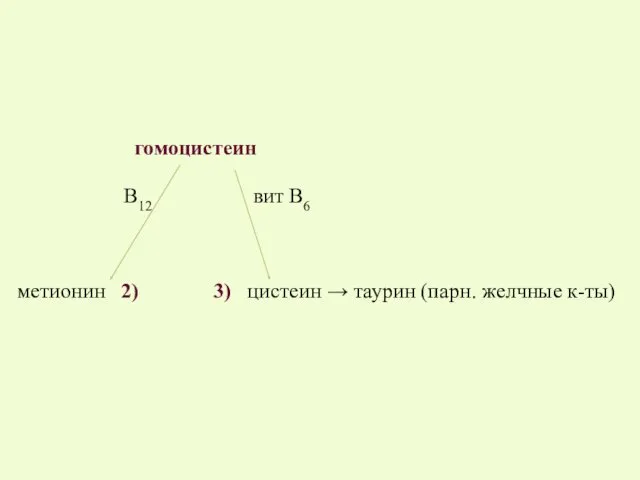
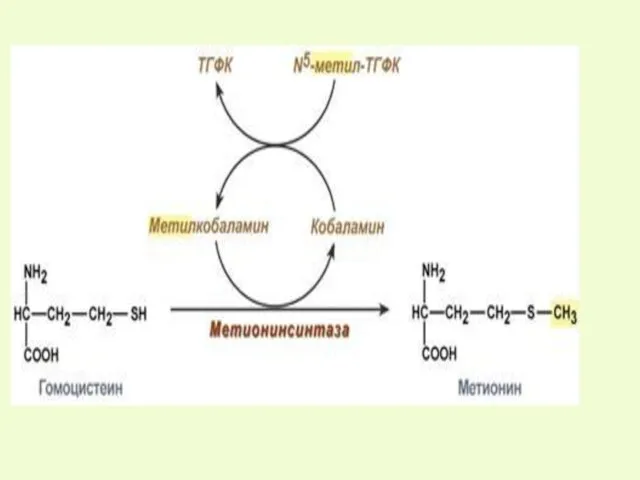
- 19. гомоцистеин В12 вит В6 метионин 2) 3) цистеин → таурин (парн. желчные к-ты)
- 21. Повышение гомоцистеина отмечается: 1. При гиповитаминозах витаминов группы В, вит. В12, заболеваниях почек При повышении гомоцистеина
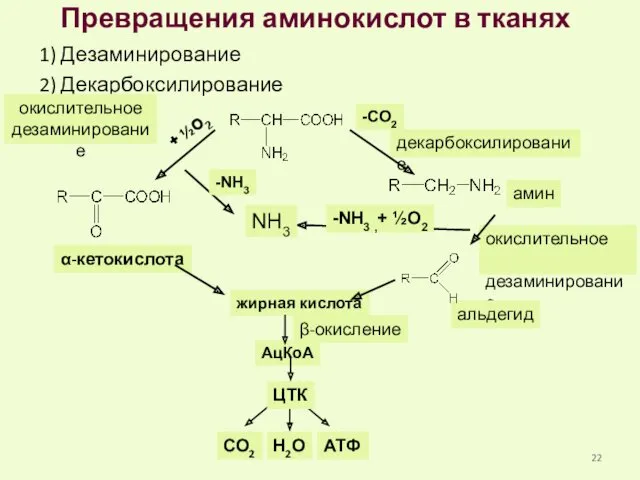
- 22. Превращения аминокислот в тканях 1) Дезаминирование 2) Декарбоксилирование декарбоксилирование окислительное дезаминирование амин окислительное дезаминирование альдегид жирная
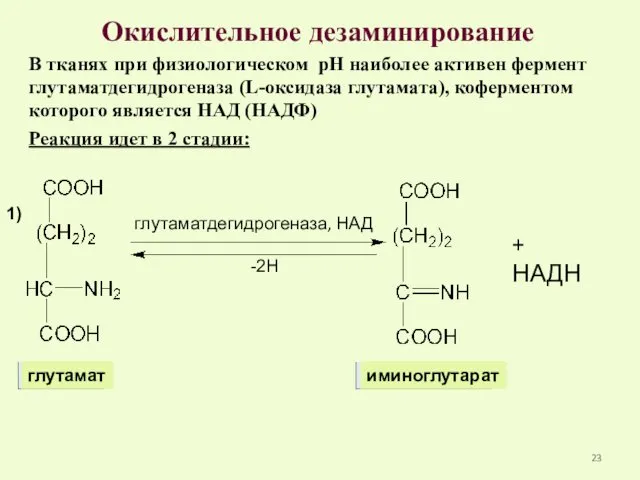
- 23. Окислительное дезаминирование В тканях при физиологическом рН наиболее активен фермент глутаматдегидрогеназа (L-оксидаза глутамата), коферментом которого является
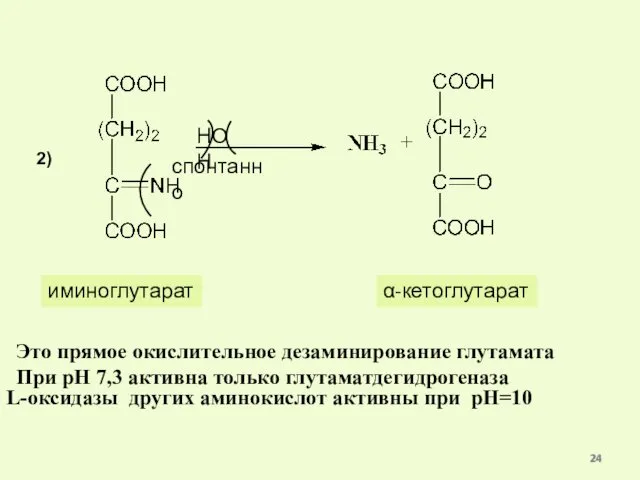
- 24. Это прямое окислительное дезаминирование глутамата При рН 7,3 активна только глутаматдегидрогеназа спонтанно НОН иминоглутарат α-кетоглутарат L-оксидазы
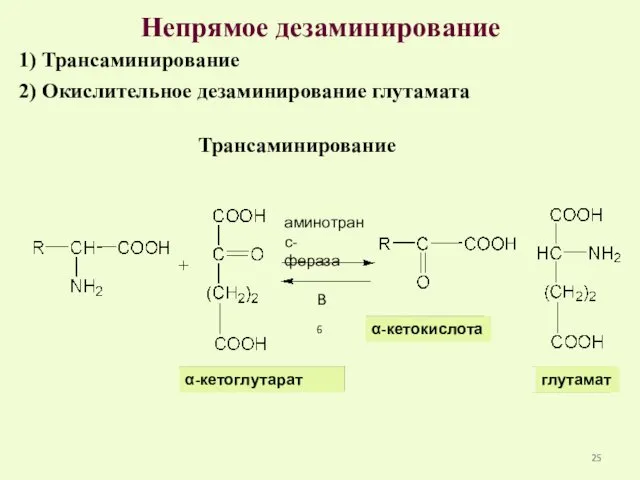
- 25. Непрямое дезаминирование 1) Трансаминирование 2) Окислительное дезаминирование глутамата Трансаминирование аминотранс- фераза B6
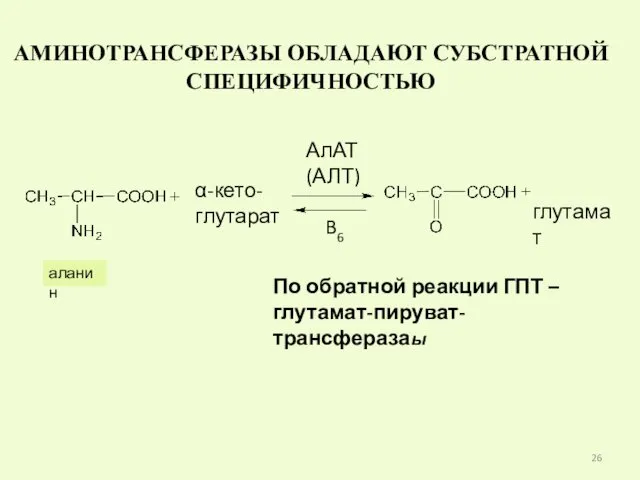
- 26. АМИНОТРАНСФЕРАЗЫ ОБЛАДАЮТ СУБСТРАТНОЙ СПЕЦИФИЧНОСТЬЮ глутамат аланин α-кето- глутарат АлАТ (АЛТ) B6 По обратной реакции ГПТ –
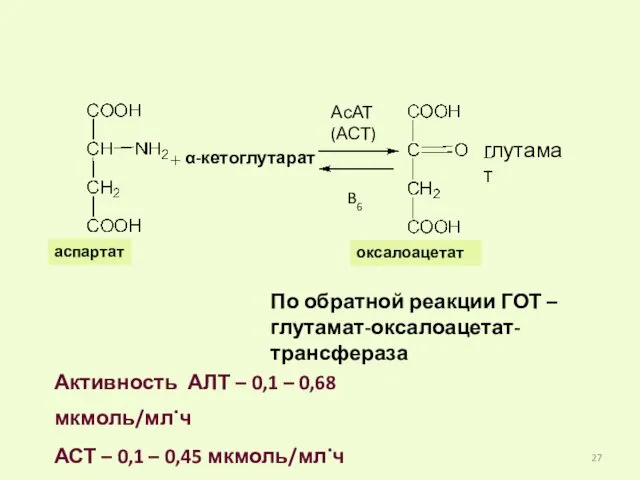
- 27. Активность АЛТ – 0,1 – 0,68 мкмоль/мл.ч АСТ – 0,1 – 0,45 мкмоль/мл.ч аспартат α-кетоглутарат глутамат
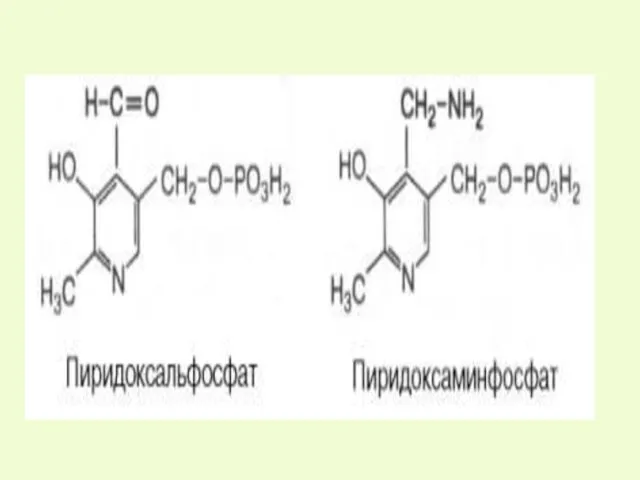
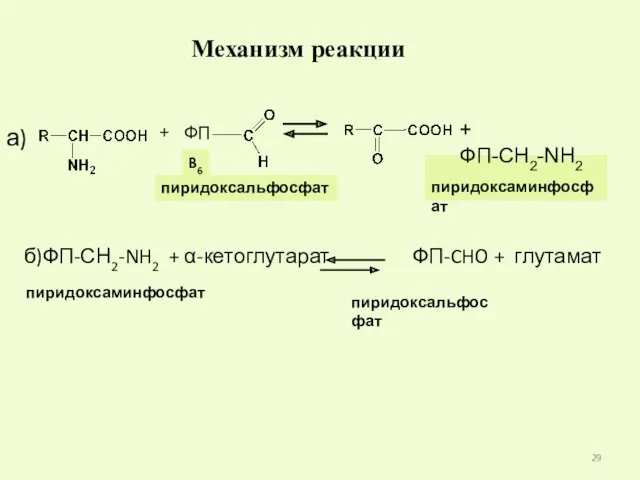
- 29. б)ФП-СН2-NH2 + α-кетоглутарат ФП-CHO + глутамат B6 пиридоксальфосфат пиридоксаминфосфат + ФП + ФП-CH2-NH2 Механизм реакции а)
- 30. Диагностическое значение аминотрансфераз Повышение активности АЛТ наблюдается при гепатите ( не изменяется при желчно-каменной болезни). Повышение
- 31. Биологическая роль трансаминирования 1) Синтез заменимых аминокислот 2) Трансаминирование - I стадия непрямого дезаминирования с образованием
- 32. Источники аммиака 1)Дезаминирование аминокислот (в тканях и толстом кишечнике) 2) Дезаминирование аминов 3) Дезаминирование азотистых оснований
- 33. ПРИЧИНЫ ТОКСИЧНОСТИ АММИАКА 1.Аммиак увеличивает образование глутамата (восстановительное аминирование), что снижает уровень α- кетоглутарата и угнетает
- 34. 3. Накопление иона аммония нарушает трансмембранный транспорт ионов и влияет отрицательно на проведение нервного импульса 4.
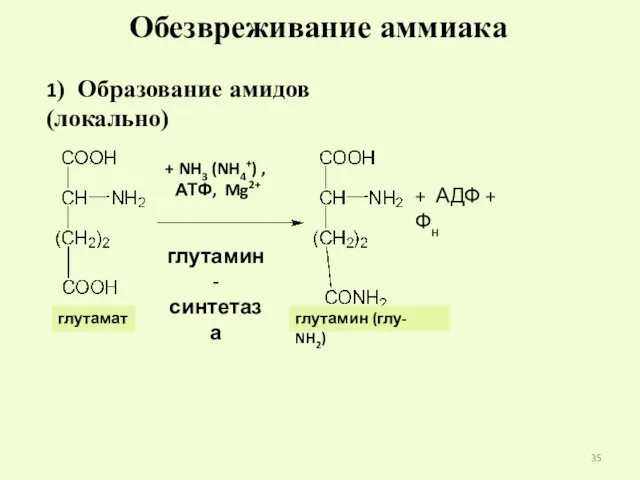
- 35. Обезвреживание аммиака 1) Образование амидов (локально) + NH3 (NH4+) , АТФ, Mg2+ глутамин- синтетаза + АДФ
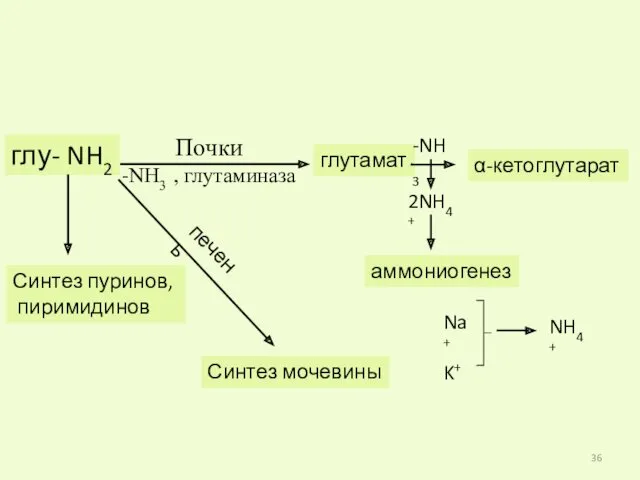
- 36. глу- NH2 Синтез пуринов, пиримидинов печень Синтез мочевины Почки -NH3 , глутаминаза глутамат -NH3 α-кетоглутарат 2NH4+
- 37. 2) восстановительное аминирование 3) образование аммонийных солей 4) синтез мочевины а) α-кетоглутарат NH4+, 2H+,НАДФ глутаматдегидрогеназа (режим
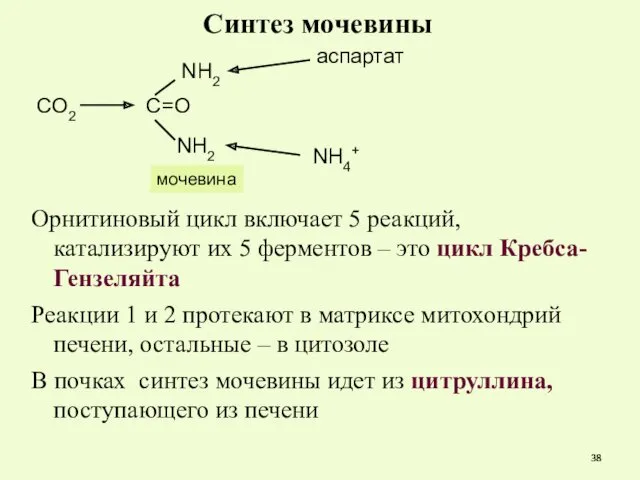
- 38. Синтез мочевины Орнитиновый цикл включает 5 реакций, катализируют их 5 ферментов – это цикл Кребса-Гензеляйта Реакции
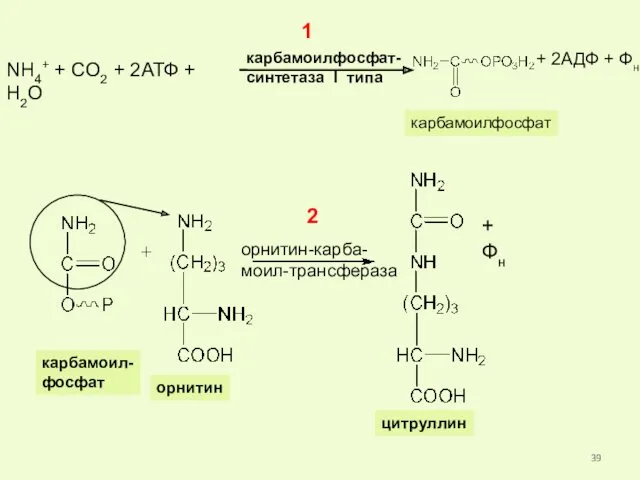
- 39. NH4+ + CO2 + 2АТФ + Н2О карбамоилфосфат- синтетаза I типа карбамоилфосфат + 2АДФ + Фн
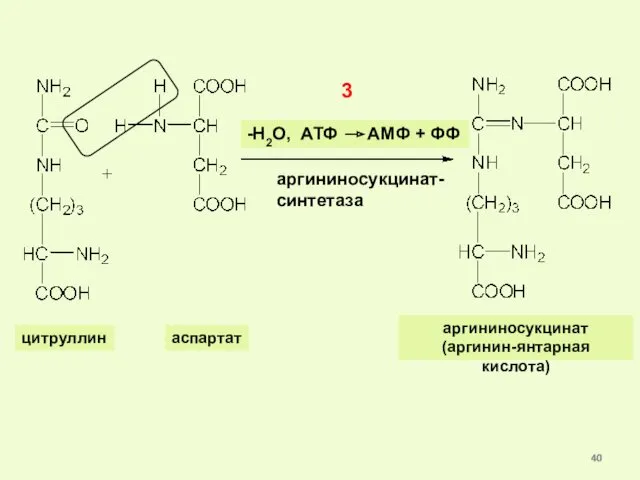
- 40. цитруллин аспартат -Н2О, АТФ АМФ + ФФ 3 аргининосукцинат- синтетаза аргининосукцинат (аргинин-янтарная кислота)
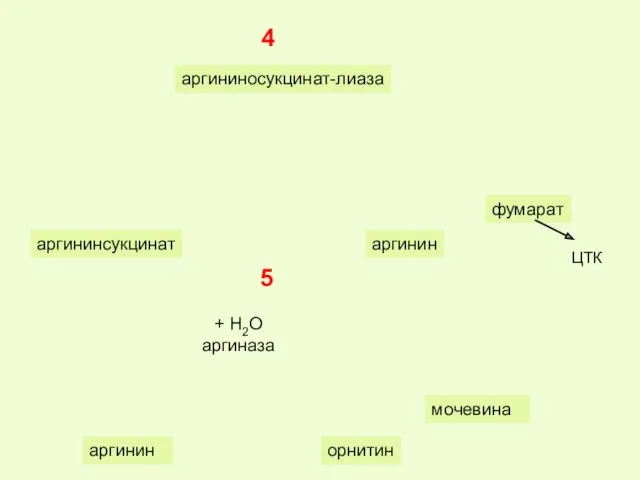
- 41. фумарат ЦТК аргининосукцинат-лиаза аргинин аргининсукцинат + Н2О аргиназа 4 5 мочевина орнитин аргинин
- 42. Связь синтеза мочевины с ЦТК Источником СО2 являются реакции декарбоксилирования в ЦТК Общим продуктом является фумарат
- 43. Суммарное уравнение синтеза мочевины На синтез 1 молекулы мочевины затрачивается 3 АТФ (4 макроэргические связи (3
- 44. Нарушения цикла мочевины Известно 5 наследственных заболеваний, обусловленных дефектом 5 ферментов 1)Гипераммониемия I типа – дефект
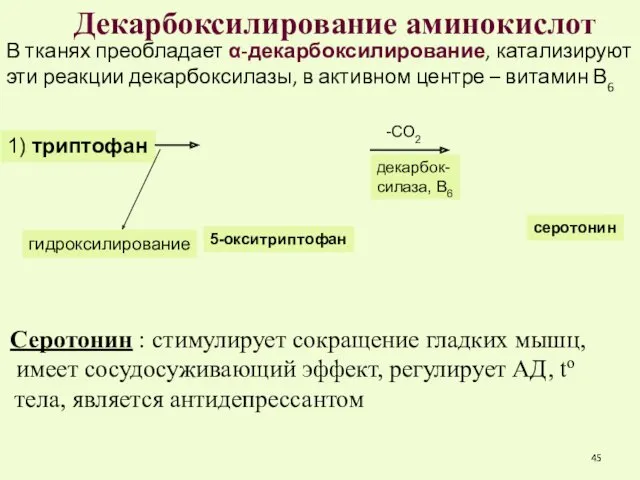
- 45. Декарбоксилирование аминокислот В тканях преобладает α-декарбоксилирование, катализируют эти реакции декарбоксилазы, в активном центре – витамин В6
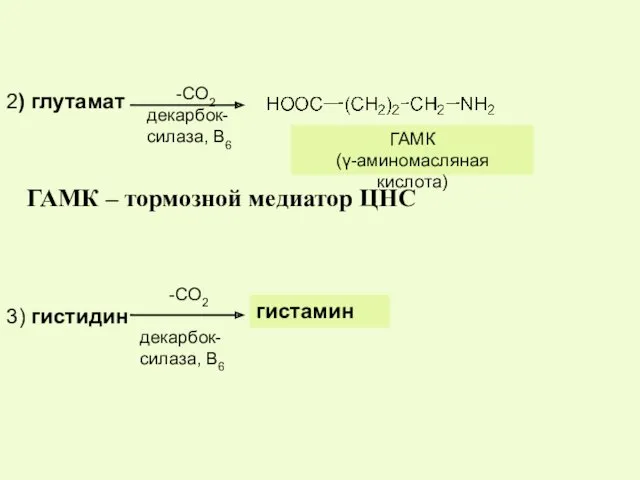
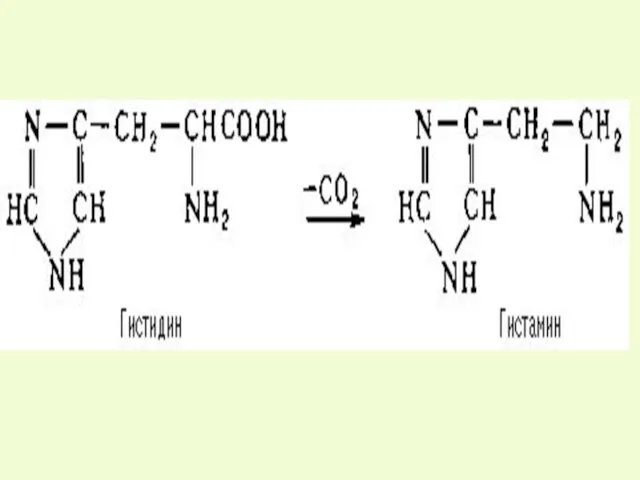
- 46. -СО2 декарбок- силаза, В6 ГАМК (γ-аминомасляная кислота) ГАМК – тормозной медиатор ЦНС -СО2 декарбок- силаза, В6
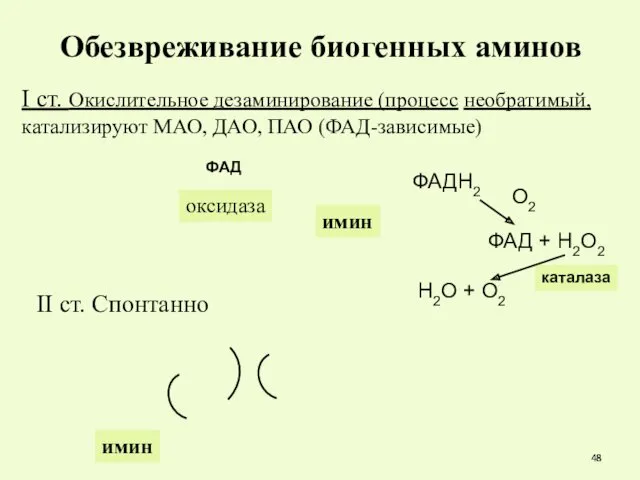
- 48. Обезвреживание биогенных аминов I ст. Окислительное дезаминирование (процесс необратимый, катализируют МАО, ДАО, ПАО (ФАД-зависимые) II ст.
- 49. Обезвреживание биогенных аминов Реакции декарбоксилирования протекают в цитоплазме, а окисление аминов на мембране митохондрий. Первая стадия
- 50. Особенности обмена белков у детей 1.У детей снижена активность ферментов синтеза мочевины –карбамоилфосфатсинтазы, поэтому доля азота
- 52. Скачать презентацию






















 Казахские Ханы
Казахские Ханы Кошки
Кошки BP560X System Application Notes
BP560X System Application Notes Алкалоидтар. Алкалоидтар туралы түсінік
Алкалоидтар. Алкалоидтар туралы түсінік Іріңді тендовагинит
Іріңді тендовагинит Рождество Христово
Рождество Христово Внеклассное мероприятие для учащихся 5 класса Осенние посиделки Диск
Внеклассное мероприятие для учащихся 5 класса Осенние посиделки Диск Холодильник Gorenje
Холодильник Gorenje ХОБЛ – диагностика, лечение
ХОБЛ – диагностика, лечение Что такое колорит? 1 класс
Что такое колорит? 1 класс Здоровый образ жизни
Здоровый образ жизни Презентация к родительскому собранию Роль семьи в воспитании культуры ребенка
Презентация к родительскому собранию Роль семьи в воспитании культуры ребенка Обеспечение эмоционального благополучия в группах детского сада посредством компонентов РППС
Обеспечение эмоционального благополучия в группах детского сада посредством компонентов РППС Классный час Путешествие в стану Добра
Классный час Путешествие в стану Добра Основы исламской культуры
Основы исламской культуры Вusiness for 50 thousand dollars
Вusiness for 50 thousand dollars Органы чувств. Зрительный и слуховой анализаторы. Органы вкуса, обоняния. Кожный покров
Органы чувств. Зрительный и слуховой анализаторы. Органы вкуса, обоняния. Кожный покров Веб-технологии в промышленности и образовании
Веб-технологии в промышленности и образовании Варежки для Дедушки Мороза.
Варежки для Дедушки Мороза. Программа Умник. Фонд содействия инновациям
Программа Умник. Фонд содействия инновациям Философия Фомы Аквинского (томизм)
Философия Фомы Аквинского (томизм) Медико - педагогическое обследование физического развития детей с нарушениями осанки
Медико - педагогическое обследование физического развития детей с нарушениями осанки Способ сложения. Решение задач с помощью систем уравнений
Способ сложения. Решение задач с помощью систем уравнений Рациональное питание
Рациональное питание Сказочная безопасность
Сказочная безопасность Технологический процесс изготовления компьютерного стола
Технологический процесс изготовления компьютерного стола Пособие для логопедов, воспитателей, родителей Мимическая гимнастика
Пособие для логопедов, воспитателей, родителей Мимическая гимнастика Космодром Плесецк
Космодром Плесецк