Содержание
- 2. РЕМОНТ Молекулярно-кинетическая теория (МКТ) - теория, объясняющая строение и свойства тел движением и взаимодействием частиц, из
- 3. РЕМОНТ Основатель атомизма –
- 4. РЕМОНТ Демокрит: все существующее состоит из атомов и пустоты. Атомы - это неделимые плотные частицы. Они
- 5. РЕМОНТ Основные представления, высказанные Ломоносовым, были в дальнейшем развиты Л.Больцманом, Р.Клазиусом, Д.Максвеллом, Л.Гей-Люссаком, А.Авогадро и др.
- 6. РЕМОНТ Основные положения МКТ: все тела состоят из частиц, разделенных промежутками; частицы вещества находятся в непрерывном
- 7. РЕМОНТ Дробление вещества Растворение веществ 3. Испарение жидкостей 4. Расширение тел при нагревании 5.Сжатие, растяжение Обоснование
- 8. РЕМОНТ Современный растровый электронный микроскоп увеличивает объект в 1 000 000 раз.
- 9. РЕМОНТ МЕХАНИКА - это наука о движении и взаимодействии тел
- 10. РЕМОНТ Атомы золота Атомы кобальта Атомы никеля Атомы платины Атомы углерода Атомы кремния
- 11. РЕМОНТ Атом - мельчайшая частица химического элемента. Размеры атома - 10-10 м. Атом электрически нейтрален. Атом
- 12. РЕМОНТ Самые распространенные атомы Во Вселенной: атомы H, атомы He (99%) В земной коре: атомы О,
- 13. РЕМОНТ Молекула – наименьшая устойчивая частица данного вещества, обладающая его химическими свойствами. Размеры молекул 10-10–10-7 м.
- 14. РЕМОНТ Моль – это количество вещества, содержащее столько же частиц (молекул), сколько содержится атомов в 0,012
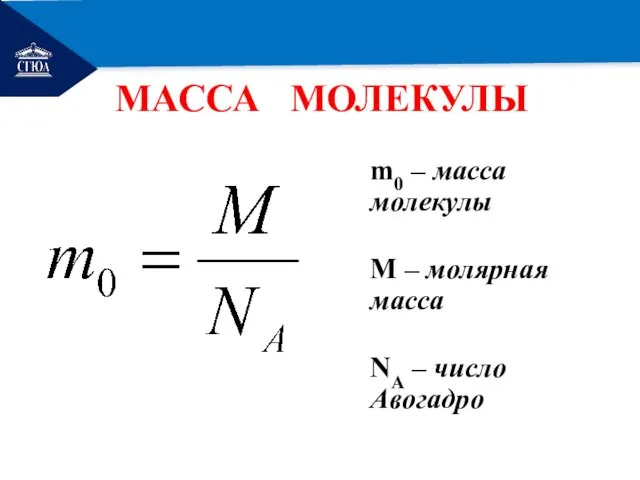
- 15. РЕМОНТ МАССА МОЛЕКУЛЫ m0 – масса молекулы М – молярная масса NА – число Авогадро
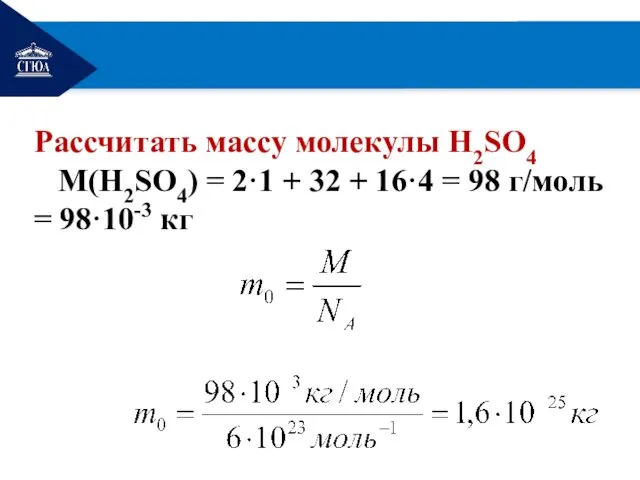
- 16. РЕМОНТ Рассчитать массу молекулы Н2SО4 М(Н2SО4) = 2·1 + 32 + 16·4 = 98 г/моль =
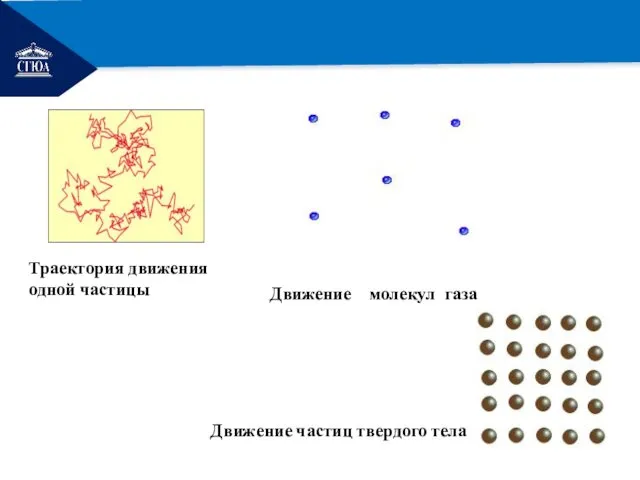
- 17. РЕМОНТ Траектория движения одной частицы Движение молекул газа Движение частиц твердого тела
- 18. РЕМОНТ Доказательство 2 положения МКТ Броуновское движение – тепловое движение взвешенных в жидкости или газе частиц
- 19. РЕМОНТ 2. Диффузия — процесс самопроизвольного распространения вещества из области с высокой концентрацией в область с
- 20. РЕМОНТ Молекулы (атомы) вещества всегда находятся в постоянном беспорядочном движении. Такое движение называют тепловым. Скорость теплового
- 21. РЕМОНТ Обоснование 3 положения МКТ На расстоянии 10-9 м молекулы притягиваются. На меньшем расстоянии дальнейшее сближение
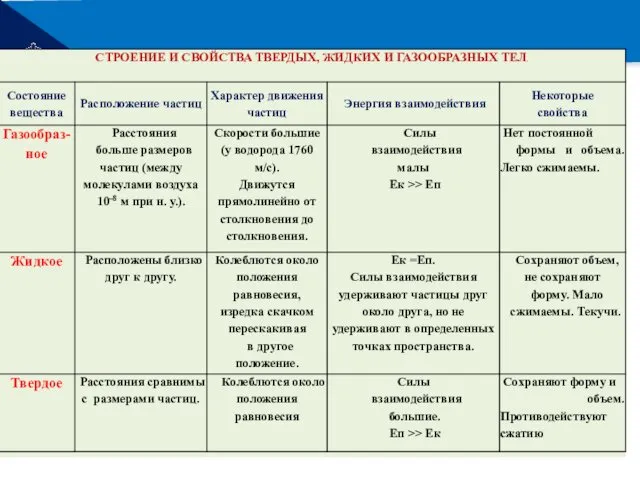
- 22. РЕМОНТ Строение и свойства газообразных, жидких и твердых тел
- 23. РЕМОНТ
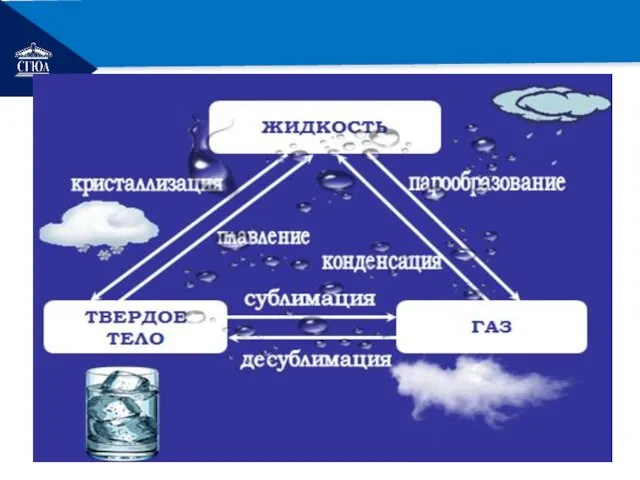
- 24. РЕМОНТ Переход вещества из одного состояния в другое
- 25. РЕМОНТ
- 26. РЕМОНТ Молекулярно-кинетическая теория газов
- 27. РЕМОНТ Для выяснения закономерностей, которым подчиняется вещество в газообразном состоянии, было введено понятие идеального газа. Идеальный
- 28. РЕМОНТ Для нахождения микроскопических параметров газа нужны измерения величины, связанной со средней кинетической энергией молекул –
- 29. РЕМОНТ Основное кинетическое уравнение МКТ устанавливает связь между макро- и микропараметрами газа. Давление идеального газа -
- 30. РЕМОНТ Ек – кинетическая энергия k – постоянная Больцмана k=1,38•10-23 Дж/К Т – абсолютная температура Связь
- 31. РЕМОНТ
- 32. РЕМОНТ Почему броуновское движение особенно заметно у наиболее мелких взвешенных частичек, а у более крупных оно
- 33. РЕМОНТ Газовые законы
- 34. РЕМОНТ Всякое изменение параметров состояния тела (Т, Р, V) называется термодинамическим процессом. Процесс, при котором один
- 35. РЕМОНТ Изотермический процесс. Закон Бойля-Мариотта При постоянной температуре давление данной массы газа обратно пропорционально его объёму.
- 36. РЕМОНТ Изобарный процесс Закон Гей - Люссака Объем данной массы газа при постоянном давлении прямо пропорционален
- 37. РЕМОНТ Изохорный процесс Закон Шарля Давление данной массы газа при постоянном объёме прямо пропорционально температуре
- 38. РЕМОНТ УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА уравнение, связывающее P, V, T и характеризующее состояние данной системы газа.
- 39. РЕМОНТ Если бы в результате какой-то мировой катастрофы все накопленные научные знания оказались бы уничтожены, …то
- 41. Скачать презентацию

































 20231017_morfologicheskie_priznaki
20231017_morfologicheskie_priznaki Личный бренд педагога как способ показать свою экспертность
Личный бренд педагога как способ показать свою экспертность Транспортная система РФ. Становление и развитие железнодорожного транспорта. Образование ОАО РЖД
Транспортная система РФ. Становление и развитие железнодорожного транспорта. Образование ОАО РЖД Прогностически неблагоприятные аллергозы
Прогностически неблагоприятные аллергозы Апаратура обчислювальних засобів. Пристрій управління висотомірами (Заняття № 7.22)
Апаратура обчислювальних засобів. Пристрій управління висотомірами (Заняття № 7.22) Мутационная изменчивость
Мутационная изменчивость Осень, осень золотая!
Осень, осень золотая! Tax elements
Tax elements Функция, ее свойства и график
Функция, ее свойства и график Щелочные металлы. Презентация, 9 класс
Щелочные металлы. Презентация, 9 класс Ассамблеи и гулянья в эпоху Петра
Ассамблеи и гулянья в эпоху Петра Главный шаблон Remon
Главный шаблон Remon Об основных проектных решениях по контактной сети для ВСМ Москва – Казань
Об основных проектных решениях по контактной сети для ВСМ Москва – Казань Pilot. The profession
Pilot. The profession Шизофрения. Клинические формы и течение
Шизофрения. Клинические формы и течение Артефакты Древнего Египта
Артефакты Древнего Египта Презентация к уроку по ОРКСиЭ Россия - наша Родина
Презентация к уроку по ОРКСиЭ Россия - наша Родина Анализ текста В.А. Солоухина Трава
Анализ текста В.А. Солоухина Трава Особенности прокладки трубопроводов под водными преградами
Особенности прокладки трубопроводов под водными преградами Сценарий праздника 23 февраля Мы будущие защитники Диск
Сценарий праздника 23 февраля Мы будущие защитники Диск О Себе
О Себе Борьба России со Швецией
Борьба России со Швецией Тісті ағарту. Көрсетілімдер, құралдар,әдістер
Тісті ағарту. Көрсетілімдер, құралдар,әдістер Консультация для родителей: Речевое развитие детей 2 – 3 лет
Консультация для родителей: Речевое развитие детей 2 – 3 лет Методы управления в правоохранительных органах
Методы управления в правоохранительных органах Гемофилия. Наследственные коагулопатии
Гемофилия. Наследственные коагулопатии Высокие результаты учебных достижений обучающихся
Высокие результаты учебных достижений обучающихся Международный день охраны памятников и исторических мест
Международный день охраны памятников и исторических мест