Содержание
- 2. 1-Е ПОЛОЖЕНИЕ ТЭД. Все вещества по их способности проводить электрический ток в растворах делятся на электролиты
- 3. ВЕЩЕСТВА В РАСТВОРАХ Электролиты (водные растворы проводят эл.ток) Неэлектролиты (водные растворы не проводят эл. ток) Вещества
- 4. ЗАДАНИЯ К I-МУ ПОЛОЖЕНИЮ ТЭД Укажите вид связи и принадлежность данных веществ к электролитам и неэлектролитам:
- 5. II-Е ПОЛОЖЕНИЕ ТЭД В РАСТВОРАХ ЭЛЕКТРОЛИТЫ ДИССОЦИИРУЮТ, Т.Е. РАСПАДАЮТСЯ НА ИОНЫ. Ионы – ЭТО ПОЛОЖИТЕЛЬНО ИЛИ
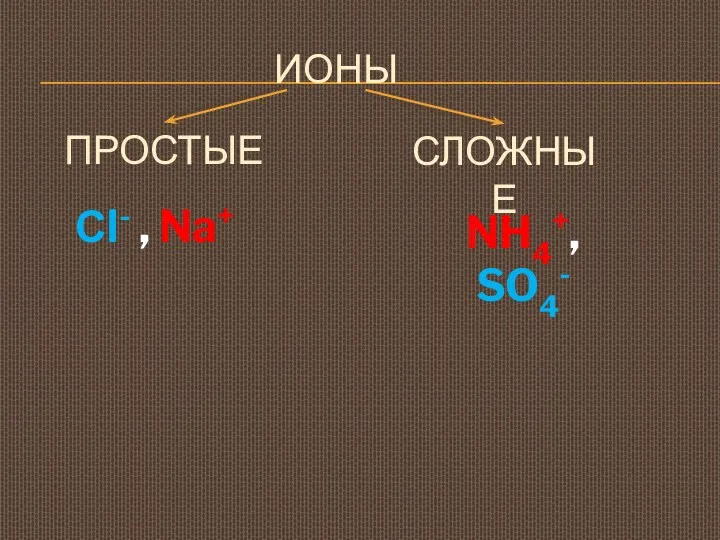
- 6. ИОНЫ ПРОСТЫЕ Сl- , Na+ СЛОЖНЫЕ NH4+, SO4-
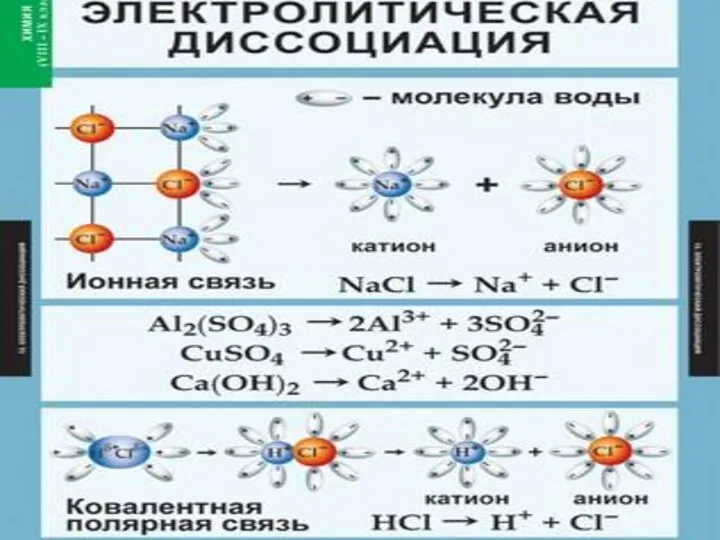
- 7. III-Е ПОЛОЖЕНИЕ ТЭД ПРИЧИНОЙ ДИССОЦИАЦИИ ЭЛЕКТРОЛИТА ЯВЛЯЕТСЯ ЕГО ВЗАИМОДЕЙСТВИЕ С МОЛЕКУЛАМИ ВОДЫ (ГИДРАТАЦИЯ). Вещества с ионной
- 9. IV-Е ПОЛОЖЕНИЕ ТЭД Под действием электрического тока положительные ионы движутся к катоду и называются катионами, а
- 10. Типы ионов По заряду: положительные, или катионы: Катионы металлов ( Мn+ ) Катион водорода (H+) Катион
- 11. Упрощённо процесс диссоциации изображают с помощью уравнений диссоциации: NaCl = Na+ + Cl- HCl = H+
- 12. ЗАДАНИЯ КО II-МУ ПОЛОЖЕНИЮ ТЭД Назовите частицы: а) H, H2 , H+ ; б) Cl2 ,
- 13. V-Е ПОЛОЖЕНИЕ ТЭД Разные электролиты по-разному диссоциируют на ионы и поэтому делятся на: Сильные (соли, щелочи,
- 14. VI-Е ПОЛОЖЕНИЕ ТЭД Свойства растворов электролитов определяются свойствами тех ионов, которые они образуют при диссоциации. По
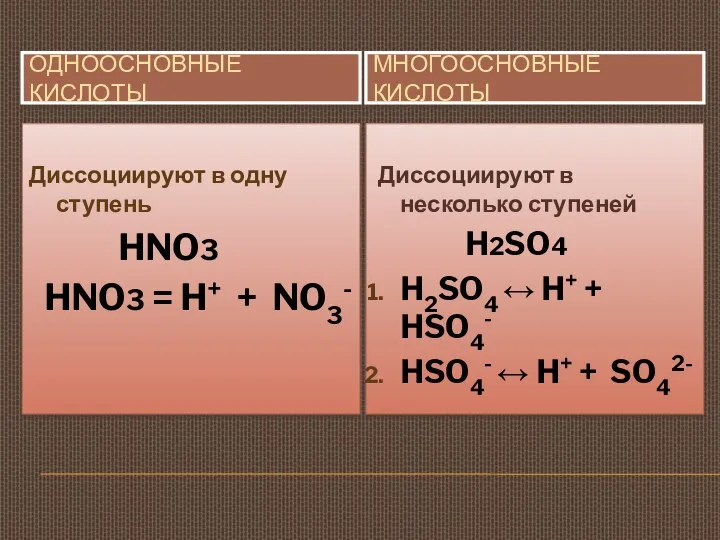
- 15. ОДНООСНОВНЫЕ КИСЛОТЫ МНОГООСНОВНЫЕ КИСЛОТЫ Диссоциируют в одну ступень HNO3 HNO3 = H+ + NO3- Диссоциируют в
- 16. 2. ОСНОВАНИЯ – ЭТО ЭЛЕКТРОЛИТЫ, КОТОРЫЕ ДИССОЦИИРУЮТ НА КАТИОНЫ МЕТАЛЛА И АНИОНЫ ГИДРОКСОГРУПП ОДНОКИСЛОТНЫЕ ОСНОВАНИЯ МНОГОКИСЛОТНЫЕ
- 17. 3. СОЛИ – ЭТО ЭЛЕКТРОЛИТЫ, КОТОРЫЕ ДИССОЦИИРУЮТ НА КАТИОНЫ МЕТАЛЛА И АНИОНЫ КИСЛОТНОГО ОСТАТКА Независимо от
- 18. ЗАДАНИЕ К 6-МУ ПОЛОЖЕНИЮ Напишите уравнения диссоциации следующих веществ: HCl, H3PO4, KOH
- 20. Скачать презентацию














 Открытка к Дню защитника Отечества
Открытка к Дню защитника Отечества Свойства параллельных плоскостей
Свойства параллельных плоскостей Танцы народов Кавказа
Танцы народов Кавказа Разложение многочленов на множители
Разложение многочленов на множители презентация Фронтовая тетрадь- песенник Трифонова С.И.
презентация Фронтовая тетрадь- песенник Трифонова С.И. Развитие чувства времени у детей старшего дошкольного возраста
Развитие чувства времени у детей старшего дошкольного возраста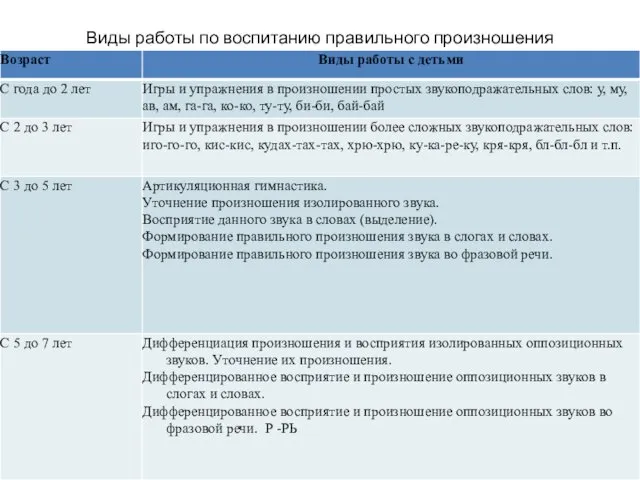 Виды работы по воспитанию правильного произношения
Виды работы по воспитанию правильного произношения Отгадай слово по первым звукам
Отгадай слово по первым звукам Реформы в 1900 – 1912 гг
Реформы в 1900 – 1912 гг Электрические трансформаторы. Расчет трансформаторов
Электрические трансформаторы. Расчет трансформаторов класс Вред
класс Вред Морфологический разбор имени существительного
Морфологический разбор имени существительного Инструктаж по ТБ и ОТ. Введение: инструктаж, знакомство
Инструктаж по ТБ и ОТ. Введение: инструктаж, знакомство Прсоединение Крыма к России
Прсоединение Крыма к России Каменный век на Кавказе
Каменный век на Кавказе Контроль за точністю руху сільськогосподарської техніки та обладнання
Контроль за точністю руху сільськогосподарської техніки та обладнання К. Паустовский Теплый хлеб
К. Паустовский Теплый хлеб Анализ работы фонда скважин Сологаевского месторождения пласта Д
Анализ работы фонда скважин Сологаевского месторождения пласта Д Мастер-класс Использование технологии развития критического мышления через чтение и письмо на примере урока чтения во 2 классе по теме В. Драгунский Заколдованная буква
Мастер-класс Использование технологии развития критического мышления через чтение и письмо на примере урока чтения во 2 классе по теме В. Драгунский Заколдованная буква Microsoft Word. Создание первого документа Word
Microsoft Word. Создание первого документа Word практические работы
практические работы Цели компании Coca-Cola
Цели компании Coca-Cola Презентация Дифференциация звуков Б-П
Презентация Дифференциация звуков Б-П مهارات الحاسب الآلي
مهارات الحاسب الآلي Презентация Петр Великий
Презентация Петр Великий Авраам Линкольн
Авраам Линкольн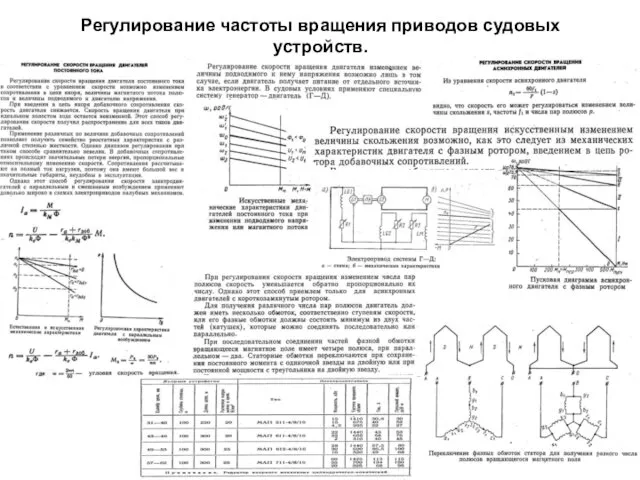 Регулирование частоты вращения приводов судовых устройств. Техническое обслуживание Дизель-генераторов. (Билет 30)
Регулирование частоты вращения приводов судовых устройств. Техническое обслуживание Дизель-генераторов. (Билет 30) Путешествие в космос
Путешествие в космос