Содержание
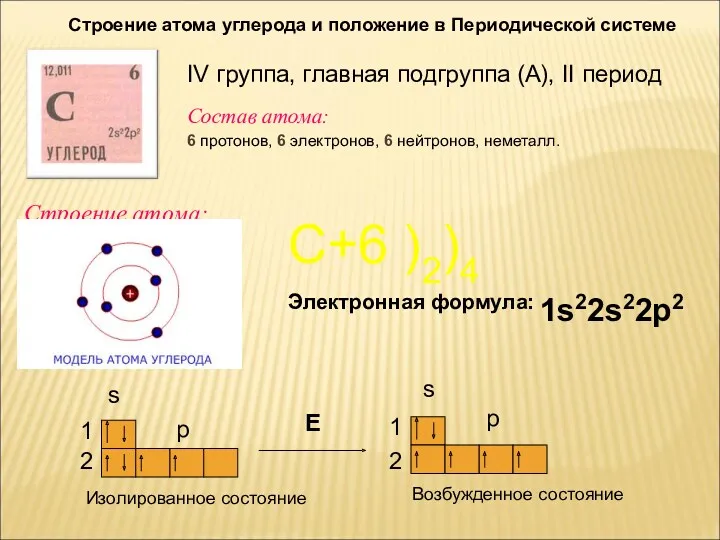
- 2. Состав атома: 6 протонов, 6 электронов, 6 нейтронов, неметалл. Строение атома: Строение атома углерода и положение
- 3. АЛЛОТРОПНЫЕ ВИДОИЗМЕНЕНИЯ УГЛЕРОДА Химический элемент углерод образует несколько простых веществ, основные из которых алмаз и графит.
- 4. Алмаз Бесцветный Прозрачный Не проводит электрический ток Прочный Твердый Он в чистом виде черный, мрачный, Неплавкий
- 5. Твёрдость алмаза (эталон твёрдости) обусловлена структурой его атомной кристаллической решётки: Применение: в ювелирном деле, для изготовления
- 6. Графит Тёмно-серый Жирный на ощупь Мягкий Непрозрачный Теплопроводный Электропроводный Мягкость графита обусловлена слоистой структурой Алмазы, полученные
- 7. Сходное с графитом строение имеют сажа и древесный уголь. Древесный уголь получают при сухой перегонке древесины.
- 8. ХИМИЧЕСКИЕ СВОЙСТВА УГЛЕРОДА 1. окислительные – атомы С принимают четыре электрона, приобретают при этом степень окисления
- 9. При нагревании углерод соединяется с кислородом, образуя оксид углерода (IV), или углекислый газ: С + O2
- 10. С металлами углерод при нагревании образует карбиды : 4Al +3C=Al4C3 карбид алюминия Более известный карбид –
- 12. Скачать презентацию








 Нравственные диллемы начальной школы
Нравственные диллемы начальной школы Сосуды города
Сосуды города А.В.Суворов- гений военного искусства.
А.В.Суворов- гений военного искусства. Почему мы играем в ЛЕГО
Почему мы играем в ЛЕГО Полевые транзисторы
Полевые транзисторы ГБПОУ НАТК. Портфолио. Профессиональный модуль ПМ. 04
ГБПОУ НАТК. Портфолио. Профессиональный модуль ПМ. 04 Триггеры, сумматоры
Триггеры, сумматоры Definitions of motivation
Definitions of motivation Коррекция фонематической дислексии
Коррекция фонематической дислексии Организация профориентационной работы: опыт, проблемы, перспективы
Организация профориентационной работы: опыт, проблемы, перспективы Тепломассообмен. Расчёт теплообменных аппаратов. (Лекция 14)
Тепломассообмен. Расчёт теплообменных аппаратов. (Лекция 14) Социальная сфера жизни общества
Социальная сфера жизни общества Познавательное мероприятие для младших школьников Жизнь без опасности
Познавательное мероприятие для младших школьников Жизнь без опасности Материалы по внесению изменений в ПЗЗ в части технико-экономических показателей и ВРИ по объекту
Материалы по внесению изменений в ПЗЗ в части технико-экономических показателей и ВРИ по объекту Оказание первой доврачебной помощи
Оказание первой доврачебной помощи Подключение к Tele2. Тарифы и услуги
Подключение к Tele2. Тарифы и услуги Пародонтологиядағы иммунотерапия
Пародонтологиядағы иммунотерапия Тромбоцитопеническая пурпура (ТПП)
Тромбоцитопеническая пурпура (ТПП) Padezhi_imen_suschestvitelnykh
Padezhi_imen_suschestvitelnykh Методические разработки уроков, полевых практик и лабораторных работ. 8класс
Методические разработки уроков, полевых практик и лабораторных работ. 8класс Психология рекламы
Психология рекламы Capitolul III. Logistica în amonte
Capitolul III. Logistica în amonte Мониторинг уровня сформированности у детей коммуникативных умений
Мониторинг уровня сформированности у детей коммуникативных умений Ноотропы
Ноотропы Учебный тренажёр и проверочный тест по теме: Члены предложения
Учебный тренажёр и проверочный тест по теме: Члены предложения Презентация Детям о дне Победы
Презентация Детям о дне Победы Бурибаевская солнечная электростанция
Бурибаевская солнечная электростанция Структура образовательной деятельности (занятий) в соответствий с ФГОС в ДО
Структура образовательной деятельности (занятий) в соответствий с ФГОС в ДО