Содержание
- 2. ВОПРОСЫ: Периодический закон. Период. Как и почему изменяются свойства в периоде? 4. Физический смысл номера периода.
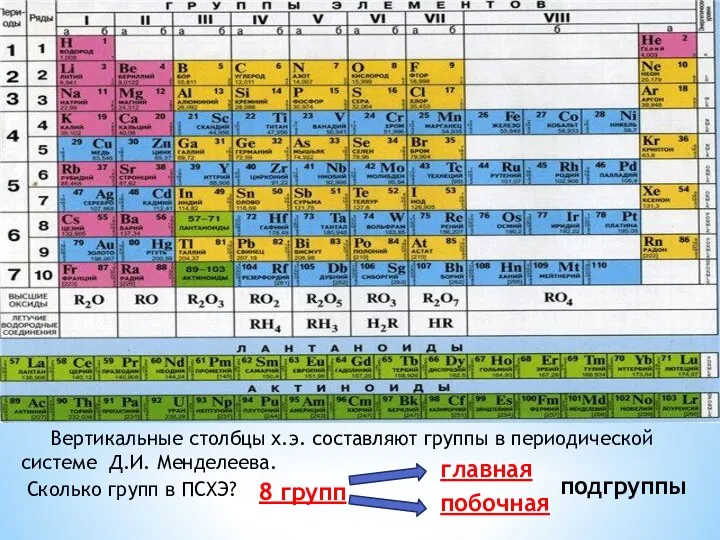
- 3. Вертикальные столбцы х.э. составляют группы в периодической системе Д.И. Менделеева. Сколько групп в ПСХЭ? 8 групп
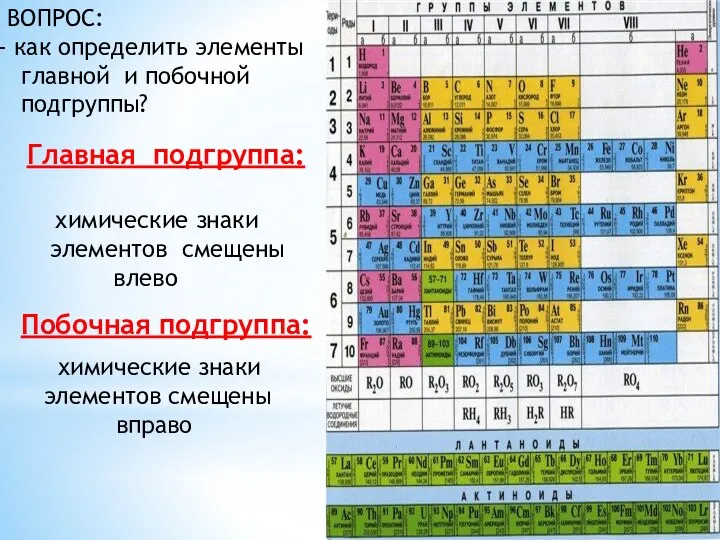
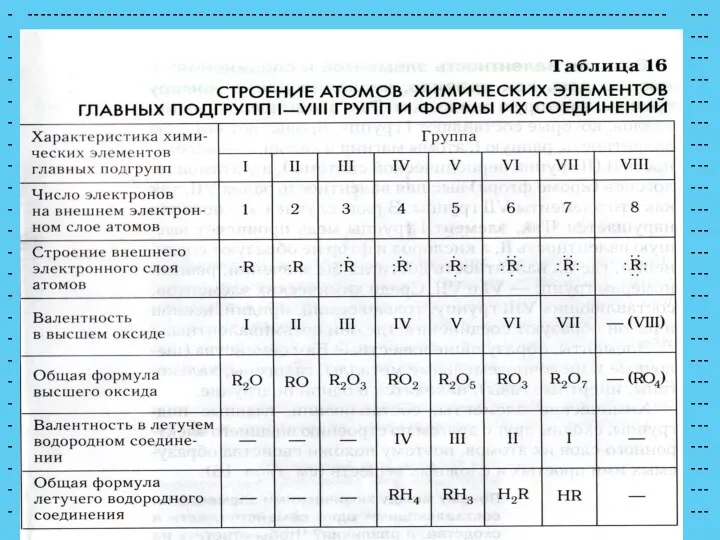
- 4. ВОПРОС: как определить элементы главной и побочной подгруппы? химические знаки элементов смещены влево химические знаки элементов
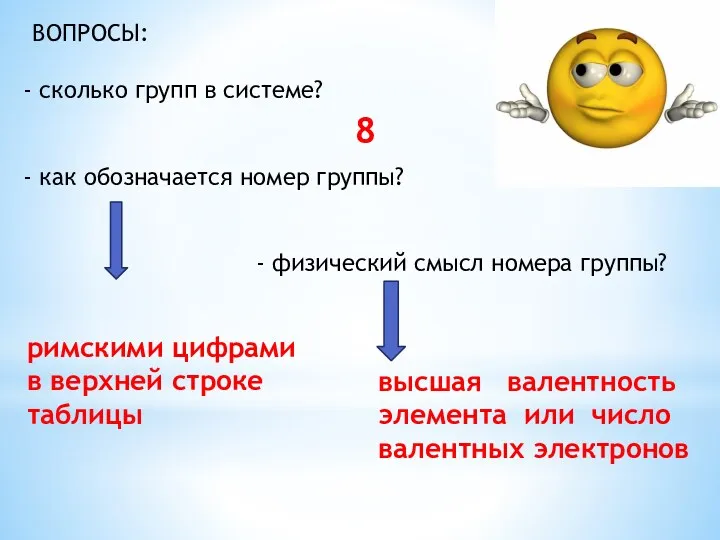
- 5. ВОПРОСЫ: сколько групп в системе? как обозначается номер группы? - физический смысл номера группы? 8 римскими
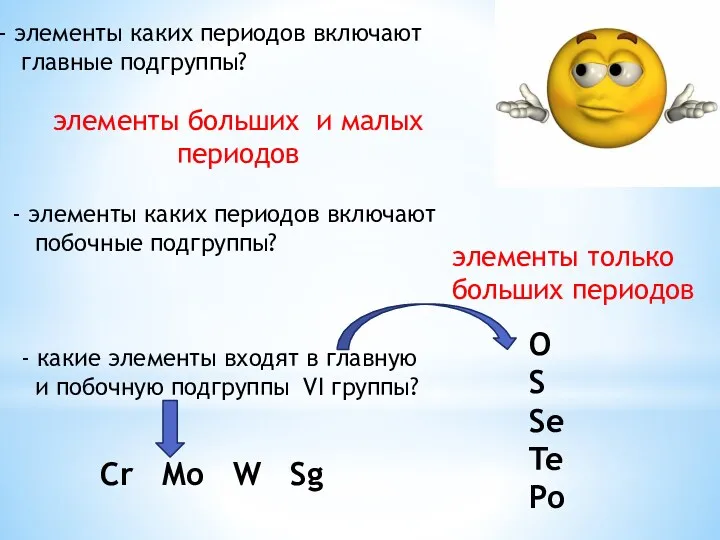
- 6. элементы каких периодов включают побочные подгруппы? - какие элементы входят в главную и побочную подгруппы VI
- 7. ------------------------ ------------------------------------------------------------------------ -------------------------------------------------------------------------------------------------
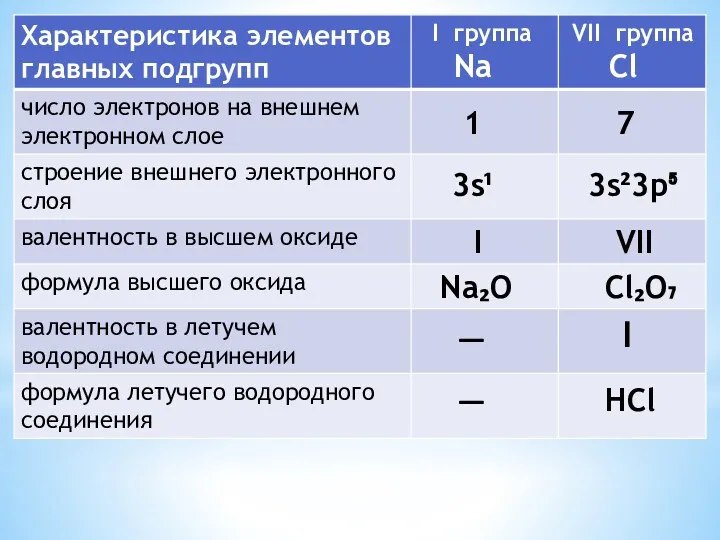
- 8. 1 7 3s¹ 3s²3p⁵ I VII Na₂O Cl₂O₇ — I — HCl
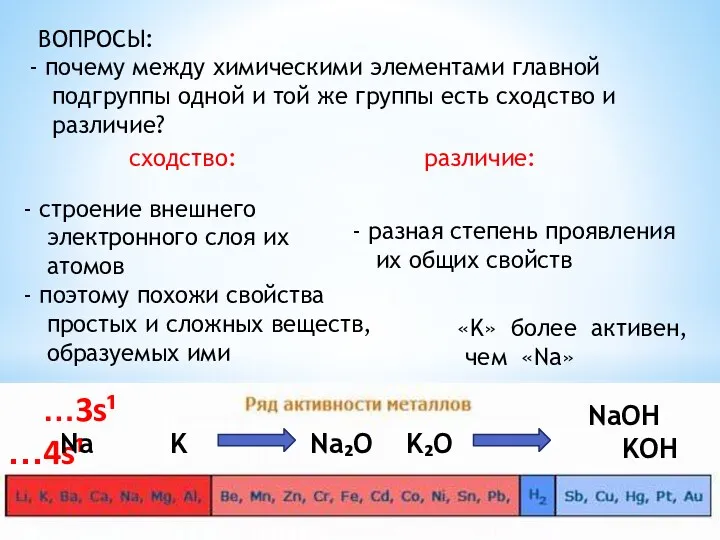
- 9. ВОПРОСЫ: почему между химическими элементами главной подгруппы одной и той же группы есть сходство и различие?
- 10. Как изменяется радиус атомов в группах (главных подгруппах)? радиусы атомов увеличиваются сверху вниз, так как растет
- 11. - вертикальный ряд элементов, в котором сверху вниз увеличивается порядковый номер элемента и заряд ядра атома;
- 13. Скачать презентацию



 Семинар родительского собрания
Семинар родительского собрания Ситуация на рынке жилой недвижимости
Ситуация на рынке жилой недвижимости Безопасность на железнодорожном транспорте
Безопасность на железнодорожном транспорте Возрастной портрет старшего дошкольника
Возрастной портрет старшего дошкольника Женская половая система. Гистология
Женская половая система. Гистология Метаболизм лекарственных препаратов
Метаболизм лекарственных препаратов Правописание НЕ с разными частями речи
Правописание НЕ с разными частями речи Мал суару қөздері
Мал суару қөздері Нормативы качества окружающей среды. Лекция 2.1
Нормативы качества окружающей среды. Лекция 2.1 Создание однотабличной базы данных
Создание однотабличной базы данных Оценка конкурентоспособности предприятия (ООО Мехофф)
Оценка конкурентоспособности предприятия (ООО Мехофф) Особо охраняемые природные территории Киришского района
Особо охраняемые природные территории Киришского района Опробование. Основные понятия
Опробование. Основные понятия Несуча здатність залізобетонних конструкцій підсилених нарощуванням
Несуча здатність залізобетонних конструкцій підсилених нарощуванням Резание (резка) стали
Резание (резка) стали Конный туризм и полевые выезды в России
Конный туризм и полевые выезды в России Марк Ротко. Эдвард Хоппер
Марк Ротко. Эдвард Хоппер Проект Чистый родник
Проект Чистый родник TRR Presentations Suggestions
TRR Presentations Suggestions Численное моделирование теплообмена в ТВС реактора БН-1200
Численное моделирование теплообмена в ТВС реактора БН-1200 Конспект интегрированного занятия по развитию речи для детей младшего дошкольного возраста с использованием мнемотехники и ИКТ
Конспект интегрированного занятия по развитию речи для детей младшего дошкольного возраста с использованием мнемотехники и ИКТ Молодёжный перекрёсток. Мат – не наш формат
Молодёжный перекрёсток. Мат – не наш формат Как мы весело живем!
Как мы весело живем! Общество. Человек. Тест
Общество. Человек. Тест Презентация к интегрированному мероприятию Мой Ямал, олений край!
Презентация к интегрированному мероприятию Мой Ямал, олений край! Автоматизация производств в пищевой промышленности
Автоматизация производств в пищевой промышленности Воинская дисциплина, ее сущность и значение. Права и обязанности солдата, командира отделения и взвода. (Тема 3.1)
Воинская дисциплина, ее сущность и значение. Права и обязанности солдата, командира отделения и взвода. (Тема 3.1) Средства художественной выразительности речи
Средства художественной выразительности речи