Содержание
- 3. получение и свойства кислорода
- 4. Общая характеристика Химический знак – ? Относительная атомная масса Ar (O) – ? Химическая формула –
- 5. Общая характеристика Химический знак – О Относительная атомная масса Ar (O) – 16 Химическая формула –
- 6. Открытие кислорода В 1774 году английский ученый Джозеф Пристли открыл кислород. Он нагрел оксид ртути (II)
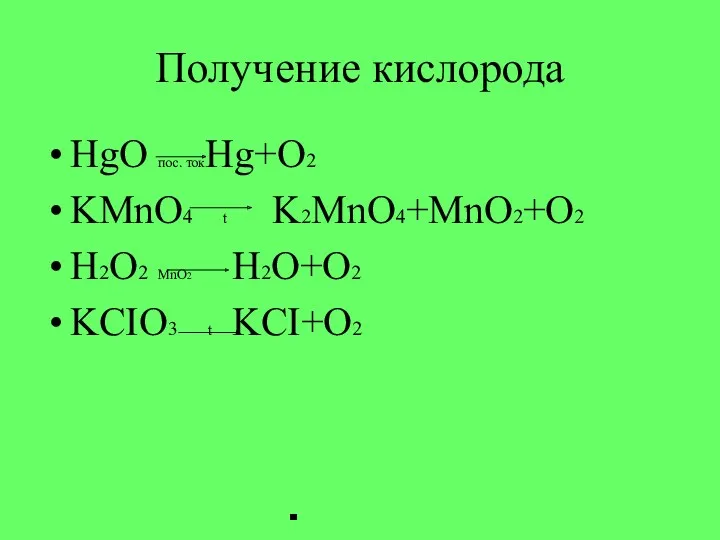
- 7. Получение кислорода HgO пос. токHg+O2 KMnO4 t K2MnO4+MnO2+O2 H2O2 MnO2 H2O+O2 KCIO3 t KCI+O2
- 8. Получение кислорода 2HgO пос. ток 2Hg+O2 2KMnO4 t K2MnO4+MnO2+O2 2H2O2 MnO2 2H2O+O2 2KCIO3 t 2KCI+3O2
- 9. Веществами, которые ускоряют химические реакции, но сами при этом не расходуются, называются катализаторами. MnO2
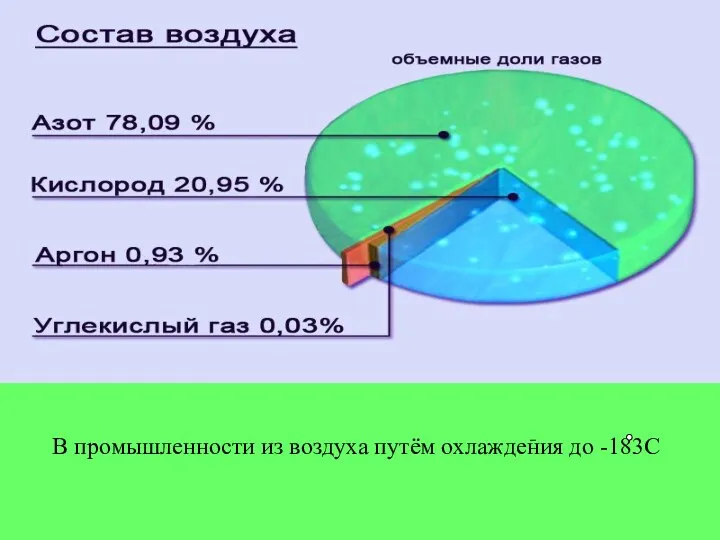
- 10. В промышленности из воздуха путём охлаждения до -183С
- 11. Физические свойства Кислород –бесцветный газ, без вкуса и запаха, относительно малорастворим в воде. Кислород немного тяжелее
- 12. Химические свойства кислорода 2Mg+O2=2MgO C+O2=CO2 S+O2=SO2
- 13. Горение – это химическая реакция, при которой происходит окисление веществ с выделением теплоты и света. MgO,
- 15. Скачать презентацию










 Эндогенные процессы: эффузивный магматизм (вулканизм)
Эндогенные процессы: эффузивный магматизм (вулканизм) Громадянське суспільство
Громадянське суспільство Способы улучшения коммутации
Способы улучшения коммутации Игра Доскажи слово правовое воспитание
Игра Доскажи слово правовое воспитание Судовое вспомогательное энерегтическое оборудование
Судовое вспомогательное энерегтическое оборудование Теоретические основы растровой и векторной компьютерной графики
Теоретические основы растровой и векторной компьютерной графики (1) г
(1) г Взаимодействие ДОУ и семьи
Взаимодействие ДОУ и семьи Презентации к урокам географии
Презентации к урокам географии Высоцкий Владимир Семенович - поэт, прозаик, бард
Высоцкий Владимир Семенович - поэт, прозаик, бард Решение логарифмических уравнений и неравенств
Решение логарифмических уравнений и неравенств Презентация к урокам технологии Модульное оригами
Презентация к урокам технологии Модульное оригами Интегрированный урок Господин из Сан-Франциско
Интегрированный урок Господин из Сан-Франциско Трансплантология - создаем нового человека
Трансплантология - создаем нового человека Эксплуатационные характеристики ограждающих конструкций зданий
Эксплуатационные характеристики ограждающих конструкций зданий Урок Типы климата России.
Урок Типы климата России. Сочинская Олимпиада
Сочинская Олимпиада Деление десятичных дробей на натуральное число
Деление десятичных дробей на натуральное число Взаимоотношения внутри популяции
Взаимоотношения внутри популяции В мире героев романа Преступление и наказание 1865-1876
В мире героев романа Преступление и наказание 1865-1876 Урок ИЗ ЧЕГО ЧТО СДЕЛАНО
Урок ИЗ ЧЕГО ЧТО СДЕЛАНО Тренинг по разбору заданий ГИА в соответствии со спецификацией и кодификатором
Тренинг по разбору заданий ГИА в соответствии со спецификацией и кодификатором 20240124_izo_6_klass._tema_31._gorodskoy_peyzazh
20240124_izo_6_klass._tema_31._gorodskoy_peyzazh Говоры и диалекты линейных казаков Кубани
Говоры и диалекты линейных казаков Кубани L’Italia del Barocco e della scienza
L’Italia del Barocco e della scienza Реки России
Реки России Основы строительной деятельности. Нормативно-регулирующая база отрасли
Основы строительной деятельности. Нормативно-регулирующая база отрасли Уголок психологической разгрузки для детей в детском саду От любопытных глаз скрываясь..
Уголок психологической разгрузки для детей в детском саду От любопытных глаз скрываясь..