Содержание
- 2. Цель урока Изучить классификации химических реакций по различным признакам
- 3. План I. Химические реакции 1) По числу и составу веществ 2) По изменению с.о. 3) По
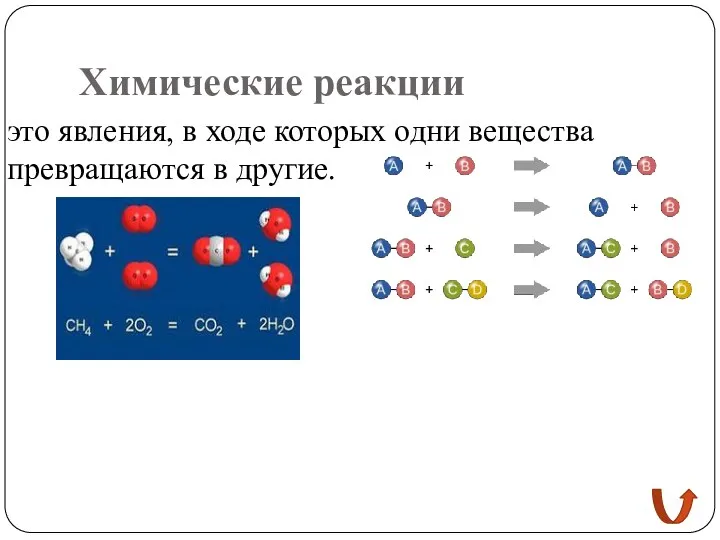
- 4. Химические реакции это явления, в ходе которых одни вещества превращаются в другие.
- 5. По числу и составу веществ а) реакции соединения S + O2 → SO2 б) реакции разложения
- 6. По изменению с.о. а) ОВР 3Fe + 2O2 = Fe3O4 б) не ОВР CuO + 2HCl
- 7. По тепловому эффекту а) экзотермические C + O2 = CO2 + Q б) эндотермические 2KMnO4 =
- 8. По фазовому составу а) гомогенные 2Al (тв)+ 3S(тв) = Al2S3(тв) б) гетерогенные СuSO4(р-р) + Fe(тв.)= FeSO4
- 9. По использованию катализатора а) каталитические Н2SO4 C2H5OH → C2H4↑ + H2O б) некаталитические 2Mg + O2
- 10. По обратимости а) обратимые N2 + 3H2 2NH3 + Q б) необратимые это все реакции обмена
- 11. Закрепление Задание: Охарактеризуйте химическое уравнение по признакам классификации. 2MgO = 2Mg + O2↑ - Q Ответы:
- 13. Скачать презентацию









 Классный час В Стране Вежливости и Доброты
Классный час В Стране Вежливости и Доброты Презентация: Урок-безопасности Чужой
Презентация: Урок-безопасности Чужой Точное земледелие
Точное земледелие Физическое насилие, факторы риска, признаки, позволяющие заподозрить физическое насилие
Физическое насилие, факторы риска, признаки, позволяющие заподозрить физическое насилие Викторина по сказке Александра Волкова Волшебник Изумрудного города
Викторина по сказке Александра Волкова Волшебник Изумрудного города Чудо - дерево. Сказки и оформление детей подготовительной группы № 9
Чудо - дерево. Сказки и оформление детей подготовительной группы № 9 Взаимодействие тел. Масса тел. Инертность
Взаимодействие тел. Масса тел. Инертность Чудеса Устьянского района. Викторина
Чудеса Устьянского района. Викторина Органи та системи органів
Органи та системи органів Презентация проекта ЭкоСелфи
Презентация проекта ЭкоСелфи Презентация Вязание крючком
Презентация Вязание крючком Я - гражданин и патриот России!
Я - гражданин и патриот России! Урок 32. Поняття мови програмування
Урок 32. Поняття мови програмування Контроль качества кровельных работ (плоская крыша)
Контроль качества кровельных работ (плоская крыша) 27a143fd9fb04a2ab729c298e0733f83
27a143fd9fb04a2ab729c298e0733f83 Past Simple (Was/Were)
Past Simple (Was/Were) ISO 45001. Система менеджмента охраны здоровья и безопасности труда
ISO 45001. Система менеджмента охраны здоровья и безопасности труда Особенности изъятия узлов (петель) с места происшествия и их трасологического исследования
Особенности изъятия узлов (петель) с места происшествия и их трасологического исследования Пословицы и поговорки – народная копилка евангельских нравственных принципов
Пословицы и поговорки – народная копилка евангельских нравственных принципов The art of negotiation
The art of negotiation Манометры и гидравлическое оборудование
Манометры и гидравлическое оборудование Конструктивные особенности конвейеров
Конструктивные особенности конвейеров Нейролингвистика. Экспериментальная и клиническая лингвистика
Нейролингвистика. Экспериментальная и клиническая лингвистика Медициналық клиникалық зерттеулердің дизайны
Медициналық клиникалық зерттеулердің дизайны Жировые,углеводные и минеральные дистрофии. Лекция по патологической анатомии
Жировые,углеводные и минеральные дистрофии. Лекция по патологической анатомии Использование нейронных сетей для исследования перколяционных моделей
Использование нейронных сетей для исследования перколяционных моделей Активизация творческой деятельности учащихся на уроках математики с использованием ИКТ
Активизация творческой деятельности учащихся на уроках математики с использованием ИКТ Шаблон оформления дипломной работы
Шаблон оформления дипломной работы