Содержание
- 2. Пример: 2Cu0 + O2 =2 Cu2+O2- 2H+CL- + Zn0 = Zn2+CL2- + H20 Реакции, протекающие с
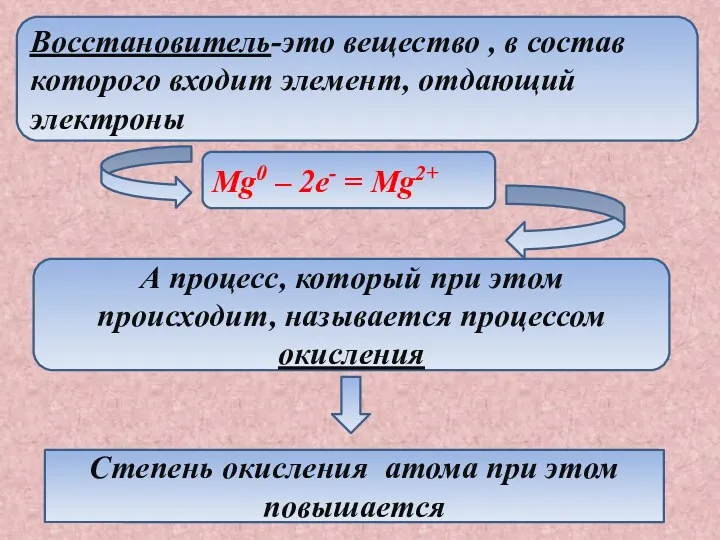
- 3. Восстановитель-это вещество , в состав которого входит элемент, отдающий электроны Mg0 – 2e- = Mg2+ А
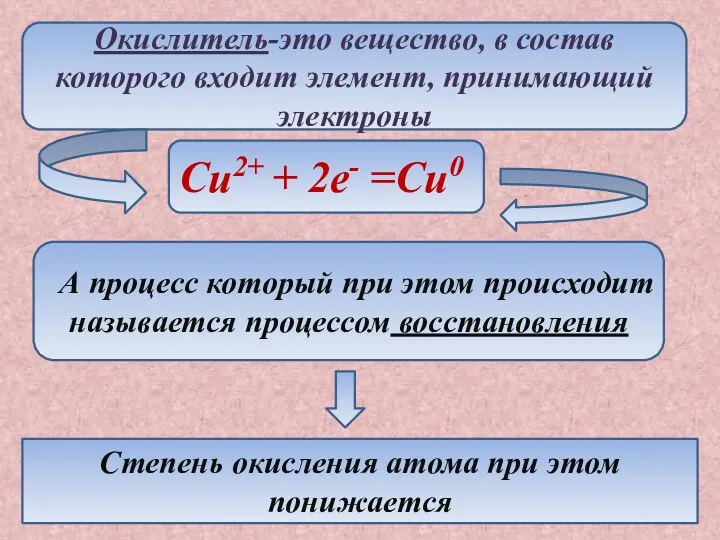
- 4. Окислитель-это вещество, в состав которого входит элемент, принимающий электроны Cu2+ + 2e- =Cu0 А процесс который
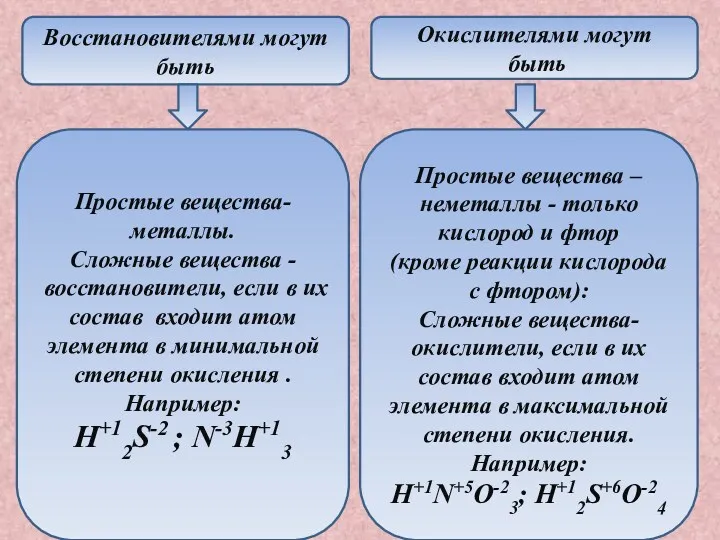
- 6. Восстановителями могут быть Окислителями могут быть Простые вещества-металлы. Сложные вещества - восстановители, если в их состав
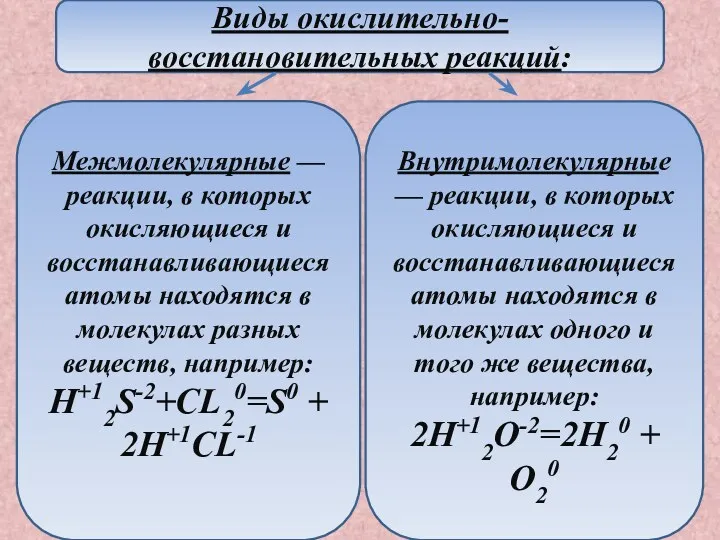
- 7. Межмолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных веществ, например: H+12S-2+CL20=S0
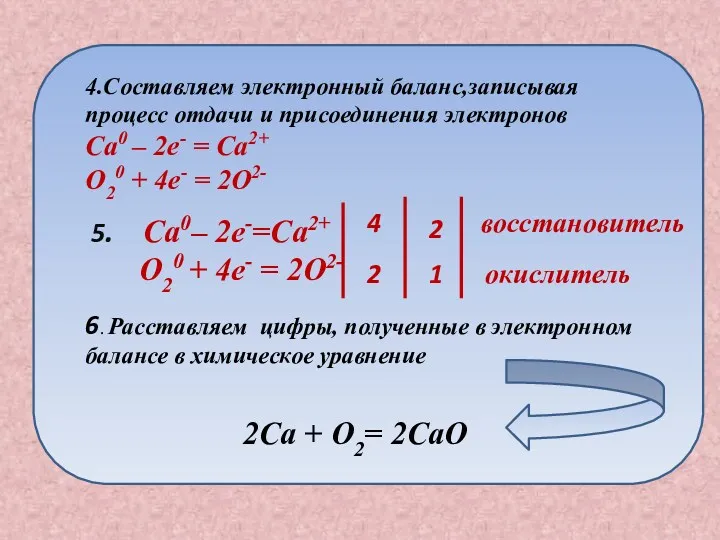
- 8. План составления окислительно -восстановительной реакции Записываем схему химической реакции Ca + O2 2. Расставляем степени окисления
- 9. 5. Ca0– 2e-=Ca2+ O20 + 4e- = 2O2- 4 2 2 1 восстановитель окислитель 6. Расставляем
- 11. Скачать презентацию



 Презентация к классному часу Жить здорово- здорово?
Презентация к классному часу Жить здорово- здорово? Организация работы отделения физиотерапии и восстановительного лечения
Организация работы отделения физиотерапии и восстановительного лечения Ремонт тротуарного покрытия вдоль улиц 25 Октября и Ленина
Ремонт тротуарного покрытия вдоль улиц 25 Октября и Ленина Оптимизация детско-родительских отношений через применение жетонной терапии
Оптимизация детско-родительских отношений через применение жетонной терапии Мосты Санкт-Петербурга
Мосты Санкт-Петербурга Работа в термодинамике. Внутренняя энергия. Первый закон термодинамики. Адиабатный процесс
Работа в термодинамике. Внутренняя энергия. Первый закон термодинамики. Адиабатный процесс Атмосфера
Атмосфера Интегрированный урок ИНФОРМАТИКА - НАУКА О ЖИВОЙ ПРИРОДЕ Сверхзадача: Воспитывать граждан, осознающих и принимающих свою долю ответственности за те изменения в окружающем мире, которые могут произойти в результате их деятельности. Межпредметные связи: ин
Интегрированный урок ИНФОРМАТИКА - НАУКА О ЖИВОЙ ПРИРОДЕ Сверхзадача: Воспитывать граждан, осознающих и принимающих свою долю ответственности за те изменения в окружающем мире, которые могут произойти в результате их деятельности. Межпредметные связи: ин Презентация Группа Полянка Диск
Презентация Группа Полянка Диск Выпуклый анализ. Выпуклые множества. Лекция 10
Выпуклый анализ. Выпуклые множества. Лекция 10 Эмоции тревоги и страха: сравнительная характеристика
Эмоции тревоги и страха: сравнительная характеристика Презентация работы ШПМ
Презентация работы ШПМ Праздники иудаизма
Праздники иудаизма Презентация. Вести с конкурса проектов и учебно-исследовательских работ учащихся Ярмарка идей
Презентация. Вести с конкурса проектов и учебно-исследовательских работ учащихся Ярмарка идей Проект Створення корекційно-розвиваючого середовища для дітей старшого дошкільного віку в логопедичній групі
Проект Створення корекційно-розвиваючого середовища для дітей старшого дошкільного віку в логопедичній групі Материал по теме самообразования Воспитание человечности
Материал по теме самообразования Воспитание человечности Маркетинговые исследования
Маркетинговые исследования Первая медицинская помощь при поражении аварийно-химически опасными веществами
Первая медицинская помощь при поражении аварийно-химически опасными веществами 20231114_asou_16h9_-_kopiya
20231114_asou_16h9_-_kopiya Дорожная карта по управляемому перетоку работников компании
Дорожная карта по управляемому перетоку работников компании 15 минут о неклассических функциях ДНК
15 минут о неклассических функциях ДНК Пісена лірика Андрія Малишка
Пісена лірика Андрія Малишка Проектирование электрооборудования резьбонарезного автомата 5А993
Проектирование электрооборудования резьбонарезного автомата 5А993 Распределенные базы данных
Распределенные базы данных Проект Толерантность
Проект Толерантность Всемирный День семьи
Всемирный День семьи Оценка эффективности инвестиционного проекта
Оценка эффективности инвестиционного проекта Внешняя политика России в начале XX века. Русско-японская война
Внешняя политика России в начале XX века. Русско-японская война