Слайд 2

Классификация
1. Простые и сложные вещества :
Простые вещества: металлы и неметаллы
Металлы: Аl; Ca; Na
Неметаллы: О2 ; N2 ; S ; Н2 .
2. Сложные вещества:
Оксиды: Na 2O ; SiO2 ; Al 2O3 ;
СаO; СО2 ; Н2О .
,,,,,,,, ? NaOH; КОН; Ca (OH)2; Al(OH)3 .
Существует ли связь между простыми веществами и сложными?
Каких веществ мы ещё не знаем?
Слайд 3
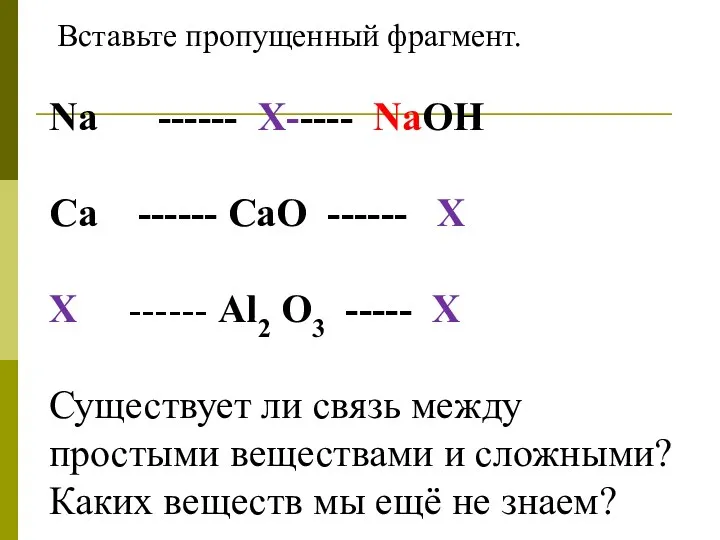
2 задание.
Вставьте пропущенный фрагмент.
Na ------ Х----- NaOH
Ca ------ CaO ------
Х
Х ------ Al2 O3 ----- Х
Существует ли связь между простыми веществами и сложными?
Каких веществ мы ещё не знаем?
.
Слайд 4
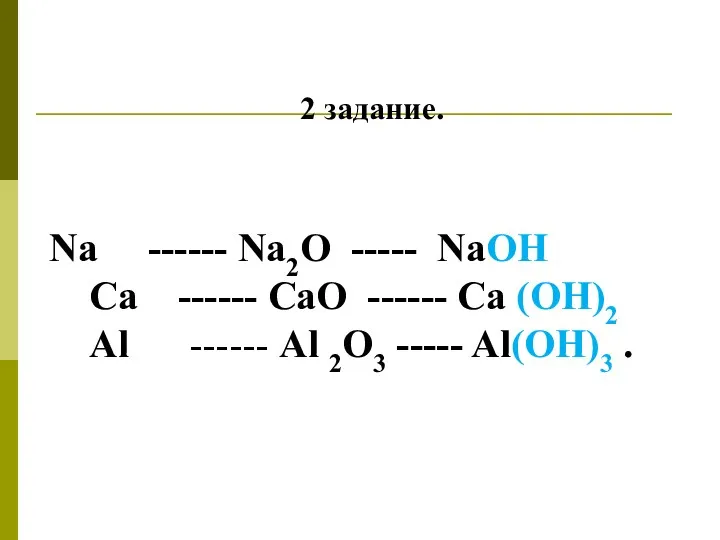
2 задание.
Na ------ Na2O ----- NaOH
Ca ------ CaO ------ Ca
(OH)2
Аl ------ Al 2O3 ----- Al(OH)3 .
Слайд 5

Слайд 6

ПЛАН
1.Основания.Определение, состав.
2.Номенклатура.
3.Классификация.
Слайд 7

3 задание.
Определить : почему у оснований разное количество групп -ОН? Дайте
обоснованный ответ.
NaОH Ca ( OH)2 Al ( OH)3
Слайд 8

3 задание.
Na+1 Ca+2 Al+3
Имеют разную степень окисления.
Слайд 9

Определите степени окисления каждого элемента в формуле гидроксид- иона
Гидроксид- ион
имеет суммарный заряд:
( О-2 Н+1 )- или ОН-
Слайд 10

1.Основания
Выведем общую формулу оснований?
Ме+n ( ОН-1)n
Слайд 11

Основания – это сложные вещества, состоящие из ионов металлов и гидроксид-
ионов.
Слайд 12

4 задание.
Составьте формулы оснований элементов под номерами:
3, 12, 31, 26,
Проанализируйте
составленные формулы оснований : по общей формуле, по степени окисления металла.
Слайд 13
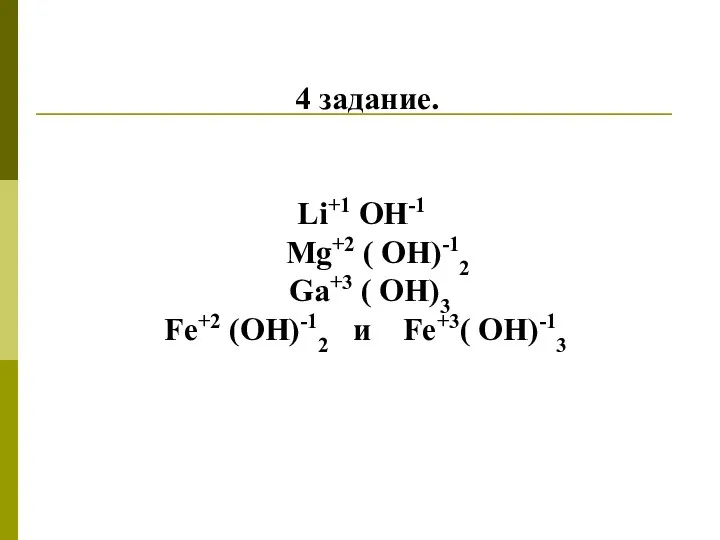
4 задание.
Li+1 OH-1
Mg+2 ( OH)-12
Ga+3 ( OH)3
Fe+2
(OH)-12 и Fe+3( OH)-13
Слайд 14

2.Номенклатура
5 задание.
Дайте название основаниям, учитывая степень окисления металла
КОН;
Fe( ОН)2;
Fe (OH)3;
Сu (OH)2;
Ва( ОН)2 ;
СuОH
Ca ( OH)2 ;
Al( OH)3;
Слайд 15

5 задание.
КОН- гидроксид калия;
Fe (ОН)2 – гидроксид железа(II);
Fe (OH)3 - гидроксид железа(III);
Сu (OH)2 - гидроксид меди(II);
Ва(ОН)2 – гидроксид бария;
СuОH - гидроксид меди(I);
Ca ( OH)2 - гидроксид кальция
Al( OH)3 - гидроксид аллюминия
Слайд 16

5 задание.
КОН- гидроксид калия;
Fe (ОН)2 – гидроксид железа(II);
Fe (OH)3 - гидроксид железа(III);
Сu (OH)2 - гидроксид меди(II);
Ва(ОН)2 – гидроксид бария;
СuОH - гидроксид меди(I);
Ca ( OH)2 - гидроксид кальция
Al( OH)3 - гидроксид аллюминия
3 Классификация
Определите группы оснований
а) по количеству групп -ОН
Слайд 17

6 задание
Однокислотные:
КОН- гидроксид калия;
Двухкислотные:
Fe (ОН)2 – гидроксид железа(II);
Сu
(OH)2 - гидроксид меди(II);
Ва (ОН)2 – гидроксид бария;
Трёхкислотные:
Fe (OH)3 - гидроксид железа(III);
Слайд 18

б) по растворимости:
Определите растворимость оснований двумя способами:
-лабораторным
Правила техники безопасности:
Что делать,
если попала на руки щёлочь?
лабораторный опыт №1
-прибавьте в первую пробирку к таблетке NаОН 5-10 мл воды ;
- прибавьте во вторую пробирку к Сu(ОН)2 ( голубое вещество) 5-10 мл воды .
Что произошло?
Вывод:
Как без опыта узнать растворимое основание или нет?
-По таблице растворимости.
Слайд 19

Слайд 20

Гранулы гидроксидов калия и натрия расплываются, поглощая влагу из воздуха. Они
очень гигроскопичны.
Слайд 21

Все щёлочи называют едкими, т. к. они разрушают бумагу, ткани, древесину.
Слайд 22

Гидроксид калия повреждает ткань
Слайд 23

« В жизни нет ничего лучшего, чем собственный опыт»
В. Скотт.
Слайд 24

Практическое задание №2
Как узнать в какой пробирке щелочь?
прибавьте в пробирку №1
со щелочью универсальный лакмус
в пробирку №2 с водой универсальный лакмус
Что произошло?
Результаты опыта оформите в таблицу:
Слайд 25

Слайд 26

7 задание
Игра « Третий лишний»
Na OH; КОН; СаО.
Na
OH; КОН; Са ( OH)2
Сu(OH)2; Fe(OH)3; Fe (OH)2;
Na OH; Сu(OH)2; Fe (OH)2.
Na OH; Fe (OH)2; КОН
Слайд 27

7 задание
Выбери лишнее вещество и объясни почему?
1. СаO
- т.к. оксид
2. Ca (OH)2 -т.к. двухкислотное основание.
3. Fe (OH)3 - т.к. трёхкислотное основание.
NaOH- т.к. растворимое основание (щёлочь)
Fe (OH)2 - т. к . нерастворимое основание
Слайд 28

Домашнее задание
§,19 упр.2 упр.4 стр 101
Слайд 29

Верите или нет
1) нет
2) да
3) нет
4) да
5) нет
6) да
7) да
8)
да
9) нет
10) да
Слайд 30

Рефлексия
1. Сегодня я узнал…
2. Было интересно…
3. Было трудно…
4. Я выполнял
задания…
5. Я понял, что…
6. Теперь я могу…
7. Я почувствовал, что…
8. Я приобрёл…




























 Презентация по химии для 9 класса по теме: Органические вещества.
Презентация по химии для 9 класса по теме: Органические вещества.
 Право и закон: природа, сущность, взаимодействие
Право и закон: природа, сущность, взаимодействие презентация о жизни и творчестве З.Биишевой
презентация о жизни и творчестве З.Биишевой 20231010_zachem_nuzhna_matematika
20231010_zachem_nuzhna_matematika Истоки 13.04 Памятные и приметные места. Гора, дерево
Истоки 13.04 Памятные и приметные места. Гора, дерево Шкатулка из открыток
Шкатулка из открыток Історія України до XX ст
Історія України до XX ст Архитектура периода Древнего Рима и Римской имерии
Архитектура периода Древнего Рима и Римской имерии Кто Я. Личная эффективность
Кто Я. Личная эффективность Розы из кленовых листьев
Розы из кленовых листьев Жиры - сложные эфиры глицерина и карбоновых кислот
Жиры - сложные эфиры глицерина и карбоновых кислот ЦЕНТРЫ РАЗВИВАЮЩЕЙ АКТИВНОСТИ.Старший дошкольный возраст
ЦЕНТРЫ РАЗВИВАЮЩЕЙ АКТИВНОСТИ.Старший дошкольный возраст Перестройка в СССР. Реформа политической системы
Перестройка в СССР. Реформа политической системы Ранние формы религии
Ранние формы религии Красная книга. Фото
Красная книга. Фото Патриотический проект Женская война
Патриотический проект Женская война Русские земли и княжества в XII - середине XV вв. Политическая раздробленность на Руси. Русь удельная в XII - XIII вв
Русские земли и княжества в XII - середине XV вв. Политическая раздробленность на Руси. Русь удельная в XII - XIII вв Секреты пластилина. Новогодняя елочка
Секреты пластилина. Новогодняя елочка Правила дорожного движения для детей старшего дошкольного возраста
Правила дорожного движения для детей старшего дошкольного возраста Именные стипендии губернатора области
Именные стипендии губернатора области Пресуппозиции в тексте. Понятие пресупозиции. Характер связи пресуппозиции с контекстом. Пресуппозиция в тексте
Пресуппозиции в тексте. Понятие пресупозиции. Характер связи пресуппозиции с контекстом. Пресуппозиция в тексте Основное представление об игре баскетбол
Основное представление об игре баскетбол Презентация к уроку Семья - важнейший институт духовно-нравственного развития
Презентация к уроку Семья - важнейший институт духовно-нравственного развития Экологический КВН Земля наш общий Дом
Экологический КВН Земля наш общий Дом Париж – столица Франции
Париж – столица Франции История театра
История театра Вода на Земле. Презентация по географии. 6 класс.
Вода на Земле. Презентация по географии. 6 класс.