Содержание
- 2. Спирты- органические вещества, молекулы которых содержат функциональную гидроксильную группу(-ОН) , соединённую с углеводородным радикалом. (Производные углеводородов,
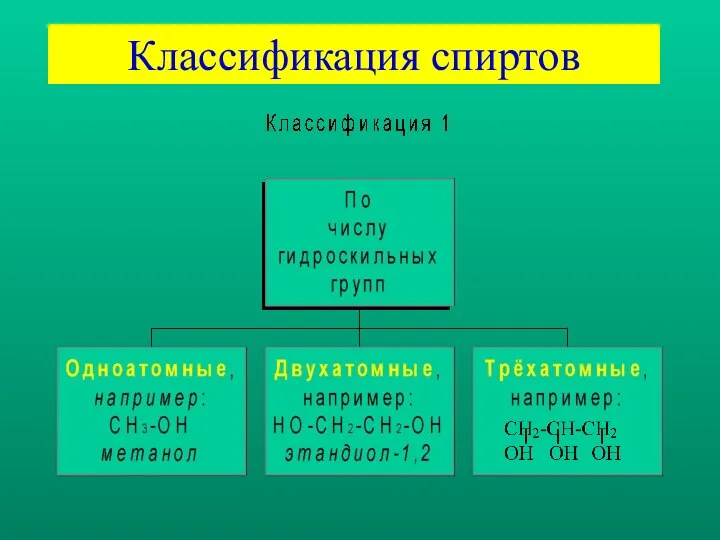
- 3. Классификация спиртов
- 4. Классификация 2 По характеру углеводородного радикала: Предельные-содержащие в молекуле лишь предельные углеводородные радикалы CH3-CH2-OH этанол Непредельные-содержащие
- 5. Ароматические-спирты, содержащие в молекуле бензольное кольцо и гидроксильную группу, связанные друг с другом не непосредственно, а
- 6. Классификация 3 По характеру атома углерода, с которыми связана гидроксильная группа: Первичные-спирты, в молекулах которых гидроксильная
- 7. Третичные-спирты, в молекулах которых гидроксильная группа связана с третичным атомом углерода СH3 CH3-C-OH OH 2-метилпропанол-2 (трет-бутиловый
- 8. Номенклатура При образовании названий спиртов к названию углеводорода, соответствующего спирту, добавляют суффикс -ол. Цифрами после суффикса
- 9. Изомерия Положения функциональной группы(C>3) CH3-CH2-CH2-OH и СH3-CH-CH3 OH пропанол-1 пропанол-2 Углеродного скелета(С>4) СH3-CH2-CH2-CH2-OH и CH3-CH-CH2-OH CH3
- 10. Физические свойства спиртов Между молекулами возникают водородные связи.Это приводит к тому, что спирты имеют аномально высокие
- 11. Способы получения спиртов Гидролиз галогеналканов H2O R-Cl+NaOH R-OH+NaCl+H20 Многоатомные спирты можно получить при гидролизе галогеналканов, содержащих
- 12. Гидрирование альдегидов и кетонов O H R-C+H2 R-C-OH H H Окисление алкенов(гликоли могут быть получены при
- 13. Брожение глюкозы(ферментативное)-только для этанола С6H12O6 2C2H5OH+2CO2 Из синтез-газа-только для метанола (t0 200-3000C, p=6-8 МПа, kat CuO,
- 14. Химические свойства спиртов Взаимодействие спиртов со щелочными и щелочными металлами Взаимодействие спиртов с галогеноводородами(реакция обратима) Межмолекулярная
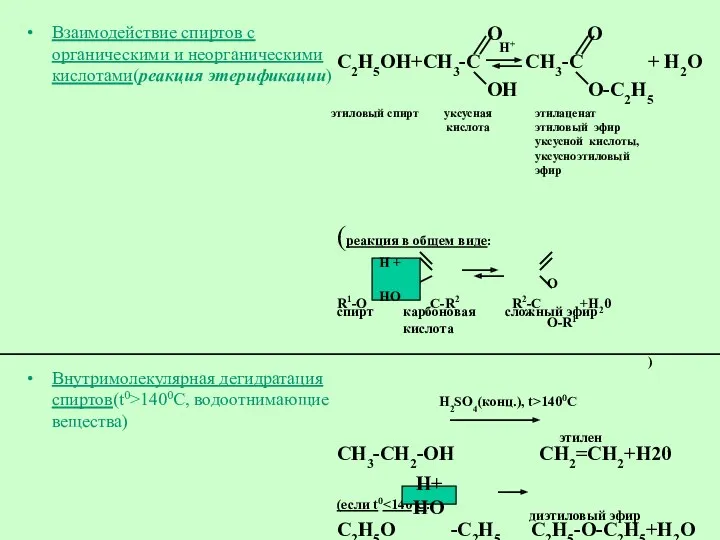
- 15. Взаимодействие спиртов с органическими и неорганическими кислотами(реакция этерификации) Внутримолекулярная дегидратация спиртов(t0>1400C, водоотнимающие вещества) O O C2H5OH+CH3-C
- 16. Окисление спиртов а)Первичный спирт альдегид кетон: б)Вторичный спирт кетон: в)Третичный спирт(устойчив к окислению). O O CH3-CH2-OH
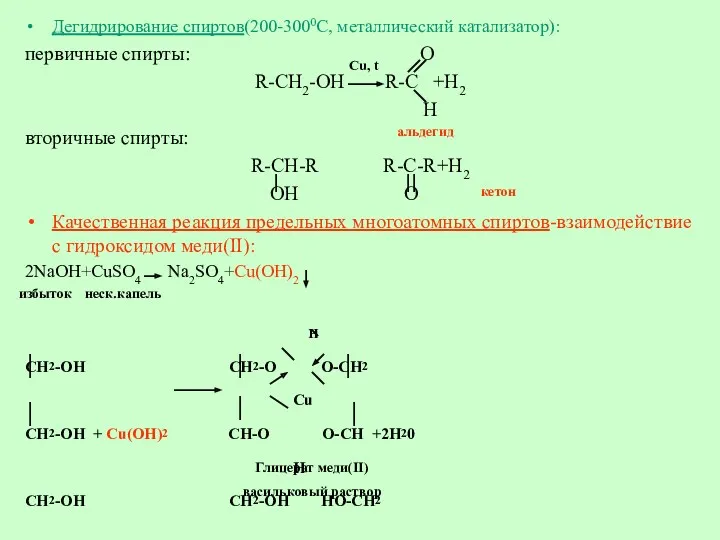
- 17. Дегидрирование спиртов(200-3000С, металлический катализатор): первичные спирты: O R-CH2-OH R-C +H2 H вторичные спирты: R-CH-R R-C-R+H2 OH
- 18. Применение спиртов Растворители, этанол=>духи, лекарства, спиртные напитки. Горючее для двигателей, добавка к моторному топливу. 2СH3OH+3O2=2CO2+4H20+Q Растворитель,
- 19. Этанол (Этиловый спирт) С2H5OH жидкость, ц , з характерный, t кип=78,390С, р в Н2О и органических
- 21. Скачать презентацию















 Saint Valentines Day
Saint Valentines Day Разработка на платформе 1С: Предприятие 8.3 системы, реализующей учет на свиноферме
Разработка на платформе 1С: Предприятие 8.3 системы, реализующей учет на свиноферме Шаблонный слайд
Шаблонный слайд Современные тренды в интернет-маркетинге
Современные тренды в интернет-маркетинге Виды изоляционных материалов. Лекция 1
Виды изоляционных материалов. Лекция 1 Визитная карточка 2 Б класса
Визитная карточка 2 Б класса Презентация к родительскому собранию Агрессия. Игры на снижение агрессии.
Презентация к родительскому собранию Агрессия. Игры на снижение агрессии. Магнітне поле постійного струму
Магнітне поле постійного струму Содержание методической работы с педагогами
Содержание методической работы с педагогами Сравнение положительных и отрицательных чисел
Сравнение положительных и отрицательных чисел Толерантность - путь к миру
Толерантность - путь к миру Презентация для детей с ОНР на развитие фонематического восприятия, анализа и синтаза по лексической теме Зимние виды спорта
Презентация для детей с ОНР на развитие фонематического восприятия, анализа и синтаза по лексической теме Зимние виды спорта Презентация урока математики в 5 классе на тему: Доли. Обыкновенные дроби
Презентация урока математики в 5 классе на тему: Доли. Обыкновенные дроби ФГОС ДО для родителей
ФГОС ДО для родителей Посуда. Развитие словарного запаса и навыки словообразования и словоизменения
Посуда. Развитие словарного запаса и навыки словообразования и словоизменения Шаблон 8 Марта. Снеговик, соавтор Иванова Т.А.
Шаблон 8 Марта. Снеговик, соавтор Иванова Т.А. Иммунология. Врожденный иммунитет
Иммунология. Врожденный иммунитет Фотография, ее история и выполнение
Фотография, ее история и выполнение Ректоцеле. Эпидемиология
Ректоцеле. Эпидемиология Мемлекеттік тіл – мәртебеміз
Мемлекеттік тіл – мәртебеміз ПАО Норникель
ПАО Норникель Контроль зуб.колес
Контроль зуб.колес Полимерные материалы, виды, оборудование, используемые при ремонте деталей
Полимерные материалы, виды, оборудование, используемые при ремонте деталей Охарактеризуйте три направления изучения детства
Охарактеризуйте три направления изучения детства Регистрация и налогообложение. Бизнес конструктор
Регистрация и налогообложение. Бизнес конструктор Лекция 1. Моделирование технологических процессов. Ионная имплантация. Эффект каналирования
Лекция 1. Моделирование технологических процессов. Ионная имплантация. Эффект каналирования Выражения и операторы JavaScript
Выражения и операторы JavaScript Вводная лекция. Предметы и задачи зоогигиены
Вводная лекция. Предметы и задачи зоогигиены