Содержание
- 2. Цель урока: Рассмотреть сущность окислительно-восстановительных реакций. Понять процессы окисления и восстановления. Научиться уравнивать химические реакции методом
- 3. Актуализация знаний - Что такое степень окисления? - Может ли степень окисления элемента быть равной нулю?
- 4. Определите степени окисления элементов в химических соединениях. +1 -1 +1 -2 +1 +1 +6 -2 +1
- 5. Окислительно-восстановительные реакции
- 6. Проделаем опыт: взаимодействие сульфата меди () со щелочью. Запишем молекулярное уравнение: CuSO4+2NaOH = Cu(OH)2 + Na2SO4
- 7. Посмотрим другие опыты: взаимодействие металлов с солями Взаимодействие металлов с солями.mp4 Запишем их молекулярные уравнения CuSO4
- 8. Теперь расставим степени окисления элементов для каждой формулы исходных веществ и продуктов реакции: Cu+2S+6 O4-2 +2Na+1O-2H+1
- 9. Окислительно-восстановительные реакции- это реакции протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ.
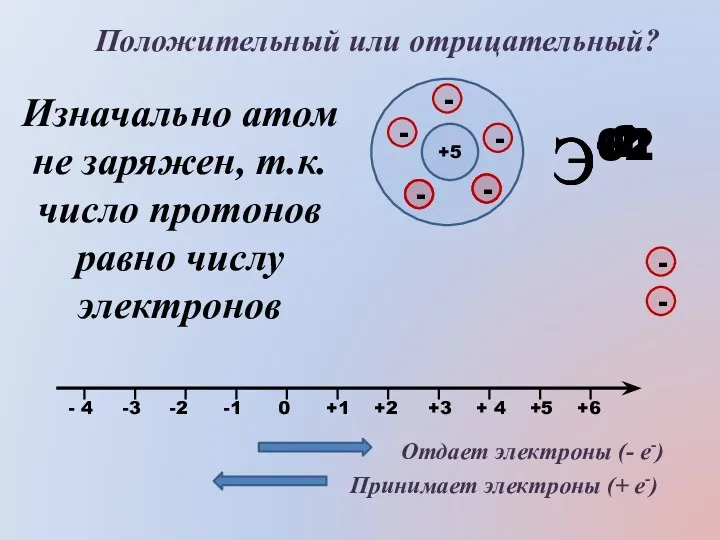
- 10. Э+1 Э+2 Э-2 Э-1 Положительный или отрицательный? +5 Изначально атом не заряжен, т.к. число протонов равно
- 11. Zn0 - 2e- Zn+2 Fe0 - 2e- Fe+2
- 12. Элемент, находящийся в низшей степени окисления, может быть только восстановителем. S-2 -2е = S0 S-2- 6е
- 14. .
- 15. 0 0 +2 -2 Ca + O2=CaO 0 +2 Ca -2e Ca 2 2 –вос-ль (окисляется)
- 17. Ответы на тестовое задание I вариант 1 - В 2 - А 3 - А II
- 18. Уравнять при помощи электронного баланса: Fe + HCl → FeCl2 + H2
- 19. Проверка: 0 +2 Fe -2е 0 +1 -1 +2 -1 0 Fe + HCl → FeCl2
- 21. Молодцы! Спасибо за работу
- 23. Скачать презентацию



















 Презентация Әлифба бәйрәме
Презентация Әлифба бәйрәме Тренажёр - презентация Состав слова
Тренажёр - презентация Состав слова Металлургия және машина жасау өнеркәсібі
Металлургия және машина жасау өнеркәсібі Почему дует ветер
Почему дует ветер Презентация. Растительный мир России, 8 класс.
Презентация. Растительный мир России, 8 класс. The Cry of a Wounded Heart
The Cry of a Wounded Heart Основные принципы переливания крови
Основные принципы переливания крови Управление качеством эксплуатации объектов теплоэнергетики
Управление качеством эксплуатации объектов теплоэнергетики Классификация информационных систем
Классификация информационных систем Сестринский уход при гломерулонефритах
Сестринский уход при гломерулонефритах Рамка и основная надпись чертежа, для школ 8 вида
Рамка и основная надпись чертежа, для школ 8 вида Сестринский процесс при уходе за недоношенным ребенком. Лекция 2
Сестринский процесс при уходе за недоношенным ребенком. Лекция 2 Построение выреза детали ¼
Построение выреза детали ¼ Познавательное развитие в соответствии с ФГОС .
Познавательное развитие в соответствии с ФГОС . Три состояния воды
Три состояния воды Как развивать внимание ? (часть 4)
Как развивать внимание ? (часть 4) Первая помощь при повреждении грудной клетки и живота
Первая помощь при повреждении грудной клетки и живота Контроль сварных соединений
Контроль сварных соединений Минеральное питание растений
Минеральное питание растений Михаил Юрьевич Лермонтов
Михаил Юрьевич Лермонтов Повышение энергоэффективности работы сортировочного комплекса Нечётной системы станции Гомель
Повышение энергоэффективности работы сортировочного комплекса Нечётной системы станции Гомель Метод моделирования на уроках географии
Метод моделирования на уроках географии Основные понятия Управления проектами
Основные понятия Управления проектами Методы исследования механической активности сердца
Методы исследования механической активности сердца Презентация аналитического отчёта
Презентация аналитического отчёта Строение Земли. Горные породы
Строение Земли. Горные породы Автоматизация звука [Р]
Автоматизация звука [Р] ЗДОРОВЬСБЕРЕГАЮЩИЕ ТЕХНОЛОГИИ НА УРОКАХ ГЕОГРАФИИ
ЗДОРОВЬСБЕРЕГАЮЩИЕ ТЕХНОЛОГИИ НА УРОКАХ ГЕОГРАФИИ