Содержание
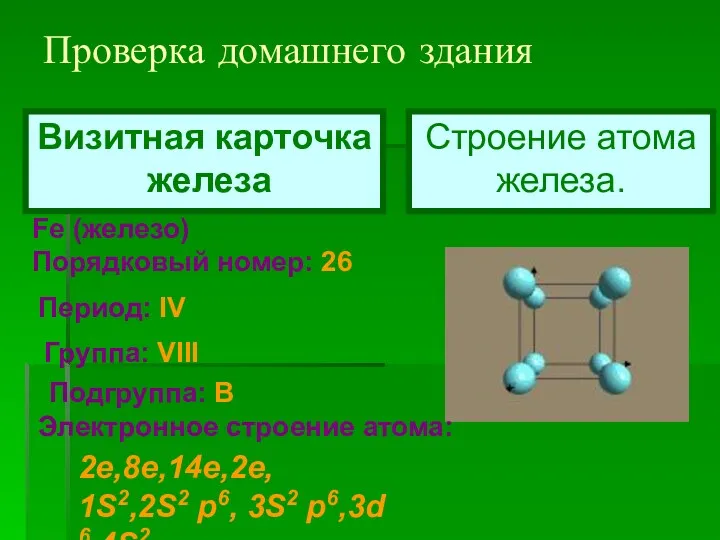
- 2. Проверка домашнего здания Fe (железо) Порядковый номер: 26 Период: IV Группа: VIII Подгруппа: В Электронное строение
- 3. Железо – восстановитель. Атомы Fe отдают электроны не только с последнего уровня, приобретая С.О.+2, но способны
- 4. Возможные соединения железа Fe S,Cu, HClразбH2SO4 р. Cl2, HNO3 +2, +3 O2, H2O +2 +3
- 5. Проверь уравнения реакций Fe + 2HCl = FeCl2 + H2 Р.И.О. Fe + 2H+ + 2Cl
- 6. Муниципальное образовательное учреждение Быстрогорская общеобразовательная средняя школа Тацинского района Ростовской области БЕНЕФИС ЖЕЛЕЗА И ЕГО СОЕДИНЕНИЙ
- 7. Эпиграф Железо не только основа всего мира, самый главный металл окружающей нас природы, оно – основа
- 8. Действие I Теоретическое
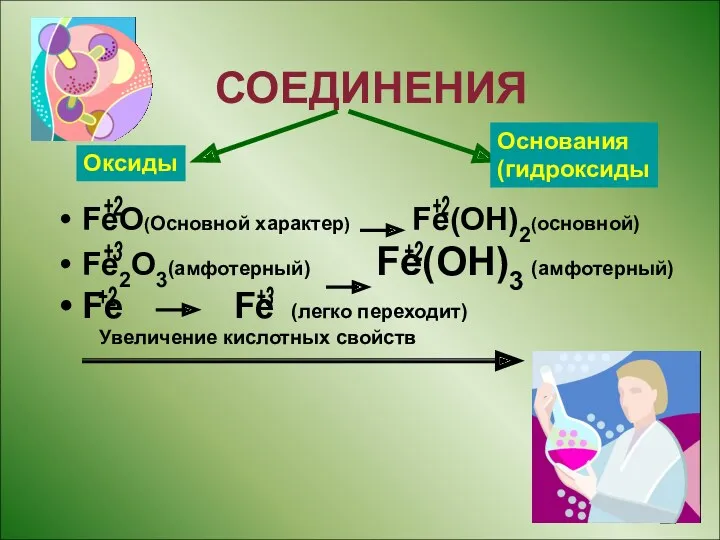
- 9. Оксиды СОЕДИНЕНИЯ FeO(Основной характер) Fe(OH)2(основной) Fe2O3(амфотерный) Fe(OH)3 (амфотерный) Fe Fe (легко переходит) Увеличение кислотных свойств Оксиды
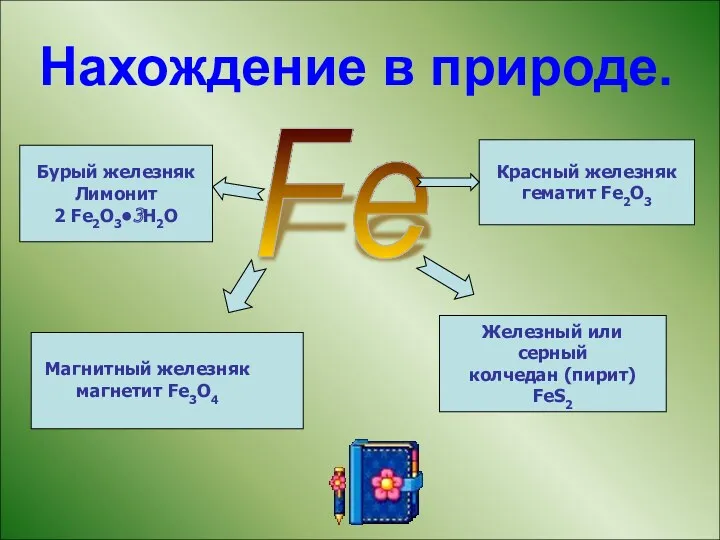
- 10. Нахождение в природе. Fe Магнитный железняк магнетит Fe3O4 Красный железняк гематит Fe2O3 Бурый железняк Лимонит 2
- 11. Действие II Химическое
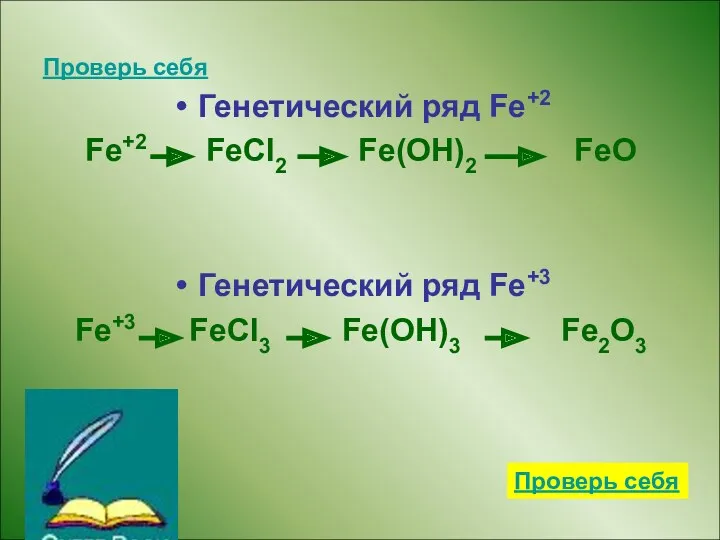
- 12. Проверь себя Генетический ряд Fe+2 Fe+2 FeCl2 Fe(OH)2 FeO Генетический ряд Fe+3 Fe+3 FeCl3 Fe(OH)3 Fe2O3
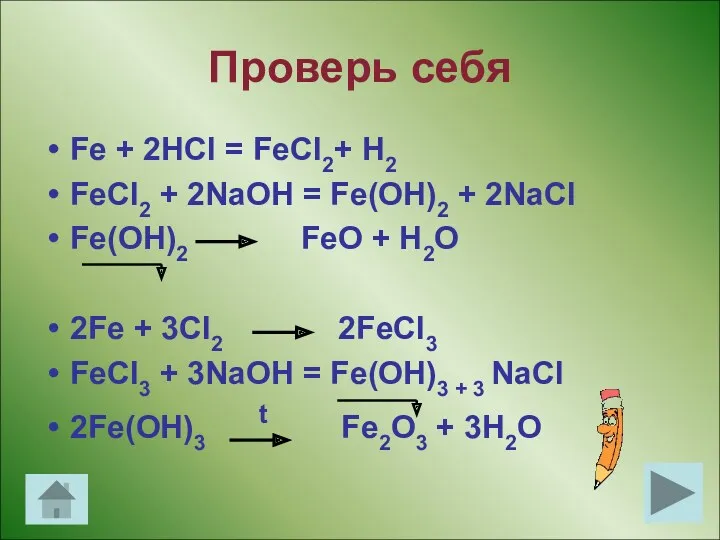
- 13. Проверь себя Fe + 2HCl = FeCl2+ H2 FeCl2 + 2NaOH = Fe(OH)2 + 2NaCl Fe(OH)2
- 14. Действие III Биологическое Презентация 1
- 15. Тест: «Порядок ли у вас с железом». 1 Часто ли вы чувствуете усталость или подавленность? 2.
- 16. Враги Fe Компонент чая связывают Fe в труднорастворимую форму. Чашка чая, выпитая во время еды, сократит
- 17. Врагами являются молочные продукты и яичные желтки.
- 18. Действие IV Практическое
- 19. Реактивом на ионы Fe+2 являются ионы OH- Fe 2+ 2OH- = Fe (OH)2 Реактивом на ионы
- 20. Действие V Гидрологическое Презентация 2
- 21. Калометрическая шкала
- 22. Действие VI Заключительное
- 23. Допишите предложения, посвященные сегодняшнему уроку: Сегодня я узнал (а)_________________________ Я удивился (лась)_________________________ Теперь я умею ____________________________
- 25. Скачать презентацию

















 Русско-японская война 1904-1905 года
Русско-японская война 1904-1905 года Амфотерные оксиды и гидроксиды
Амфотерные оксиды и гидроксиды тест Мир звезд
тест Мир звезд Царство растения
Царство растения Пассажирские перевозки. Организация перевозок пассажиров на пригородных автобусных маршрутах. Тема 6. Лекция 1
Пассажирские перевозки. Организация перевозок пассажиров на пригородных автобусных маршрутах. Тема 6. Лекция 1 Тренажёр-тест по английскому языку
Тренажёр-тест по английскому языку Управление деловой карьерой и служебно-профессиональным продвижением персонала
Управление деловой карьерой и служебно-профессиональным продвижением персонала Основные аспекты экскурсионной деятельности в школьном музее
Основные аспекты экскурсионной деятельности в школьном музее Дифференциальная диагностика менингиального синдрома
Дифференциальная диагностика менингиального синдрома С днем медика
С днем медика Георг Симон Ом
Георг Симон Ом Анализ мониторинга интегративных качеств дошкольников
Анализ мониторинга интегративных качеств дошкольников Lecture 2. Employment Procedure. Employment Contract. Categories of employees
Lecture 2. Employment Procedure. Employment Contract. Categories of employees Solution methods for bilevel optimization
Solution methods for bilevel optimization Стандартизация. Нормативно-правовая база стандартизации
Стандартизация. Нормативно-правовая база стандартизации Строение атома
Строение атома Жизнь Пифагора
Жизнь Пифагора Введение. Кристаллография
Введение. Кристаллография Расчет оборудования для подготовки формовочных материалов и приготовления смесей
Расчет оборудования для подготовки формовочных материалов и приготовления смесей Основные этапы работы над сочинением на ЕГЭ по русскому языку
Основные этапы работы над сочинением на ЕГЭ по русскому языку Мечети мира
Мечети мира С днём матери
С днём матери Почему у кошек бывают разные глаза
Почему у кошек бывают разные глаза В царстве грибов
В царстве грибов Санкт-Петербург – вторая столица России
Санкт-Петербург – вторая столица России Зигзагообразная строчка
Зигзагообразная строчка Презентация Театрализованная деятельность в детском саду в подготовительной группе
Презентация Театрализованная деятельность в детском саду в подготовительной группе Культура Древней Руси. История России
Культура Древней Руси. История России