Содержание
- 2. Демокрит (460 - 379 г до н.э.) Создал атомистическую теорию строения вещества Создал материалистическую теорию восприятия
- 3. Дж. Дальтон (1766-1844) Открыл закон парциальных давлений газов Открыл закон кратных отношений Составил первую таблицу относительных
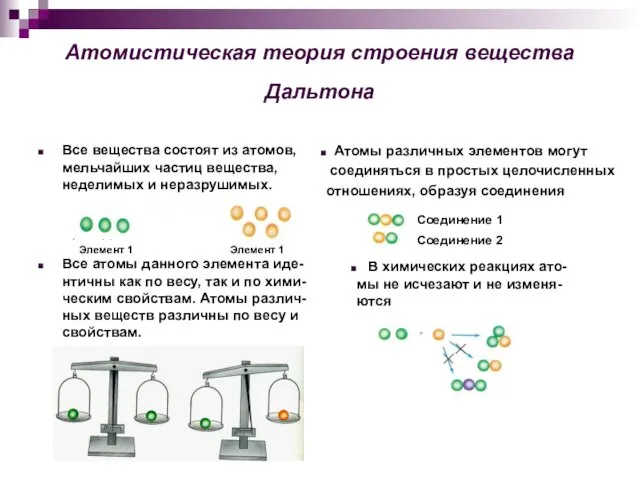
- 4. Атомистическая теория строения вещества Дальтона Все вещества состоят из атомов, мельчайших частиц вещества, неделимых и неразрушимых.
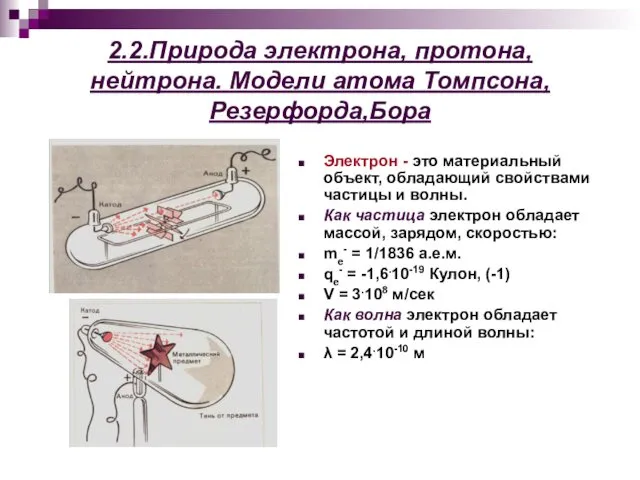
- 5. 2.2.Природа электрона, протона, нейтрона. Модели атома Томпсона, Резерфорда,Бора Электрон - это материальный объект, обладающий свойствами частицы
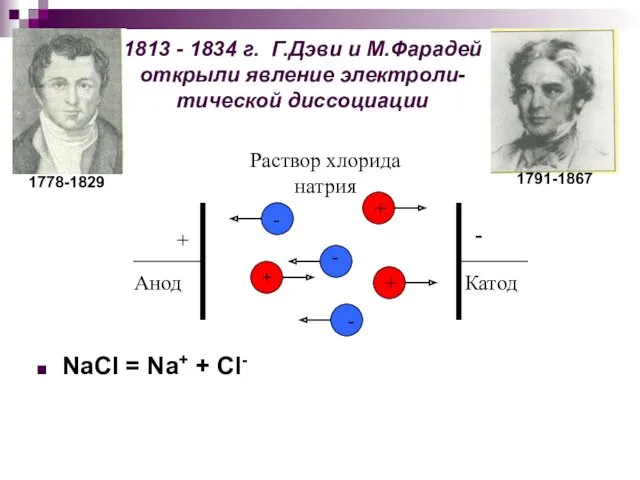
- 6. 1813 - 1834 г. Г.Дэви и М.Фарадей открыли явление электроли- тической диссоциации NaCl = Na+ +
- 7. В 1903 г. Дж.Томсон предложил одну из первых моделей строения атома, получившую название «булочки с изюмом»
- 8. В 1886 г. Э.Гольдштейн впервые регистрирует поток положительно заряженных лучей в вакуумной трубке Протон - материальный
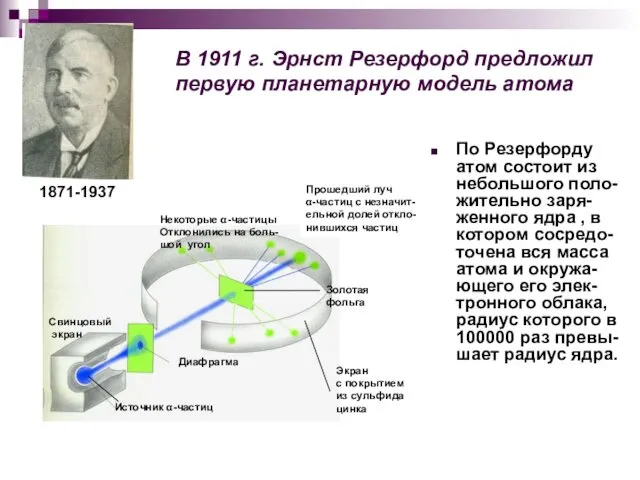
- 9. В 1911 г. Эрнст Резерфорд предложил первую планетарную модель атома По Резерфорду атом состоит из небольшого
- 10. Величина заряда ядра получила название порядкового номера элемента. Атомы одного элемента с разным количеством нейтронов имеют
- 11. В 1913 г. Н.Бор предложил модель атома, учитывающую дискретность спектров излучения водорода. 1. Из бесконечного чис-ла
- 12. 2.3. Современная квантово-механическая модель атома. Положение электрона в атоме. В качестве модели состояния электрона в атоме
- 13. В 1926 г. Шредингер предложил математическую модель , описывающую положение электронов в атоме. d2ψ/dx 2 +
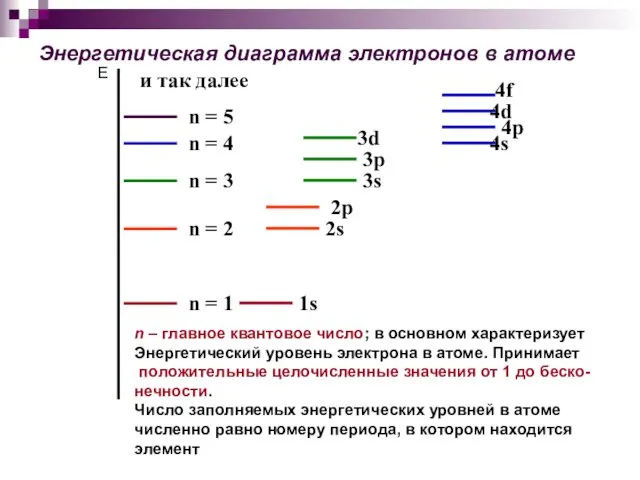
- 14. Энергетическая диаграмма электронов в атоме и так далее n – главное квантовое число; в основном характеризует
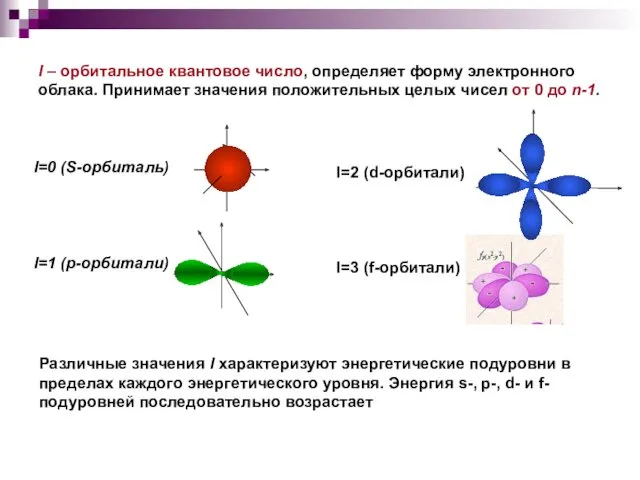
- 15. l – орбитальное квантовое число, определяет форму электронного облака. Принимает значения положительных целых чисел от 0
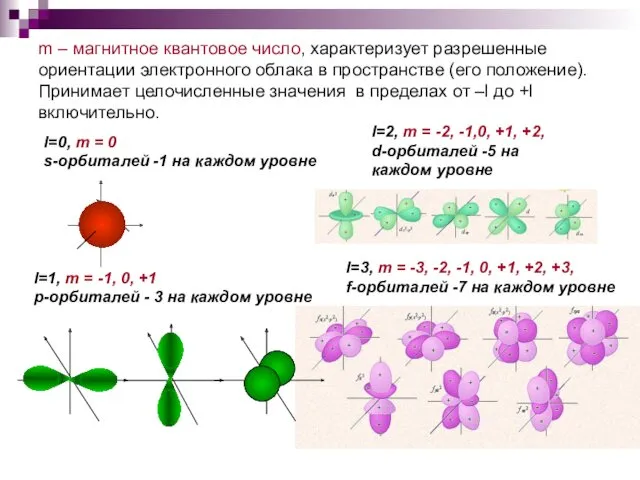
- 16. m – магнитное квантовое число, характеризует разрешенные ориентации электронного облака в пространстве (его положение). Принимает целочисленные
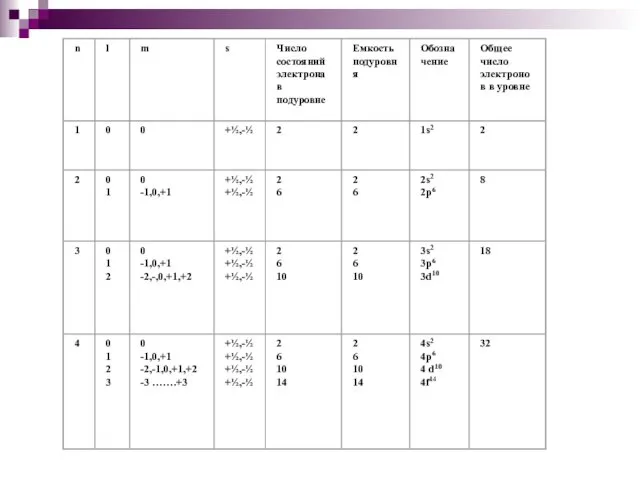
- 17. s- спиновое квантовое число. При каждом заданном значении m спиновое квантовое число имеет всего два разрешенных
- 18. Принципы построения электронных орбиталей Принцип запрета Паули: в атоме не может быть двух электронов, обладающих одинаковым
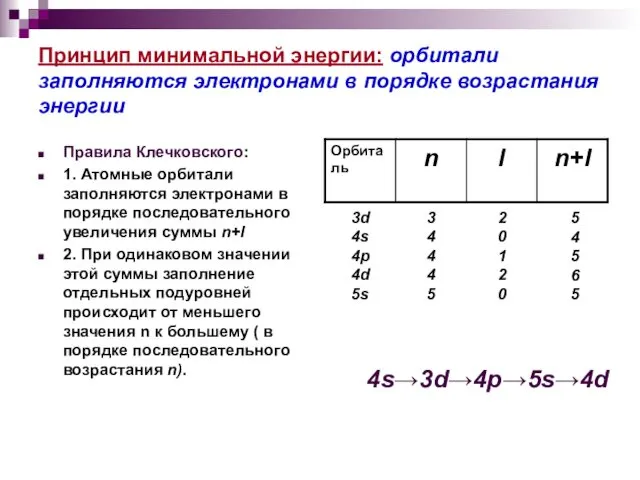
- 20. Принцип минимальной энергии: орбитали заполняются электронами в порядке возрастания энергии Правила Клечковского: 1. Атомные орбитали заполняются
- 21. Принцип максимальной мультиплетности (правило Гунда): устойчивому состоянию атома соответствует такое распределение электронов на одинаковых орбиталях, при
- 22. Дифференцирующим называется электрон, который отличает электронную оболочку данного элемента от электронной оболочки предыдущего элемента в таблице
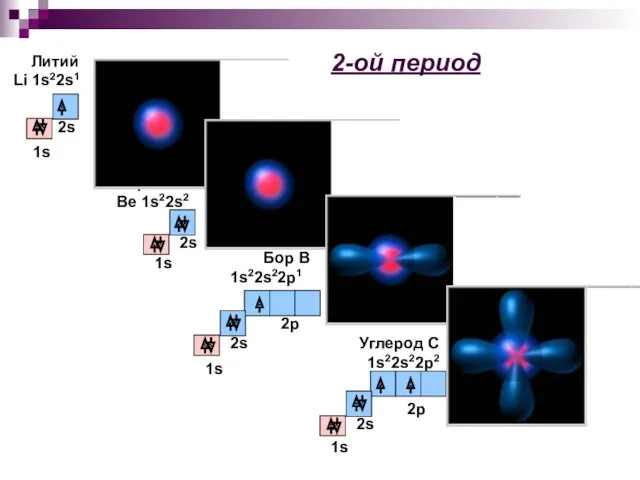
- 23. 2-ой период Литий Li 1s22s1 2s Берилий Be 1s22s2 Бор B 1s22s22p1 2р Углерод С 1s22s22p2
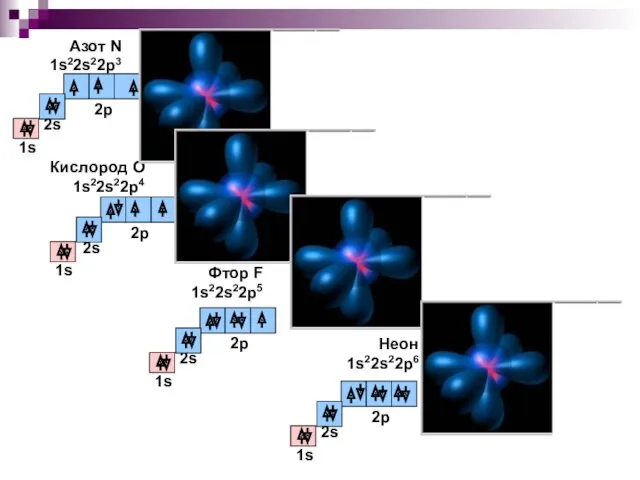
- 24. Азот N 1s22s22p3 Кислород О 1s22s22p4 Фтор F 1s22s22p5 Неон 1s22s22p6
- 26. Скачать презентацию












 Экспертиза качества некоторых сортов хлеба
Экспертиза качества некоторых сортов хлеба Microsoft Access-мәліметтер қорын басқару жүйесі
Microsoft Access-мәліметтер қорын басқару жүйесі Манипуляции в речи
Манипуляции в речи Радиосвязное оборудование воздушных судов
Радиосвязное оборудование воздушных судов Пальчиковые игры для развития речи детей 4-7 лет
Пальчиковые игры для развития речи детей 4-7 лет Аномалия Петерса. Синдром Марфана
Аномалия Петерса. Синдром Марфана Чернышевский Н.Г. (1828-1889)
Чернышевский Н.Г. (1828-1889) Волейбол. Совершенствование техники передач, нападающего удара и подачи
Волейбол. Совершенствование техники передач, нападающего удара и подачи Новая система обращения с твердыми коммунальными отходами
Новая система обращения с твердыми коммунальными отходами Тургенев. Отцы и дети. Галерея портретов и эпизодов
Тургенев. Отцы и дети. Галерея портретов и эпизодов Классный час по правилам пожарной безопасности
Классный час по правилам пожарной безопасности Климактерический синдром
Климактерический синдром Методическая разработка урока.
Методическая разработка урока. Wikipedia. How it works and why it works
Wikipedia. How it works and why it works Защита программы кружка ЮИД.
Защита программы кружка ЮИД. PWM (Pulse-Width Modulation)
PWM (Pulse-Width Modulation) проект Второе рождение коробки
проект Второе рождение коробки Participle I, II. Причастия в английском языке
Participle I, II. Причастия в английском языке Нарушения кровообращения и лимфообращения
Нарушения кровообращения и лимфообращения Работа над ошибками по русскому языку
Работа над ошибками по русскому языку Конфликт на Ближнем Востоке
Конфликт на Ближнем Востоке Комплаентность пациента с артериальной гипертензией. Роль фельдшера
Комплаентность пациента с артериальной гипертензией. Роль фельдшера Азия на политической карте мира
Азия на политической карте мира Природа человека. Изучение нового материала
Природа человека. Изучение нового материала Инструкция по вносу накладных
Инструкция по вносу накладных 20231102_podgotovka_k_gia_zad.40
20231102_podgotovka_k_gia_zad.40 Английский чай
Английский чай Размерный анализ. Точность технологических операций
Размерный анализ. Точность технологических операций