Слайд 2

Хром — элемент побочной подгруппы 6-й группы 4-го периода периодической системы химических элементов Д. И. Менделеева с атомным номером 24. Обозначается
символом Cr(лат. Chromium). Простое вещество хром (CAS-номер: 7440-47-3) — твёрдый металлголубовато-белого цвета.
Слайд 3

История
В 1766 году в окрестностях Екатеринбурга был обнаружен минерал, который получил название «сибирский красный свинец»,
PbCrO4. Современное название — крокоит. В 1797 французский химик Л. Н. Воклен выделил из него новый тугоплавкий металл (скорее всего, Воклен получил карбид хрома).
Название элемент получил от греч. χρῶμα — цвет, краска — из-за разнообразия окраски своих соединений.
Слайд 4
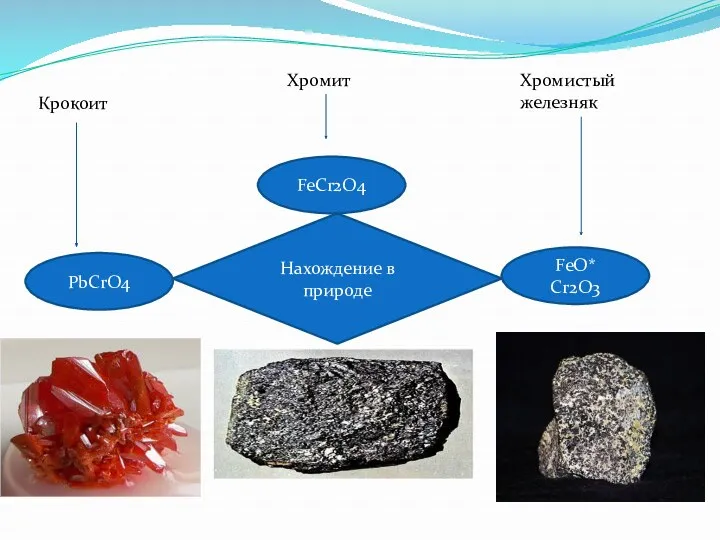
FeCr2O4
Нахождение в природе
PbCrO4
FeO* Cr2O3
Крокоит
Хромит
Хромистый железняк
Слайд 5

Физические свойства
В свободном виде — голубовато-белый металл с кубической объемно-центрированной решеткой, а = 0,28845 нм. При
температуре 39 °C переходит из парамагнитногосостояния в антиферромагнитное (точка Нееля).
Хром имеет твердость по шкале Мооса 5, один из самых твердых чистых металлов (уступает только иридию, бериллию, вольфраму и урану). Очень чистый хром достаточно хорошо поддаётся механической обработке.
Слайд 6

Химические свойства
1.Реагирует с неметаллами(при нагревании)
А) 4Cr + 3O2 =2Cr2O3
Б) 2Cr +
N2 =2CrN
В) 2Cr +3S = Cr2S3
2.Реагирует с парами воды (в раскаленном состоянии)
2Cr + 3H2O=Cr2O3 + 3H2
3.Реагирует с кислотами
Cr + H2SO4 = CrSO4 + H2
4.Реагирует с солями менее активных металлов
Cr + CuSO4 = CrSO4 + Cu
Слайд 7

Получение
Хром встречается в природе в основном в виде хромистого железняка Fe(CrO2)2 (хромит
железа). Из него получают феррохром восстановлением в электропечахкоксом (углеродом):
Феррохром применяют для производства легированных сталей
Слайд 8

Чтобы получить чистый хром, реакцию ведут следующим образом:
1) сплавляют хромит железа
с карбонатом натрия (кальцинированная сода) на воздухе:
Слайд 9

2) растворяют хромат натрия и отделяют его от оксида железа;
3) переводят
хромат в дихромат, подкисляя раствор и выкристаллизовывая дихромат;
4) получают чистый оксид хрома восстановлением дихромата натрия углём:
Слайд 10

5) с помощью алюминотермии получают металлический хром:
6) с помощью электролиза получают электролитический хром из раствора хромового
ангидрида в воде, содержащего добавку серной кислоты. При этом на катодах совершаются в основном 3 процесса:
восстановление шестивалентного хрома до трехвалентного с переходом его в раствор;
разряд ионов водорода с выделением газообразного водорода;
разряд ионов, содержащих шестивалентный хром, с осаждением металлического хрома;









 Типы химических реакций
Типы химических реакций Организация учета ГСМ на складах ГСМ авиапредприятий
Организация учета ГСМ на складах ГСМ авиапредприятий Додаткове завдання з мови.
Додаткове завдання з мови. Виды технологической карты урока английского языка
Виды технологической карты урока английского языка Организация объединенных наций (ООН)
Организация объединенных наций (ООН) Назначение геофизических исследований скважин при геологическом изучении недр и добычи нефти и газа
Назначение геофизических исследований скважин при геологическом изучении недр и добычи нефти и газа Импрессионизм в музыке и живописи
Импрессионизм в музыке и живописи Квилинг
Квилинг Запорная арматура
Запорная арматура Хранимые процедуры (stored procedures)
Хранимые процедуры (stored procedures) крупнейшие теракты мира
крупнейшие теракты мира ПАЛЬЧИКОВЫЙ ТЕАТР ИЗ ФЕТРА СВОИМИ РУКАМИ
ПАЛЬЧИКОВЫЙ ТЕАТР ИЗ ФЕТРА СВОИМИ РУКАМИ День памяти и скорби
День памяти и скорби Развитие фонематического восприятия
Развитие фонематического восприятия Дециметр. Урок № 91
Дециметр. Урок № 91 Презентация Предметно-развивающая среда в старшей группе детского сада
Презентация Предметно-развивающая среда в старшей группе детского сада Введение. Язык и речь
Введение. Язык и речь Церковь Покрова на Нерли
Церковь Покрова на Нерли Международные валютные отношения
Международные валютные отношения Презентация КЛЯКСЫ
Презентация КЛЯКСЫ Симфонический оркестр (часть 1)
Симфонический оркестр (часть 1) Shanghai WTL Welding Equipment
Shanghai WTL Welding Equipment Анализ устойчивости линейных непрерывных систем
Анализ устойчивости линейных непрерывных систем ENGLISH
ENGLISH Автоматизированная система управления рестораном МИКРОИНВЕСТ
Автоматизированная система управления рестораном МИКРОИНВЕСТ Какая бывает промышленность?
Какая бывает промышленность? Обмен липидов
Обмен липидов Тендеры: ТО и ремонт автомобилей
Тендеры: ТО и ремонт автомобилей