Содержание
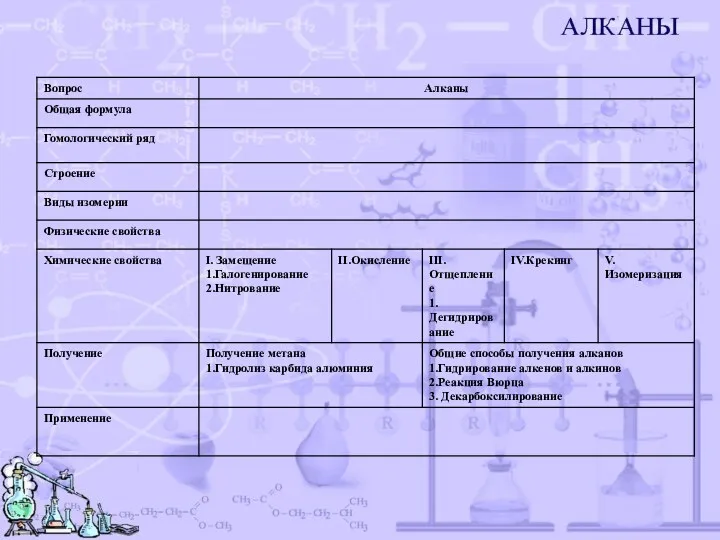
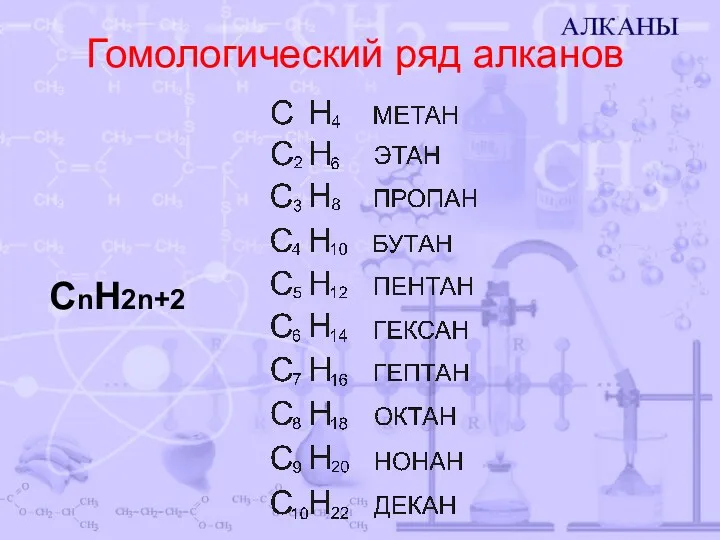
- 3. Гомологический ряд алканов CnH2n+2
- 4. Строение алканов Простейшим представителем алканов является метан. Рассмотрим строение его молекулы. CH4- ковалентная полярная связь. 109°
- 5. Виды изомерии алканов Для алканов характерна изомерия углеродного скелета ВИДЕО
- 6. Физические свойства Алканы имеют молекулярную кристаллическую решетку С1 -С4- бесцветные газы С5-С17-бесцветные жидкости, имеющие запах бензина
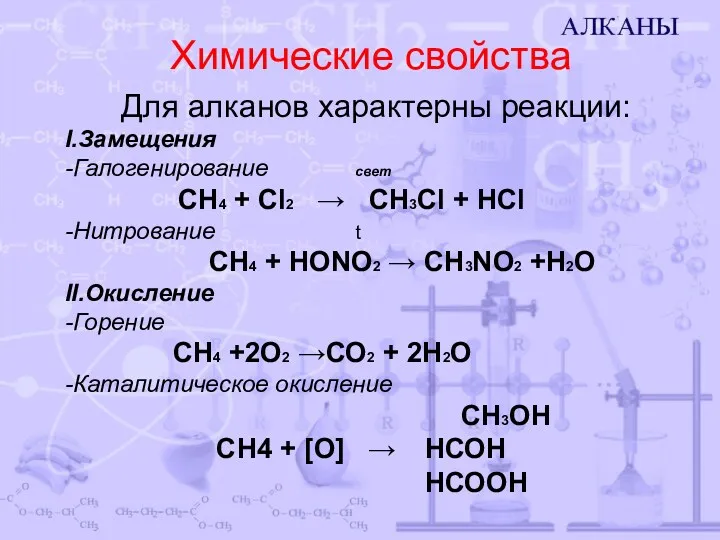
- 7. Химические свойства Для алканов характерны реакции: I.Замещения -Галогенирование свет CH4 + Cl2 → CH3Cl + HCl
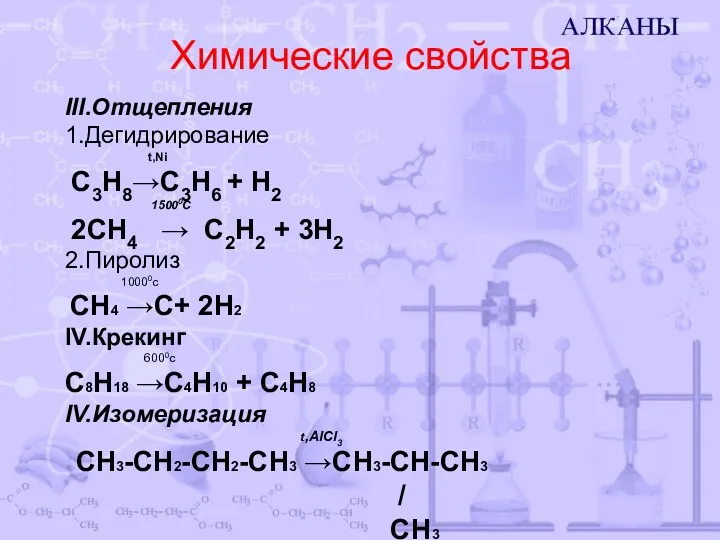
- 8. Химические свойства III.Отщепления 1.Дегидрирование t,Ni С3Н8→С3Н6 + Н2 15000C 2СН4 → С2Н2 + 3Н2 2.Пиролиз 10000c
- 9. Методы получения метана 1.Разложение карбида алюминия водой или кислотой. Al4C3 +12H2O → 4Al(OH)3 + 3CH4 Al4C3
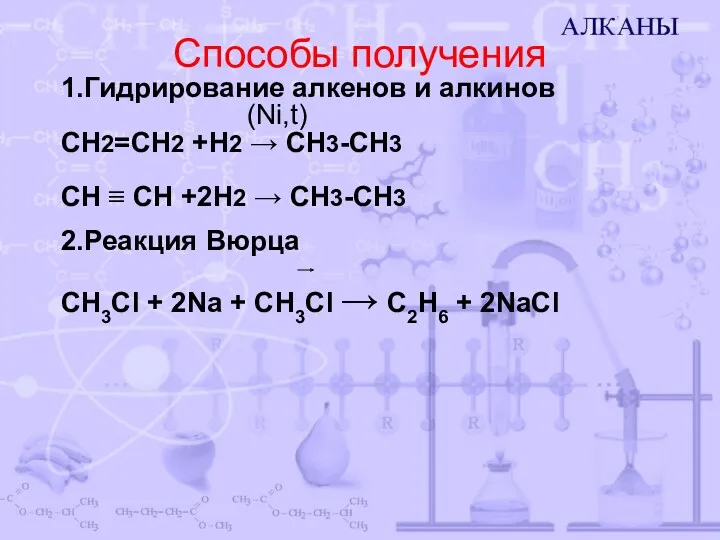
- 10. Способы получения 1.Гидрирование алкенов и алкинов (Ni,t) СН2=СН2 +Н2 → СН3-СН3 СН ≡ СН +2Н2 →
- 11. Применение Для получения: 1. Резины 2.Типографской краски 3.Синтетического бензина 4.Синтез-газа 5.Растворителей 6.Горючего 7.Хладаагентов
- 13. Скачать презентацию





 Электронные ключи
Электронные ключи Влияние компьютерных игр на изучение английского языка
Влияние компьютерных игр на изучение английского языка Научные основы и история становления трасологической диагностики
Научные основы и история становления трасологической диагностики Русская культура в X-XIII ВВ
Русская культура в X-XIII ВВ 22_Иррациональные уравнения и неравенства
22_Иррациональные уравнения и неравенства Гигиена детей и подростков
Гигиена детей и подростков Морской Транспорт
Морской Транспорт Б класс Мир человека 01.02.2022
Б класс Мир человека 01.02.2022 Бюджет домохозяйства в современной России
Бюджет домохозяйства в современной России Кетоацидоздық кома
Кетоацидоздық кома Бизнес-по русски, или танцы с граблями
Бизнес-по русски, или танцы с граблями Colours_and_Numbers_1-20
Colours_and_Numbers_1-20 Федеративная Республика Бразилия
Федеративная Республика Бразилия Оформлення позовної заяви
Оформлення позовної заяви Открытие ИП. Основы управления предприятием
Открытие ИП. Основы управления предприятием Пансионат для граждан пожилого возраста и инвалидов
Пансионат для граждан пожилого возраста и инвалидов Древние люди. Неандертальцы
Древние люди. Неандертальцы Транспортировка нефти и газа
Транспортировка нефти и газа Электронное портфолио
Электронное портфолио Принципы проектирования объектного стройгенплана
Принципы проектирования объектного стройгенплана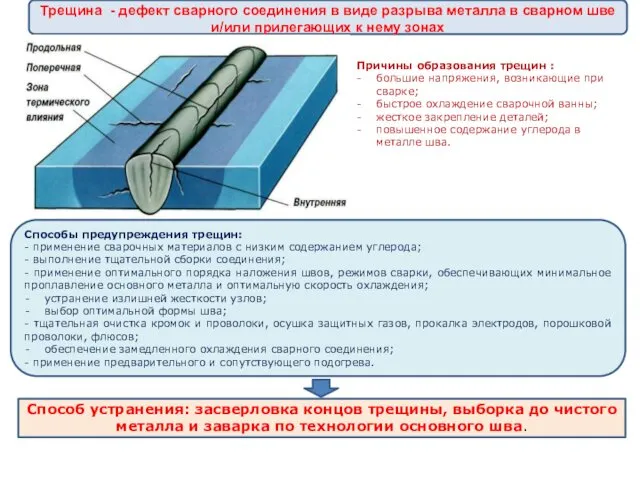 Трещина - дефект сварного соединения
Трещина - дефект сварного соединения Контроль і ревізія матеріальних запасів
Контроль і ревізія матеріальних запасів Компьютер - источник увлекательных игр или помощник в учёбе
Компьютер - источник увлекательных игр или помощник в учёбе Правила поведения
Правила поведения C# как объектно-ориентированный язык. Типы данных. Ссылочные и значимые типы. Приведение типов
C# как объектно-ориентированный язык. Типы данных. Ссылочные и значимые типы. Приведение типов Презентация первого урока Город, комфортный для жизни
Презентация первого урока Город, комфортный для жизни Презентация к внеклассному мероприятию Спасибо деду за победу
Презентация к внеклассному мероприятию Спасибо деду за победу Изменения в земельном законодательстве
Изменения в земельном законодательстве