Содержание
- 2. Не нужен университет, Ни Кембридж, и ни Оксфорд, Чтобы узнать: латинской «Р» Обозначают …
- 3. Паспортные данные фосфора Перечислите элементы V группы. Охарактеризуйте фосфор по положению в периодической системе химических элементов
- 4. Фосфор впервые получил в 1669 г. алхимик из Гамбурга Хеннинг Бранд. Подобно другим алхимикам, он пытался
- 5. К.В. Шееле (1742–1786) Вскоре Ю. Ган и К Шееле доказали, что в костях содержится много фосфора.
- 6. «Да! Это была собака, огромная, черная как смоль… Из ее отверстой пасти вырывалось пламя, глаза метали
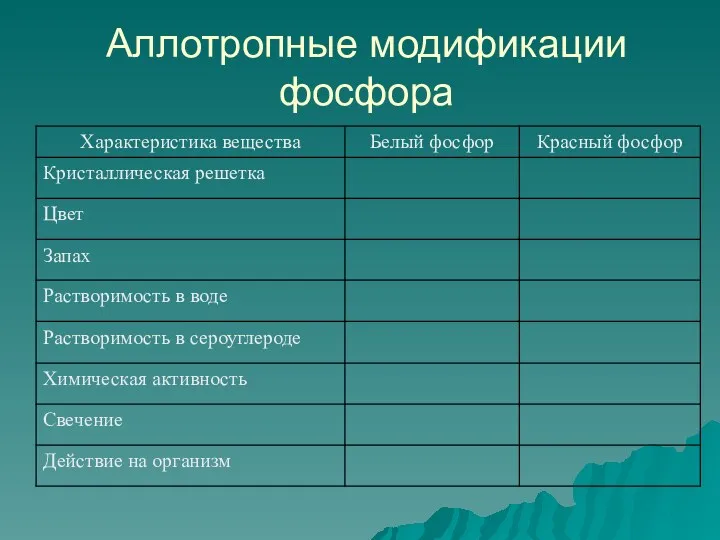
- 7. Аллотропные модификации фосфора
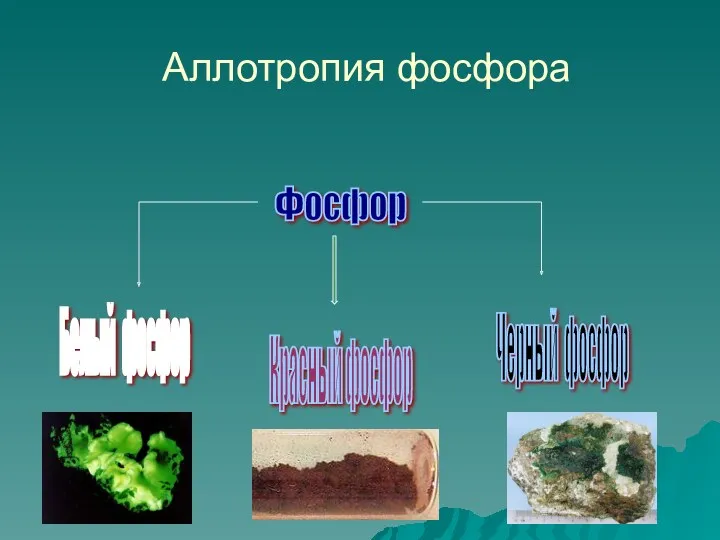
- 8. Аллотропия фосфора Фосфор Белый фосфор Красный фосфор Черный фосфор
- 9. Белый фосфор Наиболее распространен белый, или желтый, фосфор. Белый фосфор имеет молекулярную решетку, в узлах которой
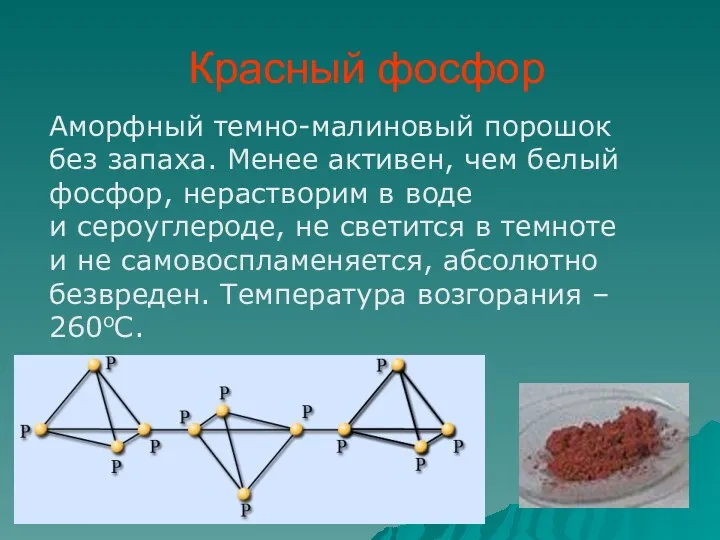
- 10. Красный фосфор Аморфный темно-малиновый порошок без запаха. Менее активен, чем белый фосфор, нерастворим в воде и
- 11. Черный фосфор Ромбическая модификация Кубическая модификация Имеет атомную кристаллическую решетку. По внешним признакам черный фосфор напоминает
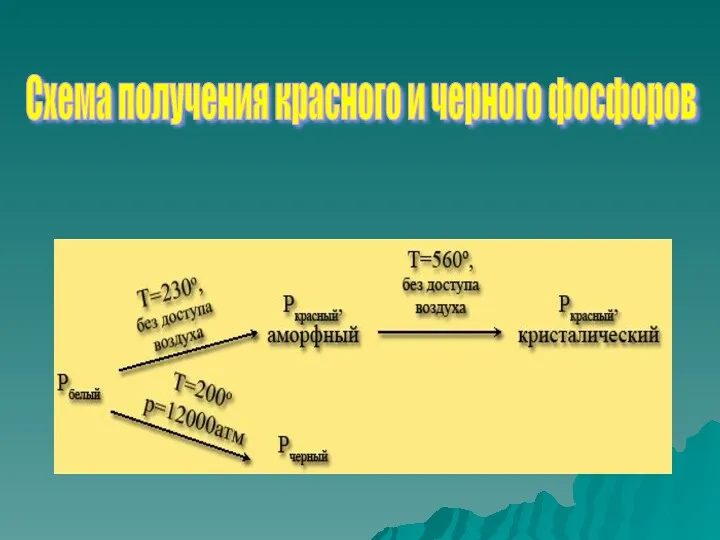
- 12. Схема получения красного и черного фосфоров
- 13. Фосфор в природе Фосфор встречается в природе только в связанном состоянии. Массовая доля фосфора в земной
- 14. Химические свойства Взаимодействие с активными металлами: Mg + P → Взаимодействие с кислородом: Р + О2
- 15. Биологическое значение По содержанию в организме человека фосфор относится к макроэлементам (w(Р) = 0,95%). Фосфор входит
- 16. Применение фосфора Более половины объема мирового производства фосфора перерабатывается в соединения, используемые в синтетических моющих средствах.
- 17. Станция поэтическая Я светоносный элемент. Я спичку вам зажгу в момент. Сожгут меня – и под
- 18. Станция контрольная 1. Сколько электронов в атоме фосфора находится на внешнем энергетическом уровне? 1) 2 ;
- 20. Скачать презентацию













 Потенциал_Нижегородской_области
Потенциал_Нижегородской_области Минипогрузчики нового поколения
Минипогрузчики нового поколения Обоснование режимов работы добывающих скважин при снижении забойного давления ниже давления насыщения пластовой нефти газом
Обоснование режимов работы добывающих скважин при снижении забойного давления ниже давления насыщения пластовой нефти газом Презентация Перелетные птицы
Презентация Перелетные птицы Надёжность сложных систем
Надёжность сложных систем Лыжи - зимние друзья
Лыжи - зимние друзья Защита медицинской информации
Защита медицинской информации МАДОУ 'Детский сад № 92' Презентация проекта Подвижные игры Прикамья
МАДОУ 'Детский сад № 92' Презентация проекта Подвижные игры Прикамья Правила уборки на кухне на каждый день
Правила уборки на кухне на каждый день Математический КВН
Математический КВН Prezentantsia_Gukov_IA
Prezentantsia_Gukov_IA Сочинение-описание картины Е. Н. Широкова Друзья
Сочинение-описание картины Е. Н. Широкова Друзья Серебряный век. Кинематограф
Серебряный век. Кинематограф Профилактика пролежней
Профилактика пролежней Тебе, изучившему полный курс школьной математики! Напутствия...
Тебе, изучившему полный курс школьной математики! Напутствия... Формы организации познавательных занятий
Формы организации познавательных занятий Презентация_Разговоры_о_важных_ppt
Презентация_Разговоры_о_важных_ppt Самопрезентация учителя
Самопрезентация учителя Детская инициативность
Детская инициативность Презентация для родителей Чтобы подросток не вырос подРАНКОМ
Презентация для родителей Чтобы подросток не вырос подРАНКОМ Тамақтану денсаулық факторы. Алиментарлық аурулар
Тамақтану денсаулық факторы. Алиментарлық аурулар Зарождение математики
Зарождение математики Работа с графическим интерфейсом. Лекция №13
Работа с графическим интерфейсом. Лекция №13 Літургійний день ранніх християн
Літургійний день ранніх християн Фитотерапия сахарного диабета
Фитотерапия сахарного диабета Заболевания желчевыделительной системы у детей
Заболевания желчевыделительной системы у детей Презентация Здоровьесберегающие технологии в школе
Презентация Здоровьесберегающие технологии в школе Свойства вод Мирового океана.
Свойства вод Мирового океана.