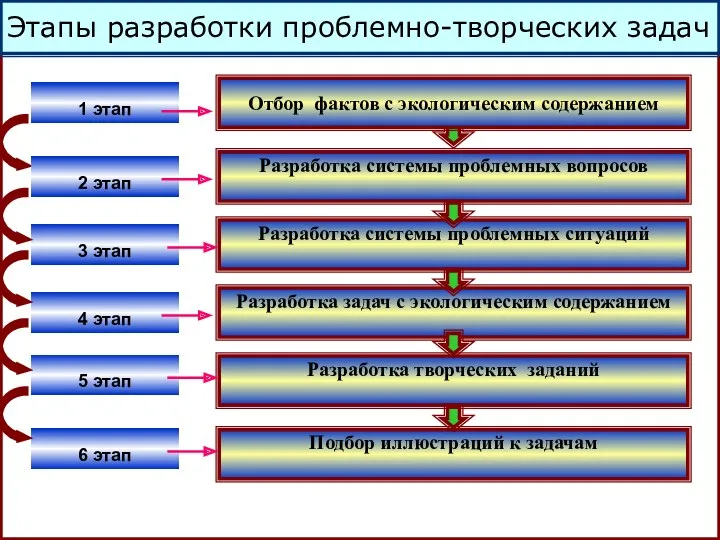
Задание.
Агрегат по производству серной кислоты
выбрасывает в течение часа в атмосферу
17 м3 газов (SO3 = 16 %). Определите
массу SO3, выбрасываемого в атмосферу
за сутки.
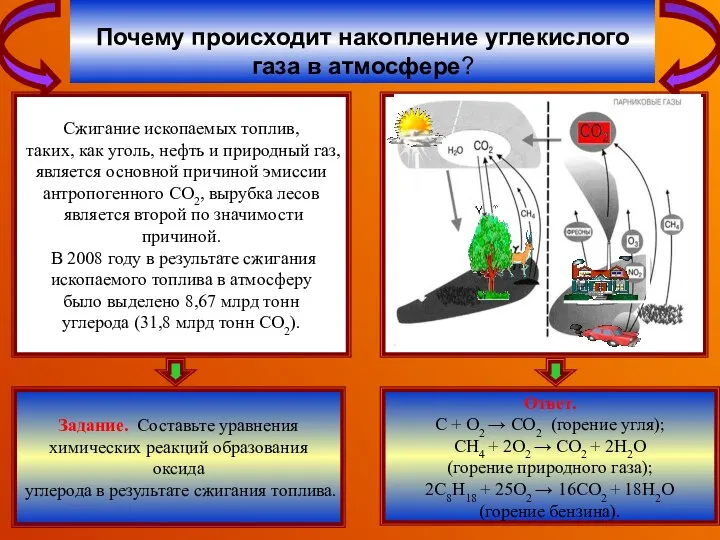
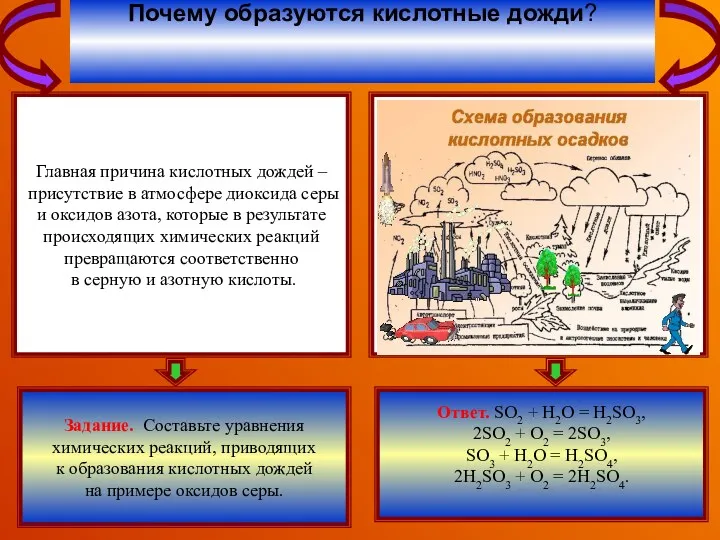
В районах, где промышленность
сильна развита, кислотные осадки
вызваны техногенными выбросами
оксидов серы и азота (автомобилями,
электростанциями, металлургическими
заводами). В результате работы
металлургического завода в окружающую
среду выбрасывается большое количество
оксида серы(IV), который, претерпевая
в атмосфере некоторые превращения,
образует серную кислоту.
Почему промышленные центры более
подвержены кислотным дождям?
Ответ. 233,14 кг.




 Шарнирное соединение деталей. Игрушки-качалки
Шарнирное соединение деталей. Игрушки-качалки Жизнь и творчество Андрея Рублева. Книжная выставка
Жизнь и творчество Андрея Рублева. Книжная выставка Современное делопроизводство. Нормативные основы. Персональные данные
Современное делопроизводство. Нормативные основы. Персональные данные Конспект урока по теме: Простые задачи на нахождение процентов
Конспект урока по теме: Простые задачи на нахождение процентов Река Конго
Река Конго Эксплуатация нефтяных и газовых скважин. Методы увеличения дебита скважин
Эксплуатация нефтяных и газовых скважин. Методы увеличения дебита скважин Методы и приборы для измерения состава и свойств веществ
Методы и приборы для измерения состава и свойств веществ Расчет и проектирование протяжек
Расчет и проектирование протяжек Отчет (в форме презентации) о проведении Дня мамы в разновозрастной группе
Отчет (в форме презентации) о проведении Дня мамы в разновозрастной группе ГЕОбитва поколений родительское собрание
ГЕОбитва поколений родительское собрание Интегральные микросхемы
Интегральные микросхемы Пульмонология. Диагноз жасау
Пульмонология. Диагноз жасау Аденоидит. Формы аденоидита. Лечение
Аденоидит. Формы аденоидита. Лечение Конструирование технологической карты урока. Фильм-мотиватор
Конструирование технологической карты урока. Фильм-мотиватор Презентация опыта работы на тему Развитие художественно- творческих способностей детей старшего дошкольного возраста
Презентация опыта работы на тему Развитие художественно- творческих способностей детей старшего дошкольного возраста Виды принтеров. Плюсы и минусы
Виды принтеров. Плюсы и минусы Интерактивная игра Осенние крестики-нолики
Интерактивная игра Осенние крестики-нолики Роль домашнего задания в самообразовании школьника
Роль домашнего задания в самообразовании школьника информационно-коммуникационные технологии в профессиональной деятельности учителя физики.
информационно-коммуникационные технологии в профессиональной деятельности учителя физики. Методы цитологии. Световое микроскопирование
Методы цитологии. Световое микроскопирование 2 Путешествие в страну Грамота (звуки П, Пь. Буква П).
2 Путешествие в страну Грамота (звуки П, Пь. Буква П). Мы читаем. С. Маршак
Мы читаем. С. Маршак Банковская система
Банковская система Бумажная пластика. Игрушки на елке
Бумажная пластика. Игрушки на елке Первичная обр.рыбы
Первичная обр.рыбы Программа развития. Павлова А.А.
Программа развития. Павлова А.А. Презентация Качество подготовки выпускников как следствие диагностики планируемых результатов
Презентация Качество подготовки выпускников как следствие диагностики планируемых результатов Столение начала Первой мировой войны
Столение начала Первой мировой войны