Слайд 2

Вычисление массовой или объемной доли выхода продукции реакции
1.Количество продукта, рассчитанное по
уравнению реакции, - это теоретический выход, он соответствует 100%
2.Практический выход, то есть реально полученное количество вещества, меньше 100%, и обозначается (этта).
Слайд 3

Слайд 4

Сколько л водорода выделится при действии избытка соляной кислоты на 2,7г
алюминия, если выход водорода составляет 90% от теоретического?
Слайд 5

Дано:
m( )=2,7г
Найти:
Vпракт ( )-?л
Слайд 6

Слайд 7

2.Запишем уравнение реакции и найдем
0,1моль хмоль
2Al+6HCl=2AlCl +3H
2моль 3моль
Слайд 8

3.Найдем теоретический выход по V.
Слайд 9

4.Найдем практический выход
Слайд 10

Слайд 11

Закрепление
1.Выход железа при взаимодействии железной окалины с алюминием составляет 85%.Сколько г
железа можно получит из 1кг железной окалины?
Слайд 12

2.Выход водорода в реакции взаимодействия натрия с водой составляет 95%.Сколько литров
водорода получится при растворении в воде 2,3г натрия?











 Материалы, применяемые для изготовления горных инструментов. ТИПИ. Тема 1
Материалы, применяемые для изготовления горных инструментов. ТИПИ. Тема 1 Информационные технологии в профессии. Сфера IT
Информационные технологии в профессии. Сфера IT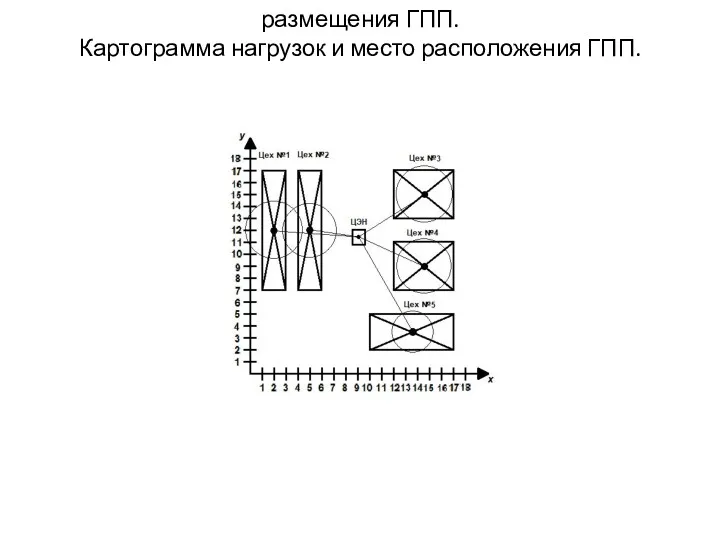 Размещения ГПП. Картограмма нагрузок и место расположения ГПП
Размещения ГПП. Картограмма нагрузок и место расположения ГПП организация и проведение прогулки в детском саду
организация и проведение прогулки в детском саду Что такое музыка. Тест
Что такое музыка. Тест Газетница для хранения газет и журналов
Газетница для хранения газет и журналов Наполняем ваш каталог качественными описаниями товаров
Наполняем ваш каталог качественными описаниями товаров Методическое объединение.
Методическое объединение. Гуманитарные проблемы информационной безопасности
Гуманитарные проблемы информационной безопасности Святая блаженная Матрона Московская
Святая блаженная Матрона Московская Презентация Прогулка по Москве
Презентация Прогулка по Москве Domino Effect Analysis and Assessment of Industrial Sites: A Review of Methodologies and Software Tools
Domino Effect Analysis and Assessment of Industrial Sites: A Review of Methodologies and Software Tools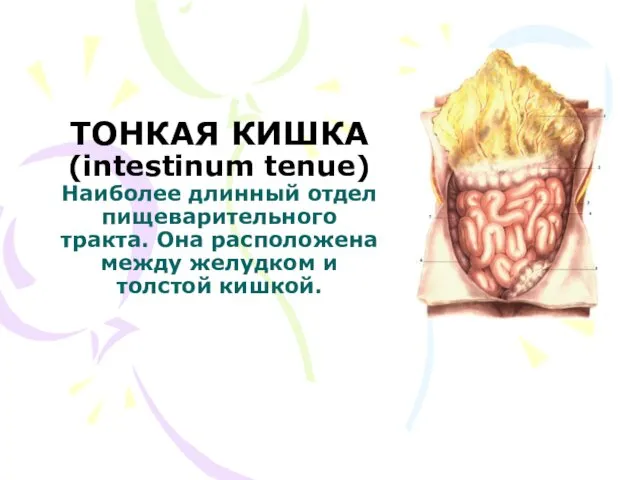 Тонкая кишка. Длина тонкой кишки у человека
Тонкая кишка. Длина тонкой кишки у человека Введение в фармакологию. Основы фармакокинетики
Введение в фармакологию. Основы фармакокинетики Презентация Праздники разных стран мира
Презентация Праздники разных стран мира Опыты с веществами
Опыты с веществами Скажи нет терроризму
Скажи нет терроризму Соединения деталей
Соединения деталей Поделка оригами Зайчик
Поделка оригами Зайчик Устройства электропитания УЭП-МПК
Устройства электропитания УЭП-МПК Что же такое Qlean?
Что же такое Qlean? Газобалонное оборудование второго поколения на СНГ и СПГ
Газобалонное оборудование второго поколения на СНГ и СПГ футбол роботов
футбол роботов Алгоритм Беллмана – Форда
Алгоритм Беллмана – Форда Теория вероятностей. Решение заданий №4
Теория вероятностей. Решение заданий №4 Взаимодествие детей и воспитателя в образовательной области Социально- коммуникативное развитие
Взаимодествие детей и воспитателя в образовательной области Социально- коммуникативное развитие Физические методы в стоматологии
Физические методы в стоматологии Массовое применение кабелей с изоляцией СПЭ в странах Европы и США
Массовое применение кабелей с изоляцией СПЭ в странах Европы и США