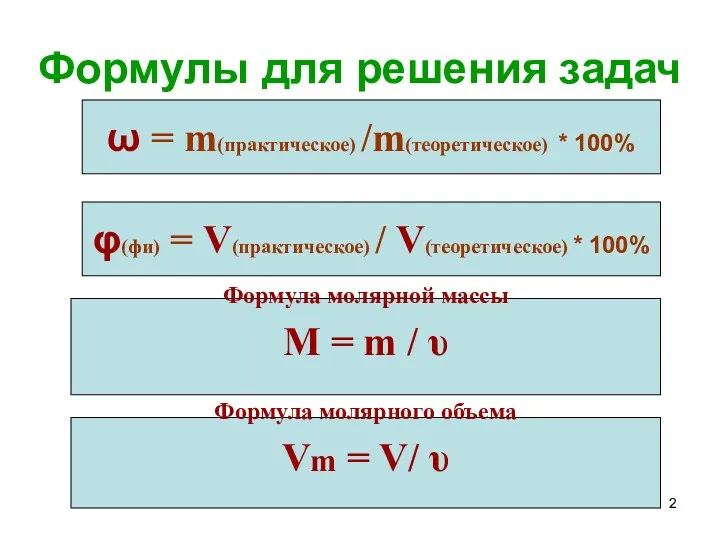
Алгоритм решения задач
Дано:
m(Zn) = 13 г
М(Zn) = 65 г/моль
V(Н2) = 4
л
Vm = 22,4 л/моль
-------------------
Найти: φ (H2) -?
I. Определяем теоретический выход продукта по уравнению реакции
1.Записываем
условие задачи
Решение:
Задача 1 (прямая).
Цинк массой 13 г. растворили в соляной кислоте. Объем выделившегося газа равен 4 л. Определите объемную долю (φ) выхода газа от теоретически возможного
Zn + 2НCl = ZnCl2 + Н2
0,2 моль
1 моль
Х моль
1 моль
3. Составляем мольную пропорцию.
0,2 моль X моль
=
1 моль 1 моль
0,2 · 1
x =
1
= 0,2 моль
2. По формуле молярной массы переводим граммы (13 г) в
моли (0,2 моль) и записываем над уравнением реакции
М = m / υ; υ = m/М; υ(Zn) = 13г / 65 г/моль = 0,2 моль




 Индивидуальная консультация для родителей. Воспитание самостоятельности у детей младшего дошкольного возраста
Индивидуальная консультация для родителей. Воспитание самостоятельности у детей младшего дошкольного возраста Будущее (wecompress.com)
Будущее (wecompress.com) Лаборатория социального проектирования
Лаборатория социального проектирования Русские художественные промыслы
Русские художественные промыслы Бусоград или волшебные игры Феи Бусинки
Бусоград или волшебные игры Феи Бусинки Банкротство коммерческой организации и его прогнозирование
Банкротство коммерческой организации и его прогнозирование Осложнения острого аппендицита. Гнойники брюшной полости
Осложнения острого аппендицита. Гнойники брюшной полости Презентация к уроку 10 класса (базового) по химии 10 класс ТемаКаменный уголь. Фенол
Презентация к уроку 10 класса (базового) по химии 10 класс ТемаКаменный уголь. Фенол Рак шейки матки
Рак шейки матки 20190527_atstekskiy_kalendar
20190527_atstekskiy_kalendar Скребковые перегружатели
Скребковые перегружатели 429e21918e4fb5b5796faa520e64e332
429e21918e4fb5b5796faa520e64e332 Коробочные страховые продукты. Рабочая тетрадь Банк ВТБ
Коробочные страховые продукты. Рабочая тетрадь Банк ВТБ День борьбы со СПИДом
День борьбы со СПИДом Энергия топлива. Удельная теплота сгорания
Энергия топлива. Удельная теплота сгорания Мастер – класс по изготовлению дидактической игрушки для
Мастер – класс по изготовлению дидактической игрушки для Чудотворцы
Чудотворцы Алгоритм. Свойства алгоритма. Способы описания алгоритмов
Алгоритм. Свойства алгоритма. Способы описания алгоритмов Медицинское страхование. Медицинское страхование в системе социального страхования
Медицинское страхование. Медицинское страхование в системе социального страхования Презентация Весенние именинники
Презентация Весенние именинники трофимчук
трофимчук Память, виды и методы тренировки памяти
Память, виды и методы тренировки памяти Моя Педагогическая династия
Моя Педагогическая династия Презентация ко Дню Матери
Презентация ко Дню Матери Криминалистическое почерковедение и автороведение
Криминалистическое почерковедение и автороведение Транспортная инфраструктура
Транспортная инфраструктура Закаливание. Методы закаливания
Закаливание. Методы закаливания Тест по математике за первое полугодие для 1 класса
Тест по математике за первое полугодие для 1 класса