Содержание
- 2. ЦЕЛЬ УРОКА: Установление взаимосвязи между состоянием равновесия системы и способах его регулирования ЗАДАЧИ УРОКА: 1. Рассмотреть
- 3. СОСТОЯНИЕ РАВНОВЕСИЯ В ПРИРОДЕ Постоянство внутренней среды организма: АССИМИЛЯЦИЯ ДИССИМИЛЯЦИЯ Постоянство численности особей в популяции: ЕСТЕСТВЕННЫЙ
- 4. Под … равновесием мы понимаем состояние, в котором свойства системы, определенные экспериментально, не претерпевают дальнейшего изменения
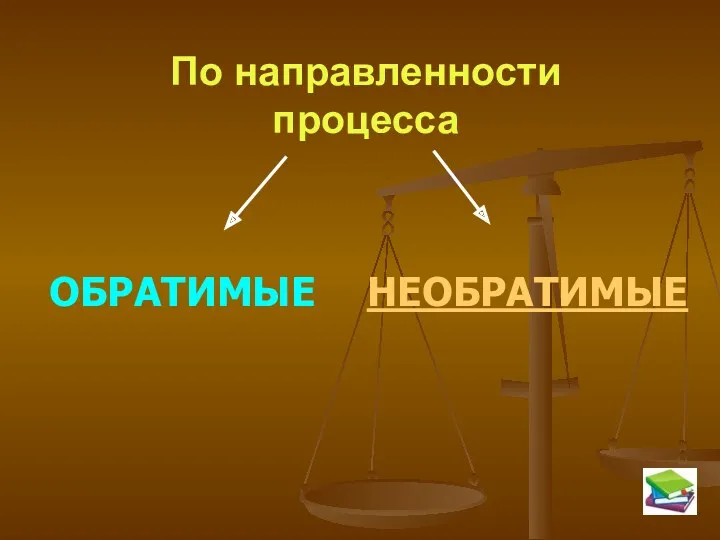
- 5. По направленности процесса ОБРАТИМЫЕ НЕОБРАТИМЫЕ
- 6. Обратимые реакции – это реакции, протекающие в данных условиях одновременно в двух противоположных направлениях Таких реакций
- 7. НЕОБРАТИМЫЕ РЕАКЦИИ – ЭТО РЕАКЦИИ, ПРОТЕКАЮЩИЕ В ДАННЫХ УСЛОВИЯХ ТОЛЬКО В ОДНОМ НАПРАВЛЕНИИ. К ним можно
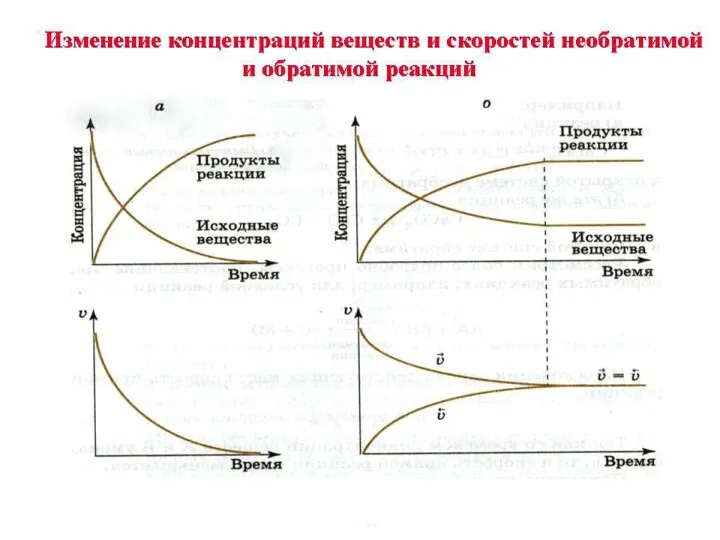
- 8. N 2 + 3 H2 2 NH3 прямая обратная Состояние системы, при котором скорость прямой реакции
- 10. ПРИНЦИП ЛЕ ШАТЕЛЬЕ Если на систему, находящуюся в состоянии равновесия произвести внешнее воздействие (изменить давление, температуру,
- 11. Анри Луи Ле Шателье (8. 10. 1850 – 17. 09. 1936) Французский физикохимик и металловед, член
- 12. 1. Концентрация N2 + 3 H2 Реагирующие вещества Продукты реакции СРЕАГИРУЮЩИХ ВЕЩЕСТВ ВПРАВО СПРОДУКТОВ РЕАКЦИИ ВЛЕВО
- 13. 2. Температура эндотермическая реакция ( - Q ) экзотермическая реакция ( + Q ) N2 +
- 14. Экзотермические реакции – это реакции, протекающие с выделением теплоты. К ним обычно относятся все реакции соединения.
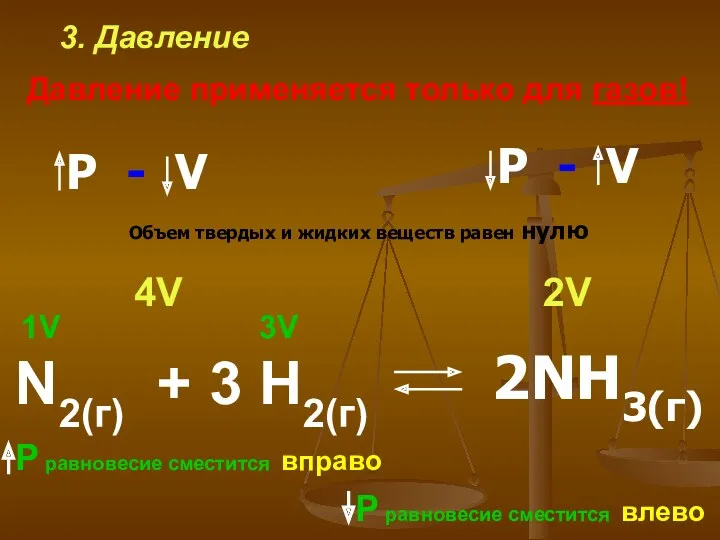
- 16. 3. Давление Давление применяется только для газов! N2(г) + 3 H2(г) 1V 3V 2V 4V Р
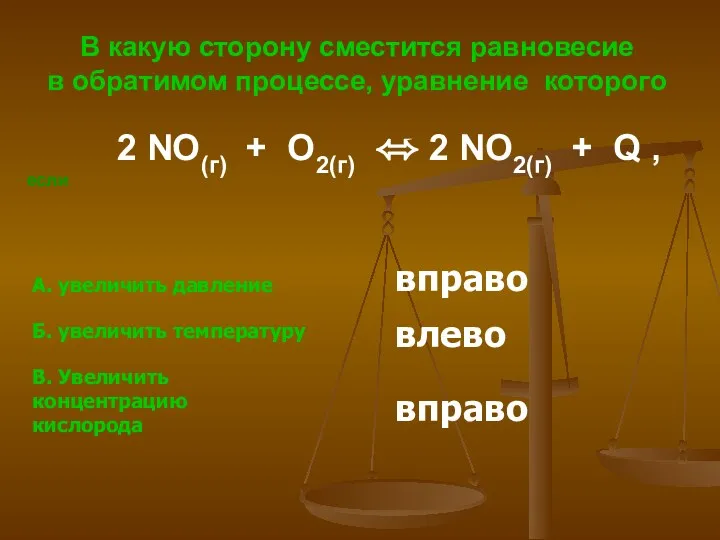
- 17. В какую сторону сместится равновесие в обратимом процессе, уравнение которого 2 NO(г) + O2(г) ⬄ 2
- 18. Как известно, в воздухе содержится 21% кислорода (по массе). Такое количество необходимо для поддержания естественного равновесия:
- 19. Домашнее задание: Принцип Ле Шателье широко используется в химической технологии для повышения выхода продукта производства. Согласуется
- 21. Скачать презентацию














 Решение треугольников
Решение треугольников Взаимодействие клиент-сервер в WWW
Взаимодействие клиент-сервер в WWW Накопители информации
Накопители информации Строительные конструкции из древесины
Строительные конструкции из древесины Лучшие позиции в кровати (позы сна)
Лучшие позиции в кровати (позы сна) Презентация Семейный поход
Презентация Семейный поход Принципиальные электрические схемы питания средств измерения и автоматизации
Принципиальные электрические схемы питания средств измерения и автоматизации Программа Рациональное питание школьника
Программа Рациональное питание школьника Философия марксизма
Философия марксизма Механические процессы
Механические процессы ГОСТ Р 53363-2009. Цифровые радиорелейные линии. Показатели качества. Методы расчета
ГОСТ Р 53363-2009. Цифровые радиорелейные линии. Показатели качества. Методы расчета Manual UTH 05B
Manual UTH 05B для 8 - го класса
для 8 - го класса Внутренние воды Африки
Внутренние воды Африки Презентация к уроку по окружающему миру. Тайга
Презентация к уроку по окружающему миру. Тайга Создание первой страницы сайта
Создание первой страницы сайта Лэпбук Малыши-букаши
Лэпбук Малыши-букаши Численность и воспроизводство населения мира
Численность и воспроизводство населения мира Робототехника и искусственный интеллект
Робототехника и искусственный интеллект Технологические свойства минералов
Технологические свойства минералов Причастие как глагольная форма. Правописание причастий. 10 класс
Причастие как глагольная форма. Правописание причастий. 10 класс Промышленный маркетинг в металлургической отрасли. Стратегический маркетинг и стратегическое позиционирование предприятий
Промышленный маркетинг в металлургической отрасли. Стратегический маркетинг и стратегическое позиционирование предприятий Многопрофильная клиника ООО Медицинский центр жизнь
Многопрофильная клиника ООО Медицинский центр жизнь Религия. Виды религий
Религия. Виды религий Масштаб и его виды
Масштаб и его виды Математический бой
Математический бой Пародонтопатогенді микрофлора
Пародонтопатогенді микрофлора Групповой конфликт
Групповой конфликт