Содержание
- 2. Тест 1) Укажите число валентных электронов и число неспаренных электронов в основном состоянии атома серы: а)
- 3. правильные ответы 1) в 2) г 3) а 4) в 5) г 6) б 7) б
- 4. Соединения серы. Урок подготовила Дуланова И.Т.
- 5. Цели урока: Рассмотреть свойства важнейших соединений серы. Продолжать развивать умение работать с учебником, составлять на основе
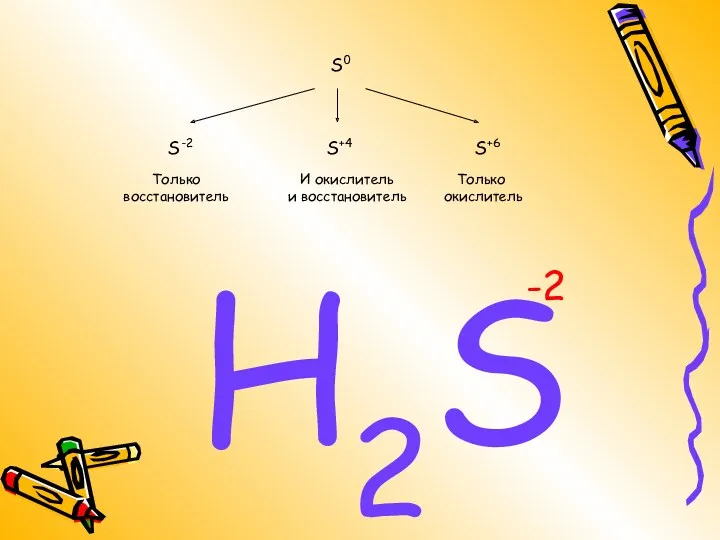
- 6. S0 S-2 S+4 S+6 H2S -2 Только восстановитель Только окислитель И окислитель и восстановитель
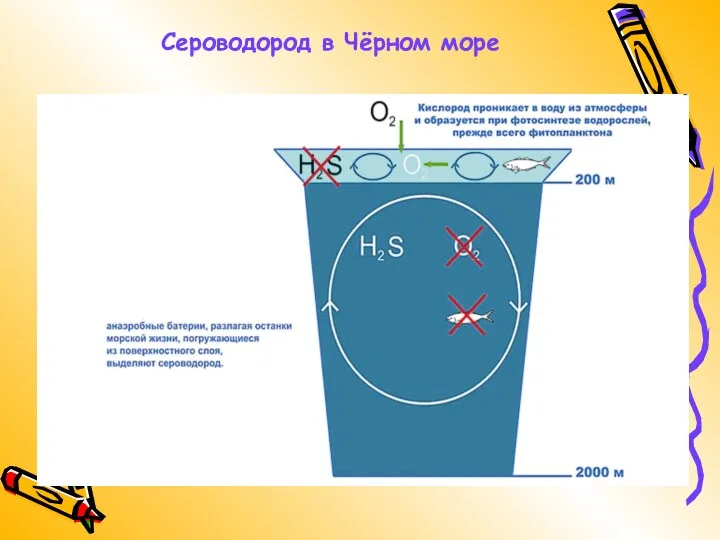
- 7. Сероводород в Чёрном море
- 8. Пользуясь учебником (параграф 23 пункт первый) объясните схему, изображенную на слайде №7. Ответьте письменно на следующие
- 9. SO2 +4
- 10. «Последний день Помпеи» При извержении Везувия в Римской империи погибло много людей и не только от
- 11. Сернистая кислота очень неустойчива и разлагается на исходные вещества: Сернистая кислота двухосновная и образует два вида
- 12. SO3 SO3 +6 SO3 SO3
- 13. При окислении оксида серы (IV) образуется оксид серы (VI). Напишите уравнение реакции. При растворении оксида серы
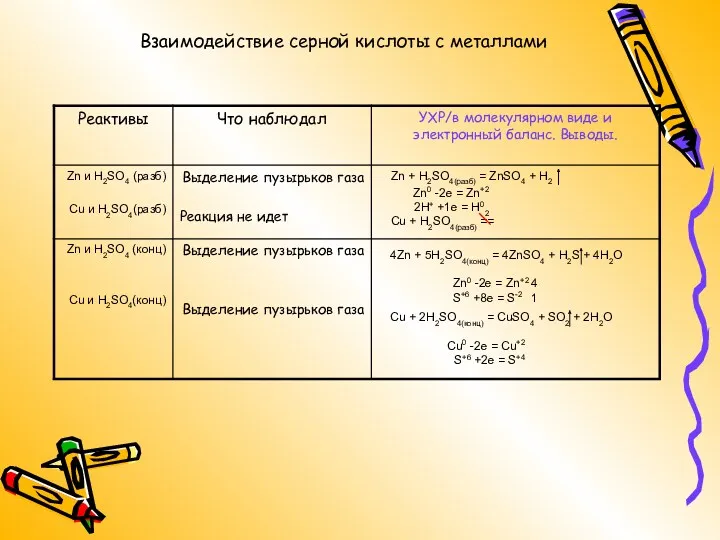
- 14. Взаимодействие серной кислоты с металлами Одинаково ли взаимодействует с металлами концентрированная и разбавленная серная кислота? После
- 15. Zn0 -2e = Zn+2 2H+ +1e = H02 Cu0 -2e = Cu+2 S+6 +2e = S+4
- 16. Гигроскопичность - свойство вещества поглощать влагу из воздуха и из молекул органических веществ. Дайте определение понятию
- 17. Качественная реакция на сульфит и сульфат - ионы. После просмотра видео опыта заполните таблицу: BaCL2, Na2SO3,
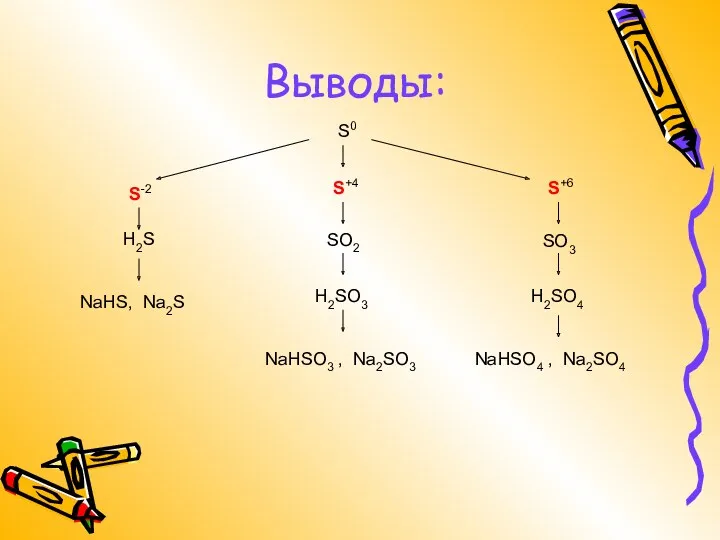
- 18. Выводы: S0 S-2 S+4 S+6 SO2 SO3 H2S NaНSО3 , Na2SО3 NaНSО4 , Na2SО4
- 20. Скачать презентацию













 5 класс 5.02
5 класс 5.02 Герои Холмского края. Челпанов Василий Николаевич
Герои Холмского края. Челпанов Василий Николаевич Трудовое право. Основания для увольнений
Трудовое право. Основания для увольнений Знакомство детей старшего дошкольного возраста с малой родиной - родным городом
Знакомство детей старшего дошкольного возраста с малой родиной - родным городом 20231110_idioadaptatsii_nasekomyh
20231110_idioadaptatsii_nasekomyh Презетация Городище Иднакар
Презетация Городище Иднакар Презентация к уроку Вода. Разновидности воды.
Презентация к уроку Вода. Разновидности воды. Презентация КВН Знайки и Умники в подготовительной группе
Презентация КВН Знайки и Умники в подготовительной группе Внедрение инноваций
Внедрение инноваций 词类. Части речи
词类. Части речи Ситуационное руководство
Ситуационное руководство Лекарственные средства, производные пиридина и пиперазина. (Тема 3)
Лекарственные средства, производные пиридина и пиперазина. (Тема 3) Контрольно-измерительные материалы. Русский язык 3 класс. Состав слова
Контрольно-измерительные материалы. Русский язык 3 класс. Состав слова Основы материаловедения Свойства текстильных материалов. Практическая работа № 5
Основы материаловедения Свойства текстильных материалов. Практическая работа № 5 Структура и функции биологических мембран
Структура и функции биологических мембран Иов Многострадальный
Иов Многострадальный Ценообразование в условиях монополии
Ценообразование в условиях монополии Россия в XVII веке
Россия в XVII веке Cannes
Cannes Биокерамика. Изготовление протезов из биокерамики
Биокерамика. Изготовление протезов из биокерамики Использование ИКТ на уроках математики. Устный счет
Использование ИКТ на уроках математики. Устный счет Центральная Якутия
Центральная Якутия Attractions of Great Britain
Attractions of Great Britain Құбырлы пештер және оның құрлысы
Құбырлы пештер және оның құрлысы Презентация Знакомьтесь, это наша группа!
Презентация Знакомьтесь, это наша группа! Религиозные проблемы современности
Религиозные проблемы современности Гашишная наркомания. Зависимость от психостимуляторов
Гашишная наркомания. Зависимость от психостимуляторов Tobacco Training for PHILIPP shop staff
Tobacco Training for PHILIPP shop staff