Содержание
- 2. «ЗИМНЯЯ НОЧЬ» Б.ПАСТЕРНАК Мело, мело по всей земле Во все пределы. Свеча горела на столе, Свеча
- 3. ХИМИЧЕСКИЙ ЭКСПЕРИМЕНТ Zn + 2HCl = ZnCl2 + H2↑ + Q Признаками проводимой реакции будут выделение
- 4. Количество теплоты, которое выделяется или поглощается при химической реакции, называют тепловым эффектом реакции. Тепловой эффект обозначается
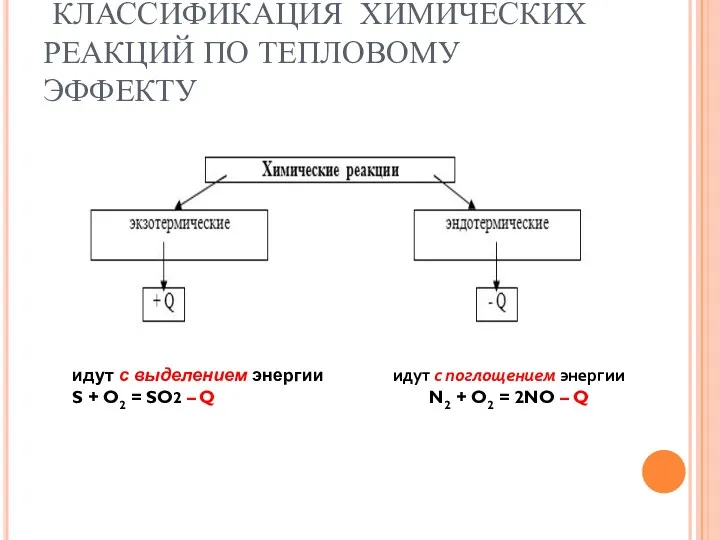
- 5. КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИЙ ПО ТЕПЛОВОМУ ЭФФЕКТУ идут с выделением энергии S + O2 = SO2 –
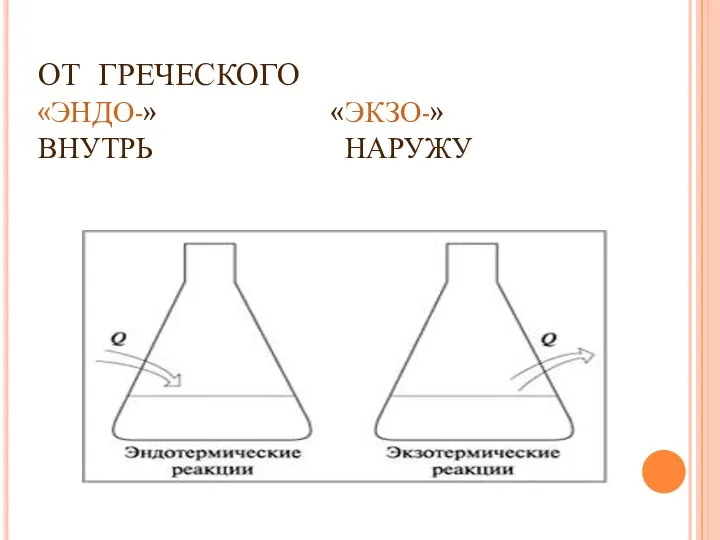
- 6. ОТ ГРЕЧЕСКОГО «ЭНДО-» «ЭКЗО-» ВНУТРЬ НАРУЖУ
- 7. Химические уравнения, в которых указывается тепловой эффект, называют термохимическими. Например: 2HgO —> 2Hg + O2 –
- 8. ГЕРМАН ИВАНОВИЧ ГЕСС -Российский академик -Основоположник термохимии Термохимия — раздел химии, в задачу которого входит определение
- 9. АЛГОРИТМ РЕШЕНИЯ ЗАДАЧ ПО ТЕРМОХИМИЧЕСКОМУ УРАВНЕНИЮ Кратко записать условия задачи (“дано”). Записать термохимическое уравнение реакции (ТХУ),
- 10. ЗАПОЛНИ ПРОПУСКИ 1. Реакции, протекающие с выделением теплоты и света называются реакциями ….. а) разложения; б)
- 11. 2. Какие схемы можно назвать термохимическими уравнениями реакций? а) 2 H2(г) + O2(г) = 2 H2О(ж)
- 12. 3. Какая запись, соответствует эндотермической реакции? а) С(тв) + O2(г) = СO2(г) + 394 кДж б)
- 13. 4. Приведены уравнения реакций: 1. С+О2 = СО2 + 402,24кДж 2. 2HgO = 2Hg + О2
- 14. САМОПРОВЕРКА 1-в 2-а,б 3-б,г 4-г
- 16. Скачать презентацию











 Формирование химических знаний учащихся при использовании информационных технологий
Формирование химических знаний учащихся при использовании информационных технологий портфолио для учителя
портфолио для учителя Темір және марганец
Темір және марганец Послание к Римлянам
Послание к Римлянам Машины постоянного тока
Машины постоянного тока Эргономические особенности организации рабочего места врача-стоматолога. Работа врача с помощником в четыре руки
Эргономические особенности организации рабочего места врача-стоматолога. Работа врача с помощником в четыре руки Организации в экономике
Организации в экономике Современные технологии, как инструмент управления качеством социального обслуживания (семинар-практикум)
Современные технологии, как инструмент управления качеством социального обслуживания (семинар-практикум) Электромагниттік өріс. Электр өрісі туралы түсінік. Магнит өрісі туралы түсінік
Электромагниттік өріс. Электр өрісі туралы түсінік. Магнит өрісі туралы түсінік Альтернативные источники энергии
Альтернативные источники энергии Презентация Береги свою планету
Презентация Береги свою планету Основы финансовых вычислений
Основы финансовых вычислений fb65ccdf64e53e0b0e898abd07c1548
fb65ccdf64e53e0b0e898abd07c1548 OZoWS_GZUQaNOQ1uP_qq2A (1)
OZoWS_GZUQaNOQ1uP_qq2A (1) Машина Голдберга
Машина Голдберга Презентация по черчению на тему Построение третьего вида по двум данным Графическая работа 5
Презентация по черчению на тему Построение третьего вида по двум данным Графическая работа 5 Какая бывает промышленность?
Какая бывает промышленность? Ядерные реакции. Деление ядер урана
Ядерные реакции. Деление ядер урана Reported speech
Reported speech Основные понятия. Принципы электрических измерений
Основные понятия. Принципы электрических измерений Основы проектирования несущих конструкций. Иерархия РЭС и НК
Основы проектирования несущих конструкций. Иерархия РЭС и НК Практика Инжиниринг и анализ данных для студентов в сбытовом блоке группы Газпром нефть
Практика Инжиниринг и анализ данных для студентов в сбытовом блоке группы Газпром нефть Фәнис Яруллин
Фәнис Яруллин Классный час Поговорим о дружбе
Классный час Поговорим о дружбе 20230329_dlya_izucheniya_v_penii
20230329_dlya_izucheniya_v_penii Физкультминутки
Физкультминутки Программа по внеурочной деятельности пректного направления Мой родной край
Программа по внеурочной деятельности пректного направления Мой родной край Архитектура 19 века в России
Архитектура 19 века в России