Содержание
- 2. 20.01.2016. Начало экзамена – 10:00 143 гр. – 338 каб. 146 гр. -- 340 каб. 144
- 3. 21.01.2016. начало экзамена – 10:00 148 гр. – 338 каб. 151 гр. -- 340 каб. 149
- 6. 1. Согласно протонной теории Бренстеда -Лоури амфолиты- это протолиты: не способные отдавать или принимать протон 2.
- 7. 2. Потенциал водородного электрода, опущенного в жидкую фазу раствора НСl с концентрацией 1 моль·дм-3 составляет 0
- 8. 3. В соответствии с законом Генри на растворимость газов в жидкостях оказывает влияние 1. давление 2.
- 9. 4. В коллоидном растворе, полученном при взаимодействии хлорида бария с избытком серной кислоты, потенциалопределяющим ионом является
- 10. 5. Определите заряд и назовите комплексное соединение: [Ni2+(Вr)4 (NH3)2]x 1. -3; диамминотетрабромоникель (II) 2. -2; диамминтетрабромникель
- 11. 6. Задача 1. Какова массовая доля (%) пероксида водорода в растворе, применяемом наружно как кровоостанавливающее и
- 12. Задача 2. Определите молярную концентрацию эквивалента раствора гептагидрата сульфата магния MgSO4 · 7Н2О, применяемого внутривенно для
- 13. Задача 3.Рассчитать молярную концентрацию эквивалента раствора нитрита натрия, содержащего 13,8 г соли в 200 см3 раствора.
- 14. Задача 4. Определите титр раствора натрия гидроксида, если на тирование 5 см3 его раствора израсходовано 5,4
- 15. 7. Рассчитать калорийность булки хлеба «Бородинский» массой 450 г, если его стограммовый кусочек содержит 7,4 г
- 16. Задача 6. Определить изменение энтальпии химической реакции: 2С2Н5ОН(ж) → С2Н5-О-С2Н5(ж) + Н2О(ж) , используя следующие данные:
- 17. 8.
- 18. Задача 7. Вычислить осмотическое давление раствора неэлектролита, в 2 дм3 которого содержится 0,25 моль вещества при
- 19. Задача . Вычислить массу рибозы С5Н10О5, содержащуюся в 4 дм3 раствора при 270С, если осмотическое давление
- 20. Задача . Рассчитать рН раствора соляной кислоты с молярной концентрацией вещества в растворе С(НСl) = 0,001
- 21. Задача. pH желудочного сока равен 1,65. Определить концентрации ионов [H+] и [OH-] в желудочном соке. Дано:
- 22. Задача. Рассчитать рН оксалатной буферной системы, состоящей из100 см3 раствора щавелевой кислоты с концентрацией С(1/2 Н2С2О4)=0,5
- 23. 9. Энтальпия сгорания вещества. Стандартная энтальпия сгорания вещества. Второе следствие из закона Гесса, формулировка, математическое выражение
- 24. 10. Оптическая изомерия: энантиомерия. Д,L – система стереохимической номенклатуры. Написать формулы энанатиомеров 2-гидроксибутаналя, сравнить свойства энантиомеров.
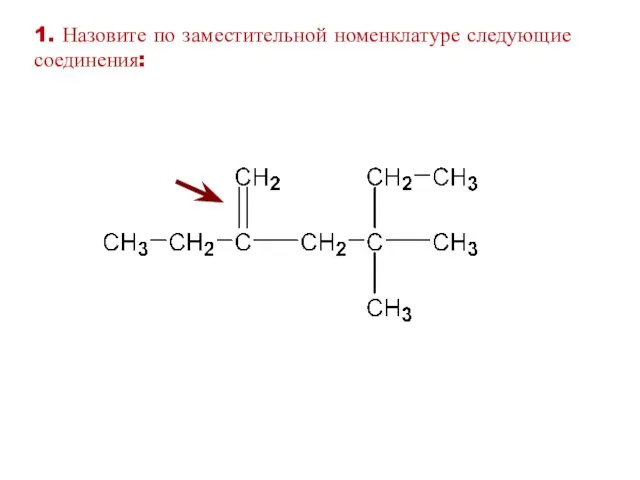
- 25. 1. Назовите по заместительной номенклатуре следующие соединения:
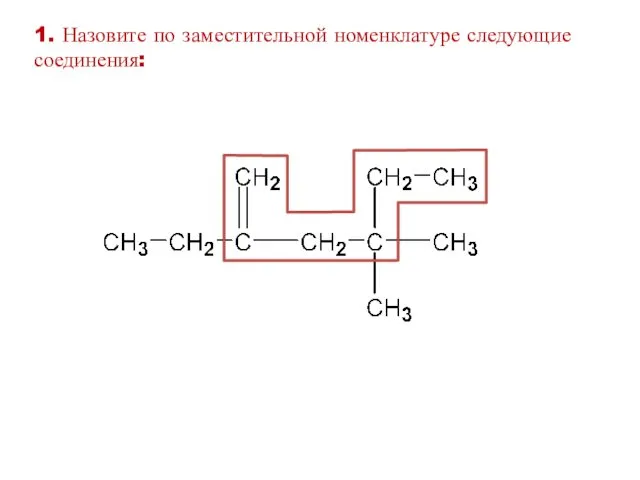
- 26. 1. Назовите по заместительной номенклатуре следующие соединения:
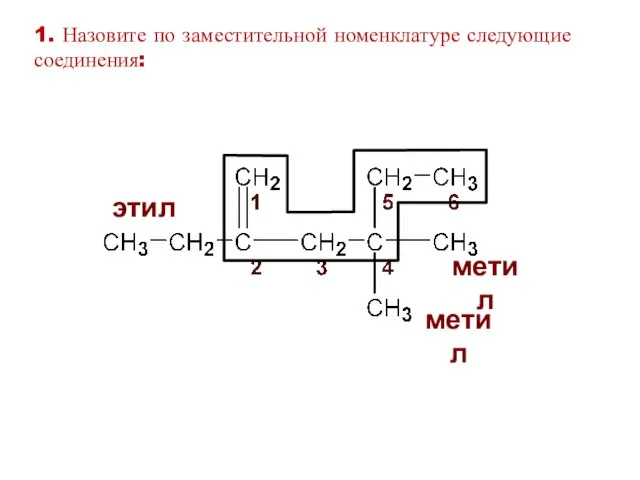
- 27. этил метил метил 1. Назовите по заместительной номенклатуре следующие соединения:
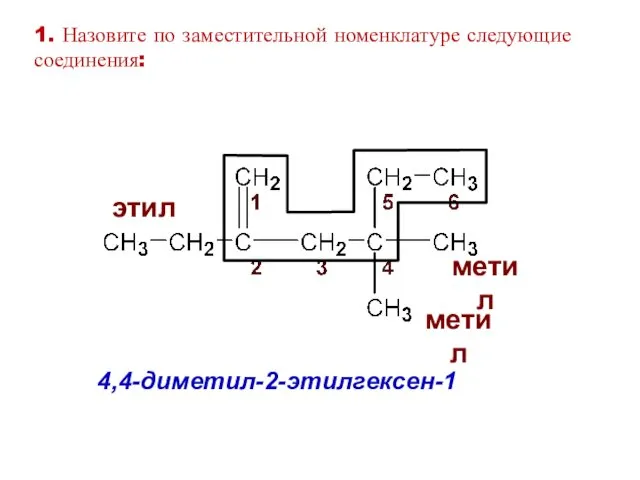
- 28. 4,4-диметил-2-этилгексен-1 этил метил метил 1. Назовите по заместительной номенклатуре следующие соединения:
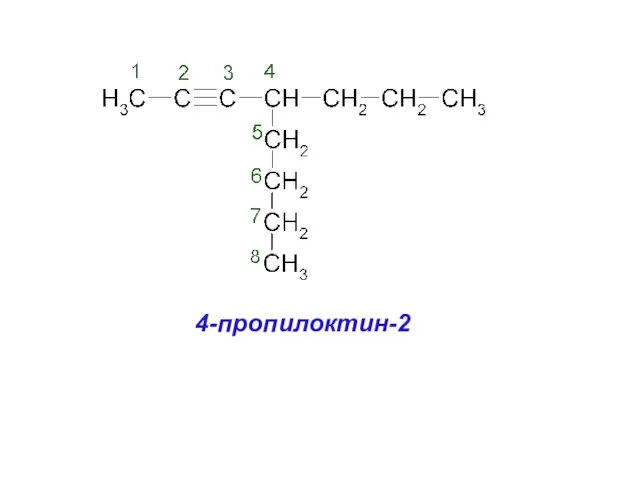
- 29. 4-пропилоктин-2
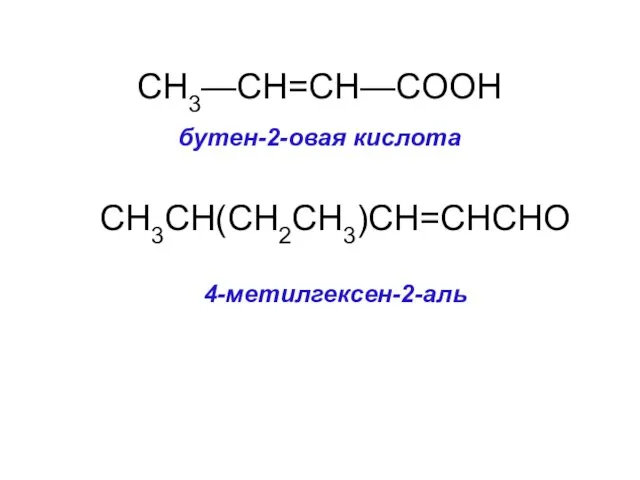
- 30. CH3—CH=CH—COOH бутен-2-овая кислота CH3CH(CH2CH3)CH=CHCHO 4-метилгексен-2-аль
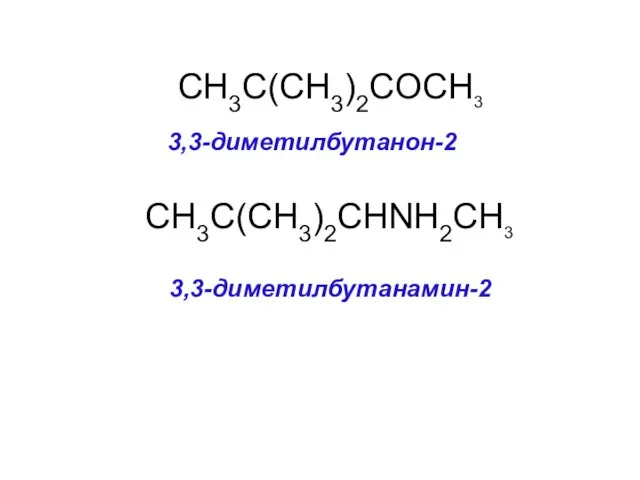
- 31. CH3C(CH3)2COCH3 3,3-диметилбутанон-2 CH3C(CH3)2CHNH2CH3 3,3-диметилбутанамин-2
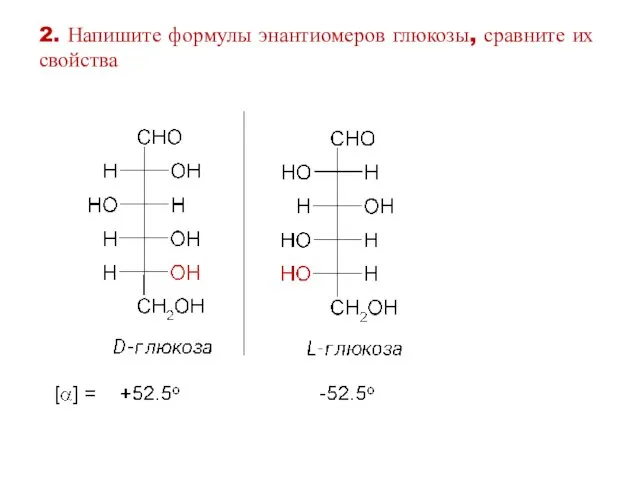
- 32. 2. Напишите формулы энантиомеров глюкозы, сравните их свойства
- 34. Скачать презентацию








![5. Определите заряд и назовите комплексное соединение: [Ni2+(Вr)4 (NH3)2]x 1.](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/42443/slide-9.jpg)










![Задача. pH желудочного сока равен 1,65. Определить концентрации ионов [H+]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/42443/slide-20.jpg)



 Инновационные технологии
Инновационные технологии Презентация классного руководителя, часть 2
Презентация классного руководителя, часть 2 Боги и люди в Синтоизме
Боги и люди в Синтоизме Потенциальная помехоустойчивость. Лекции №3
Потенциальная помехоустойчивость. Лекции №3 Слет МС и МР на Б/о Кичигино ООО Газпром трансгаз Екатеринбург. Мероприятия на 2018 год
Слет МС и МР на Б/о Кичигино ООО Газпром трансгаз Екатеринбург. Мероприятия на 2018 год Выступление на педсовете. Презентация. Повышение качества знаний
Выступление на педсовете. Презентация. Повышение качества знаний Презентация: Дополнительная образовательная программа - аэробика.
Презентация: Дополнительная образовательная программа - аэробика. Петли быстрых планет. Марс, Венера
Петли быстрых планет. Марс, Венера Презентация Теоретический семинар Подготовка обучающихся к участию в олимпиадах
Презентация Теоретический семинар Подготовка обучающихся к участию в олимпиадах Атлас профессий Братского политехнического колледжа
Атлас профессий Братского политехнического колледжа Презентация Культовые сооружения Саратова
Презентация Культовые сооружения Саратова Презентация исследовательской работы Подвиг подольских курсантов
Презентация исследовательской работы Подвиг подольских курсантов Философия. Введение в курс
Философия. Введение в курс Виды компьютерных модемов
Виды компьютерных модемов Лазерные системы сигнализации на железнодорожных переездах
Лазерные системы сигнализации на железнодорожных переездах Микропроцессорные устройства для систем автоматического управления
Микропроцессорные устройства для систем автоматического управления Смольный институт благородных девиц
Смольный институт благородных девиц Домашние птицы. Для дошкольников
Домашние птицы. Для дошкольников Энергетический обмен
Энергетический обмен Российское движение школьников: опыт и перспективы
Российское движение школьников: опыт и перспективы История пилотки (презентация PowerPoint)
История пилотки (презентация PowerPoint) Презентация Реализация системно-деятельностного подхода в работе с детьми дошкольного возраста
Презентация Реализация системно-деятельностного подхода в работе с детьми дошкольного возраста Основные сведения о грунтоведении
Основные сведения о грунтоведении Методы проектирования образовательных программ и индивидуальных образовательных маршрутов обучающихся общеобразовательных школ
Методы проектирования образовательных программ и индивидуальных образовательных маршрутов обучающихся общеобразовательных школ The Beatles - британская рок-группа из Ливерпуля
The Beatles - британская рок-группа из Ливерпуля Датчики. Реле
Датчики. Реле Платежный баланс Статистическая система мирохозяйственных связей
Платежный баланс Статистическая система мирохозяйственных связей Развитие лексико - грамматического строя речи для детей (4 - 7 лет) презентация. Тема: Дикие животные наших лесов
Развитие лексико - грамматического строя речи для детей (4 - 7 лет) презентация. Тема: Дикие животные наших лесов