Содержание
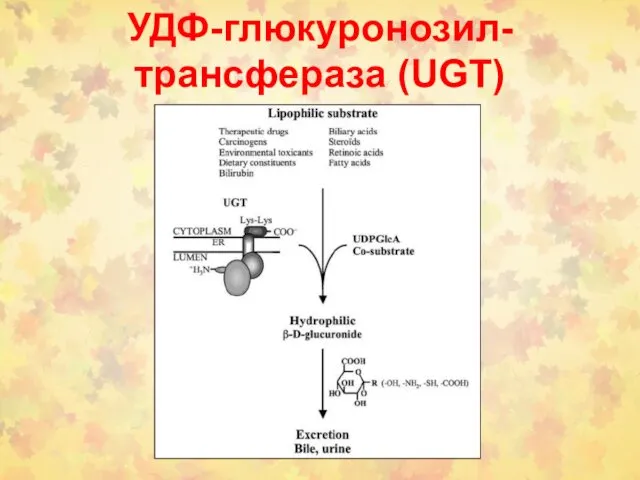
- 2. УДФ-глюкуронозил-трансфераза (UGT)
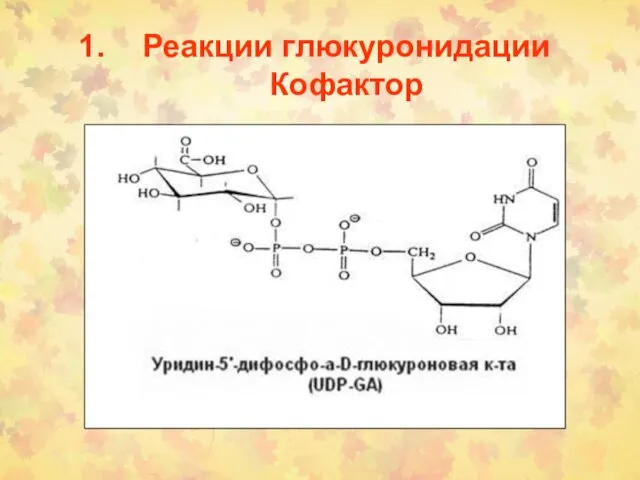
- 3. Реакции глюкуронидации Кофактор
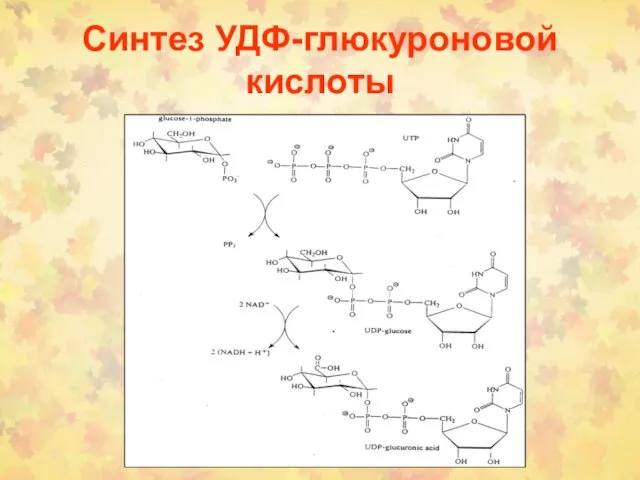
- 4. Синтез УДФ-глюкуроновой кислоты
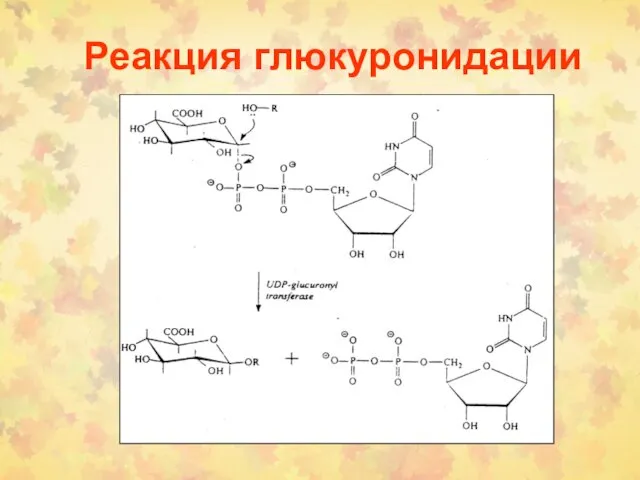
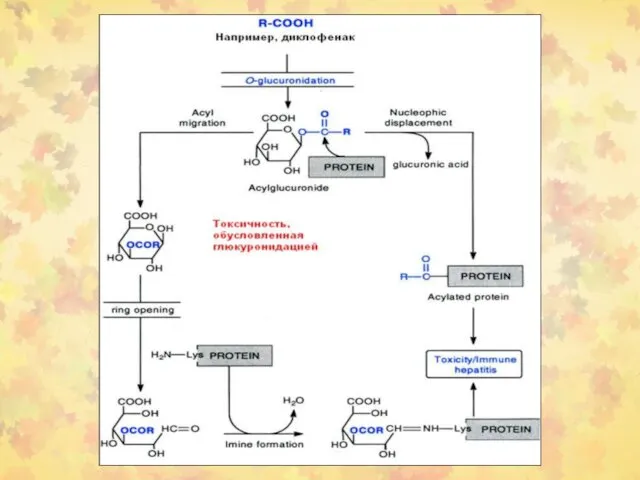
- 5. Реакция глюкуронидации
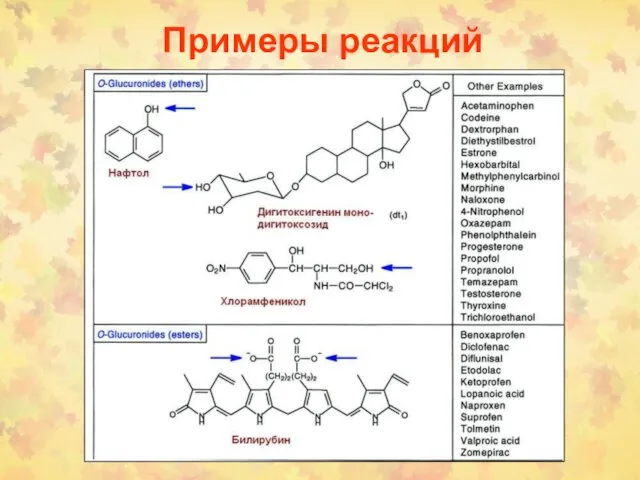
- 6. Примеры реакций
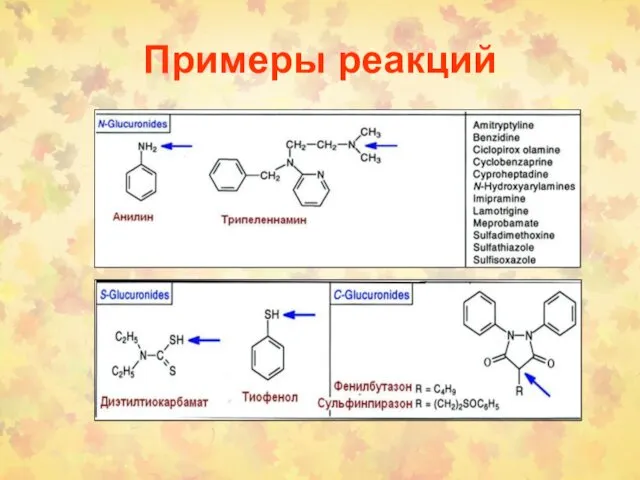
- 7. Примеры реакций
- 9. Субстраты для UGTs (UGTs; EC 2.4.1.17) Эндогенные субстраты: билирубин, стероидные гормоны, тиреоидные гормоны, желчные кислоты, жирорастворимые
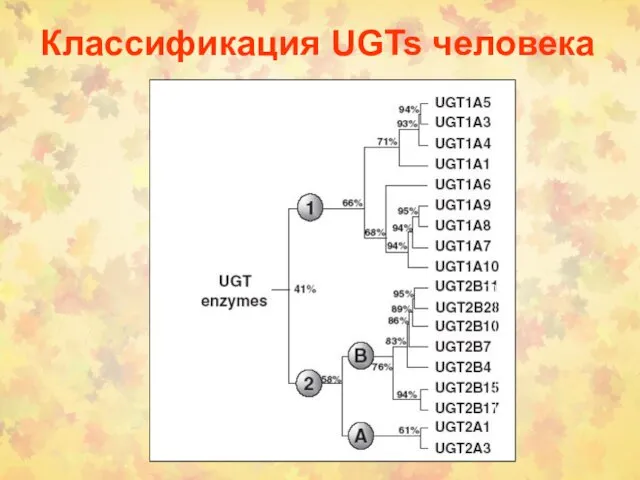
- 10. Классификация UGTs человека
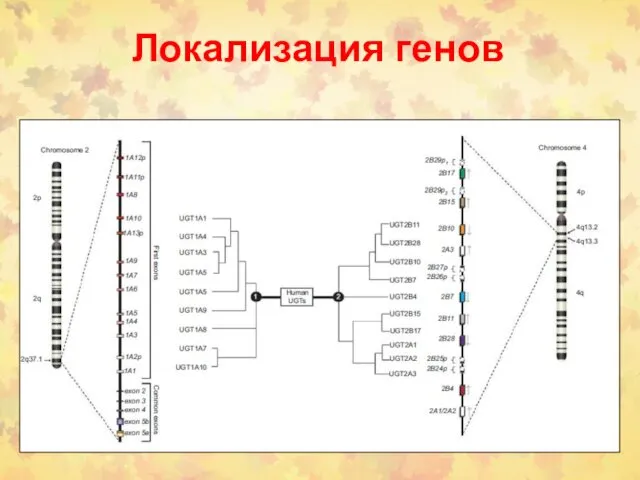
- 11. Локализация генов
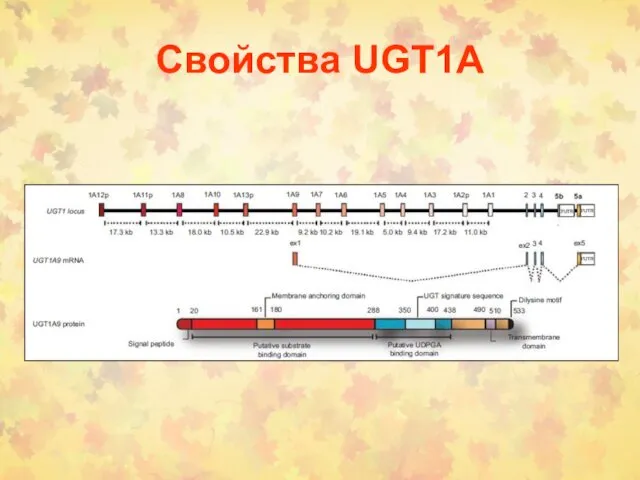
- 12. Свойства UGT1А
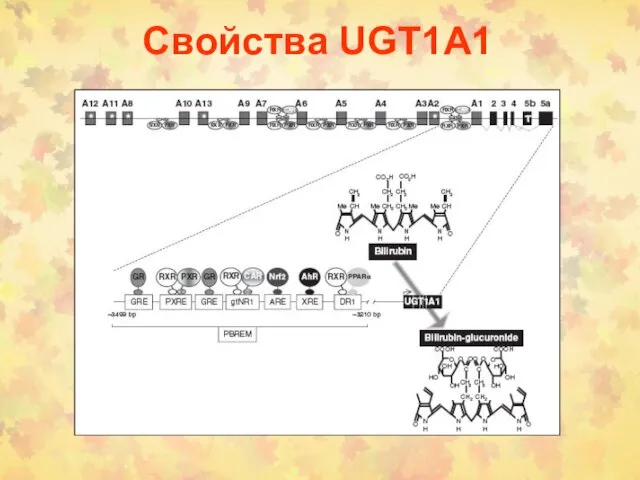
- 13. Свойства UGT1А1
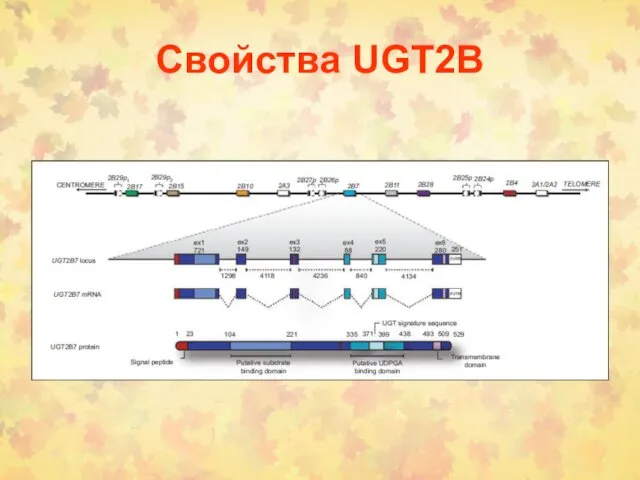
- 14. Свойства UGT2B
- 15. Регуляция экспрессии генов ферментов 2-й фазы
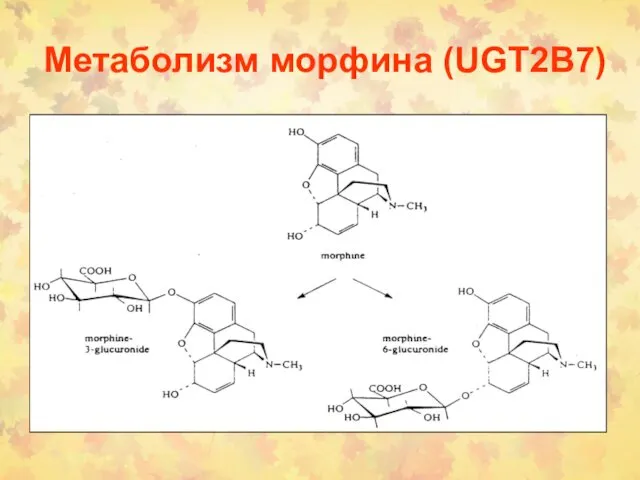
- 16. Метаболизм морфина (UGT2B7)
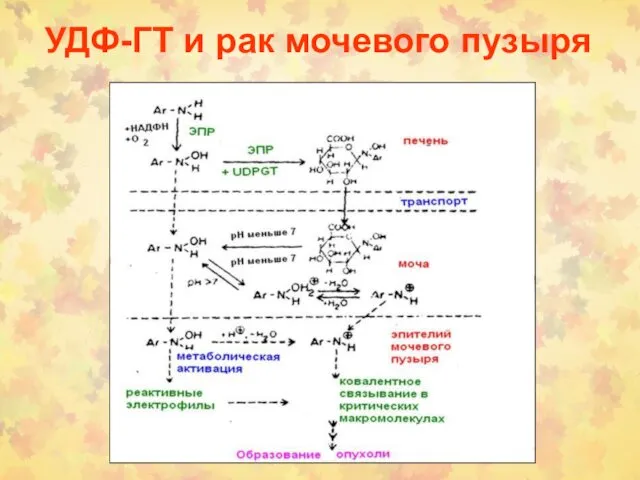
- 17. УДФ-ГТ и рак мочевого пузыря
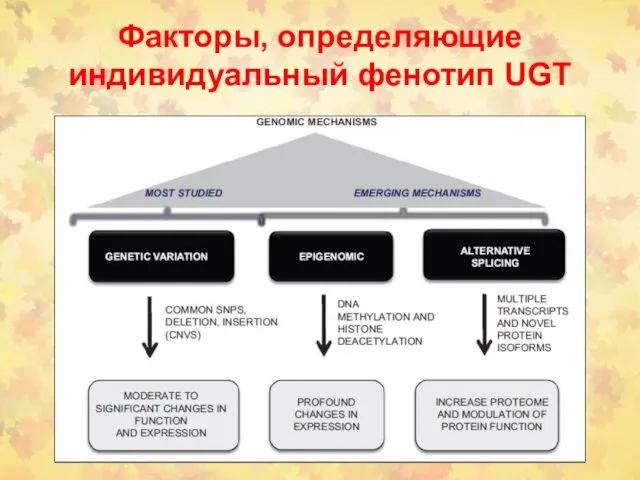
- 18. Факторы, определяющие индивидуальный фенотип UGT
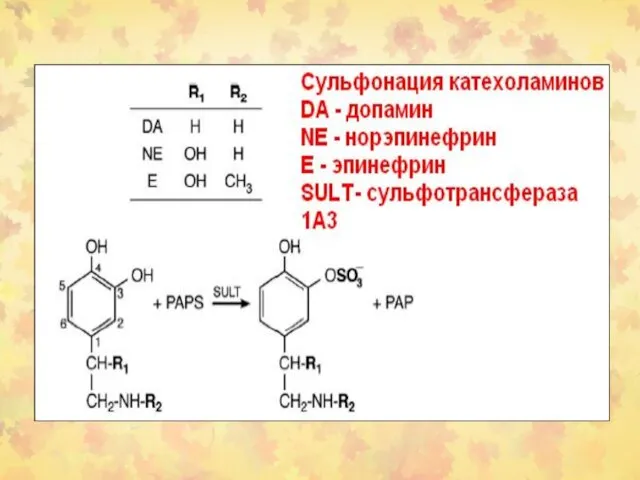
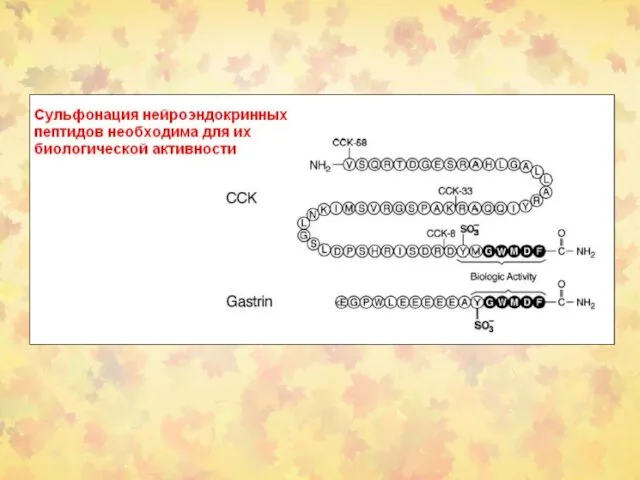
- 19. 2. Сульфонирование Судьфонируются соединения м.м. от 10 000 до 1 000 000 и выше. Метаболиты (сульфонаты)
- 20. Субстраты Ксенобиотики Гормоны Глюкозоаминоглюканы и протеогликаны Низкомолекулярные клеточные компоненты (катехоламины, иодотирозины, витамин С.
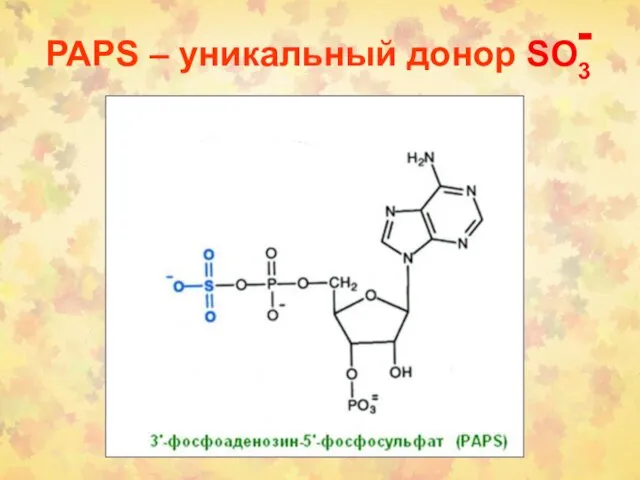
- 21. PAPS – уникальный донор SO3 -
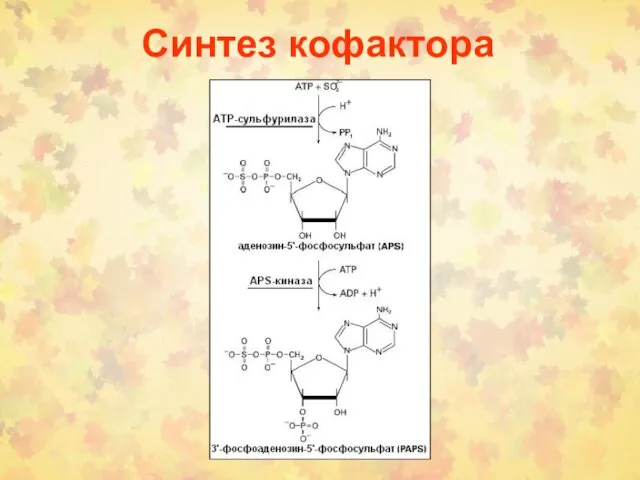
- 22. Синтез кофактора
- 23. PAPS-деградирующие ферменты Содержание PAPS: У крыс в печени и почках – до 160 и 50 нмоль/г
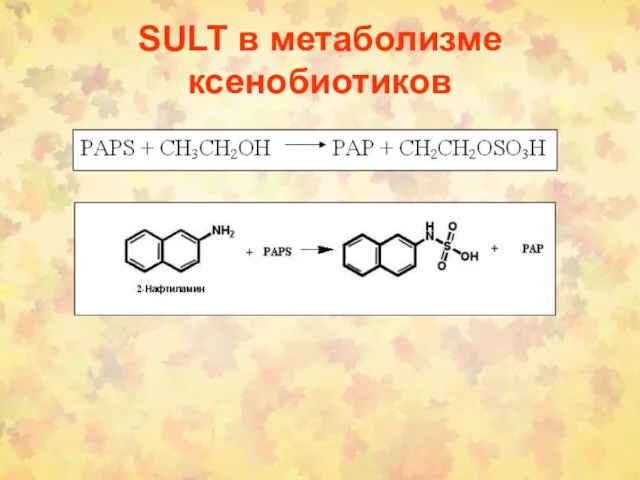
- 24. SULT в метаболизме ксенобиотиков
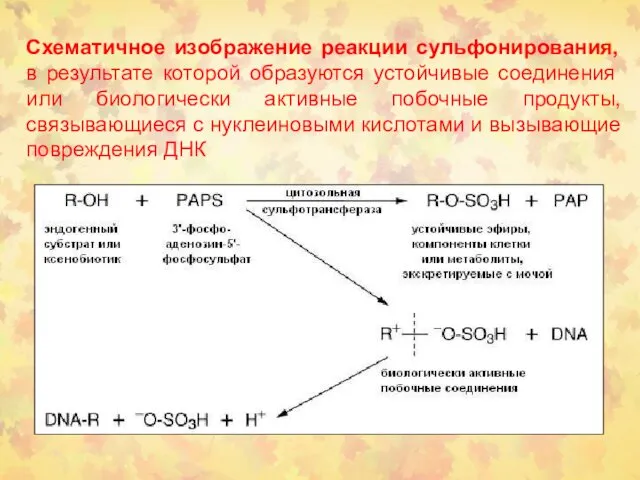
- 25. Схематичное изображение реакции сульфонирования, в результате которой образуются устойчивые соединения или биологически активные побочные продукты, связывающиеся
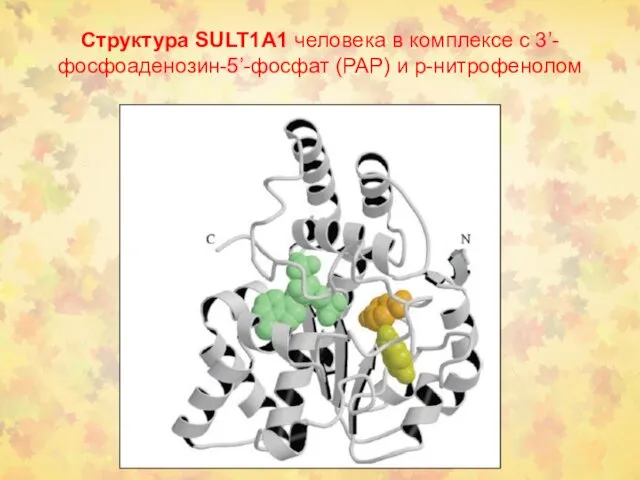
- 26. Структура SULT1A1 человека в комплексе с 3’-фосфоаденозин-5’-фосфат (PAP) и р-нитрофенолом
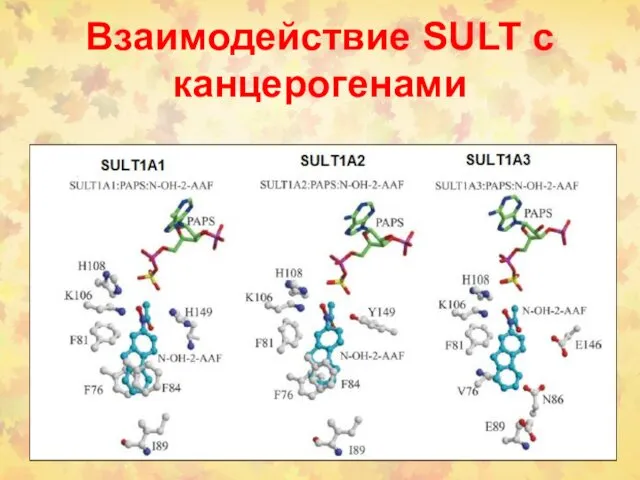
- 27. Взаимодействие SULT c канцерогенами
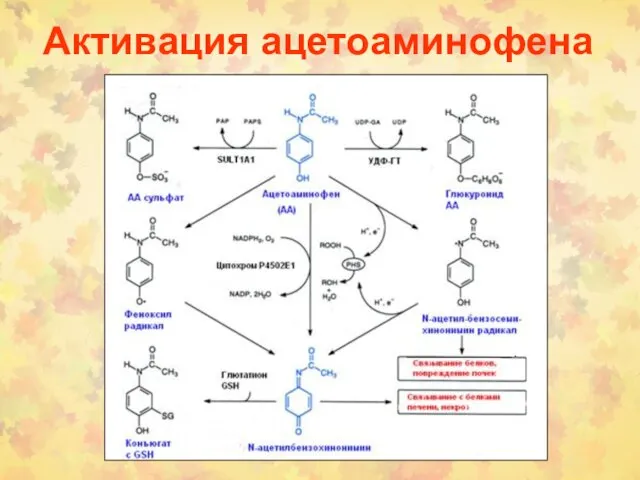
- 28. Активация ацетоаминофена
- 29. Регуляция экспрессии генов ферментов 2-й фазы
- 30. AHR-регулируемые гены
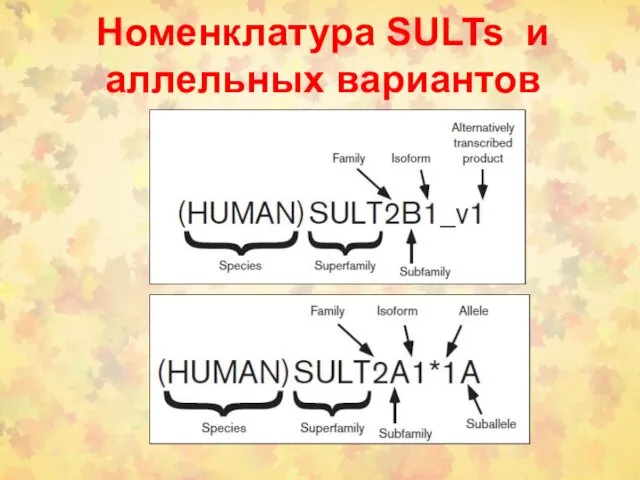
- 31. Номенклатура SULTs и аллельных вариантов
- 32. Генная структура SULTs
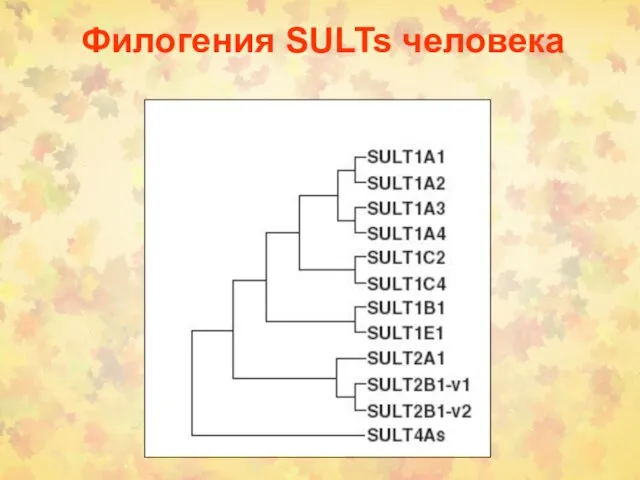
- 33. Филогения SULTs человека
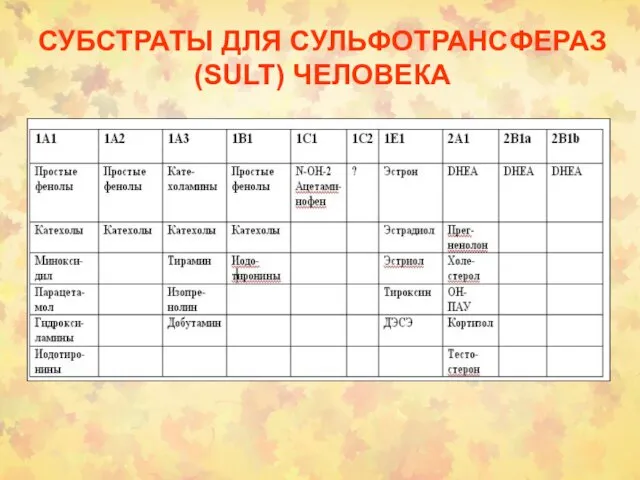
- 34. СУБСТРАТЫ ДЛЯ СУЛЬФОТРАНСФЕРАЗ (SULT) ЧЕЛОВЕКА
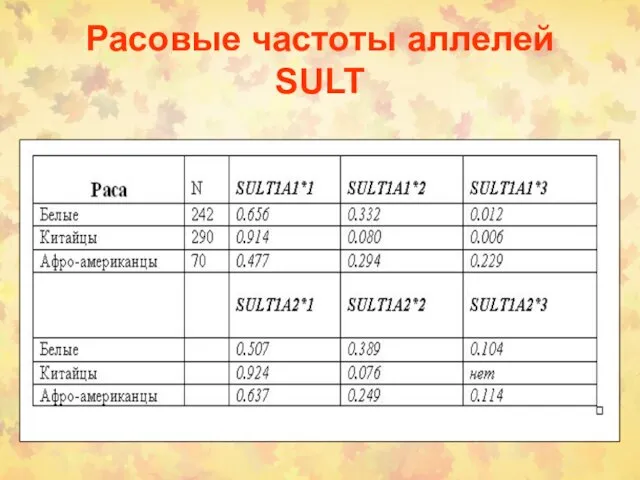
- 35. Расовые частоты аллелей SULT
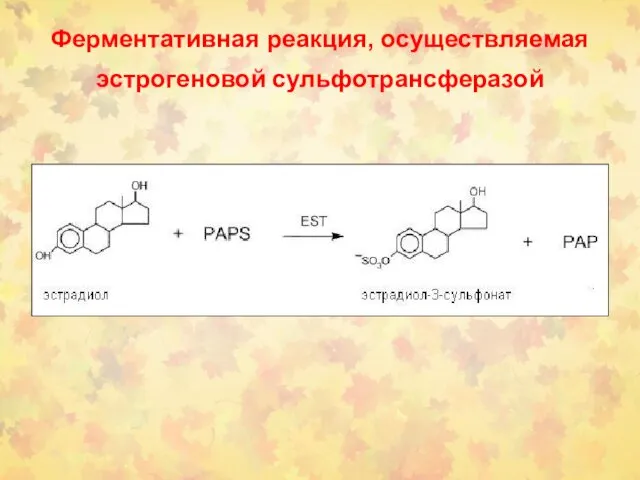
- 36. Ферментативная реакция, осуществляемая эстрогеновой сульфотрансферазой
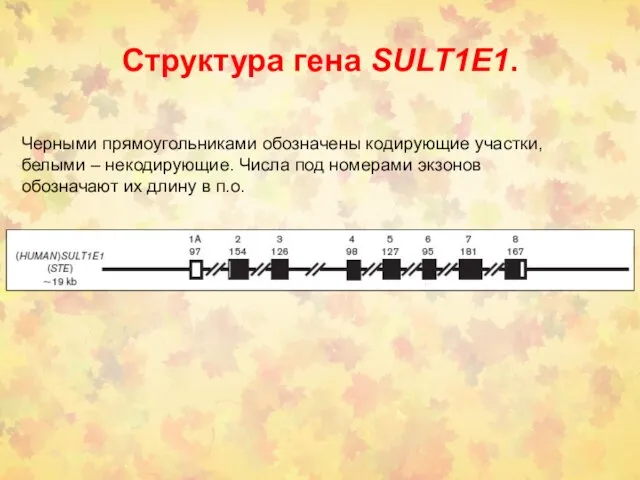
- 37. Структура гена SULT1E1. Черными прямоугольниками обозначены кодирующие участки, белыми – некодирующие. Числа под номерами экзонов обозначают
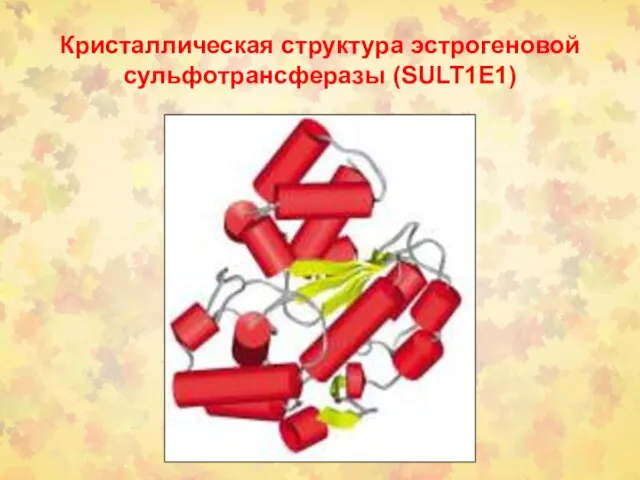
- 38. Кристаллическая структура эстрогеновой сульфотрансферазы (SULT1E1)
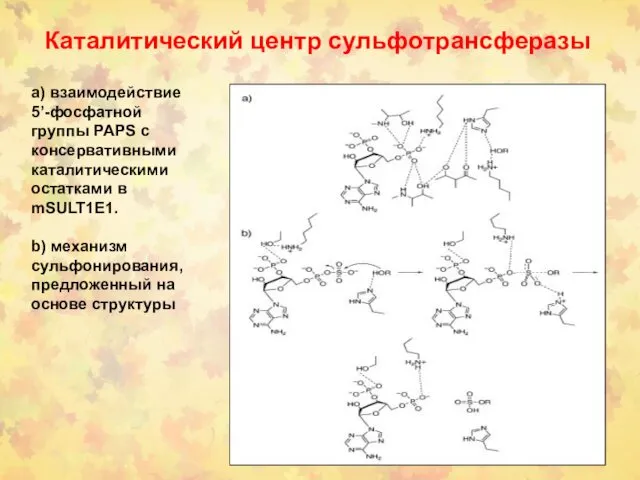
- 39. Каталитический центр сульфотрансферазы а) взаимодействие 5’-фосфатной группы PAPS с консервативными каталитическими остатками в mSULT1E1. b) механизм
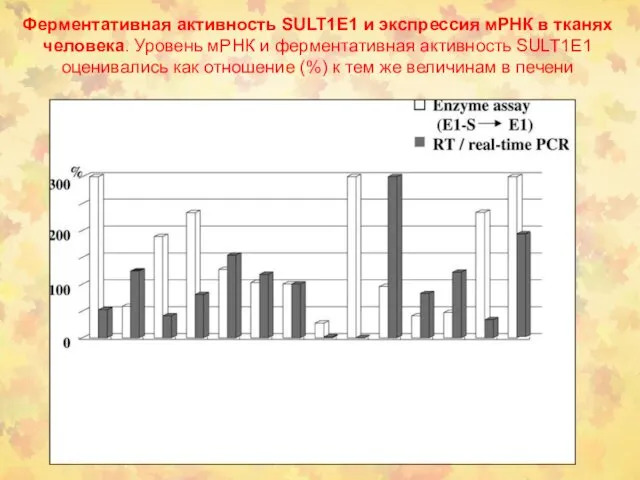
- 40. Ферментативная активность SULT1E1 и экспрессия мРНК в тканях человека. Уровень мРНК и ферментативная активность SULT1E1 оценивались
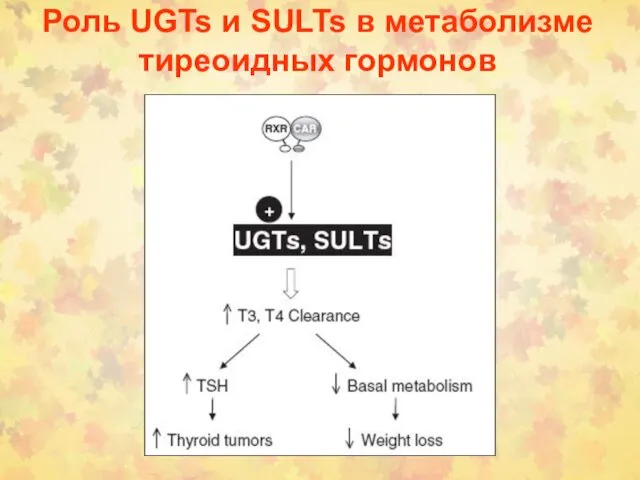
- 42. Роль UGTs и SULTs в метаболизме тиреоидных гормонов
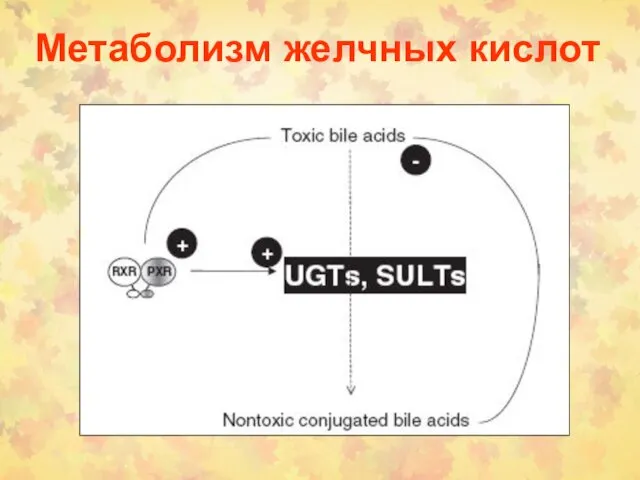
- 43. Метаболизм желчных кислот
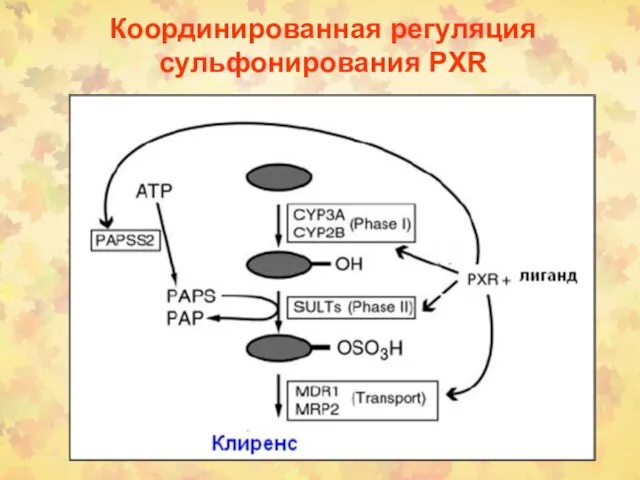
- 44. Координированная регуляция сульфонирования PXR
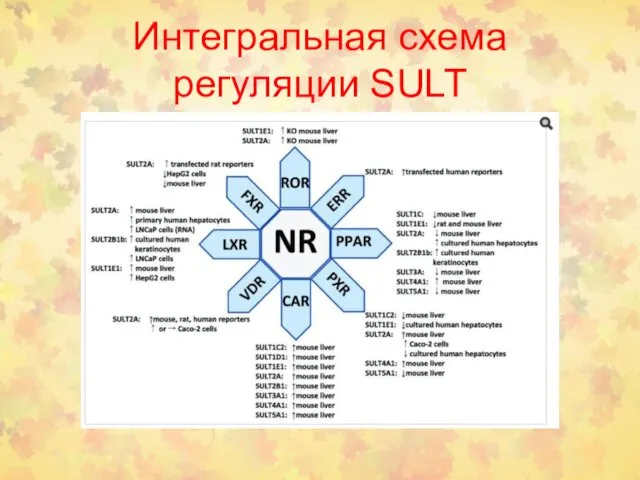
- 45. Интегральная схема регуляции SULT
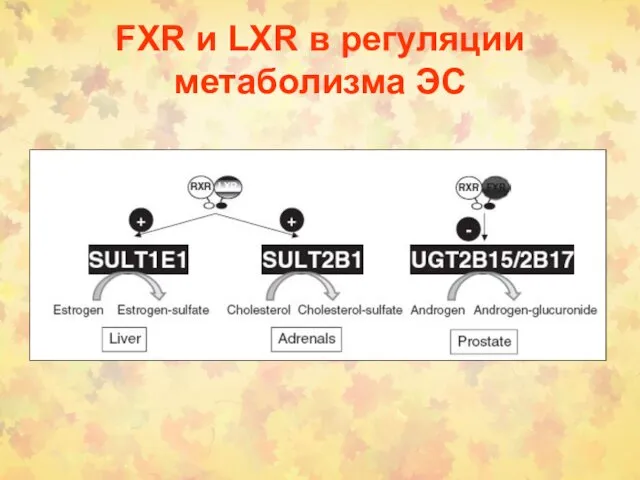
- 46. FXR и LXR в регуляции метаболизма ЭС
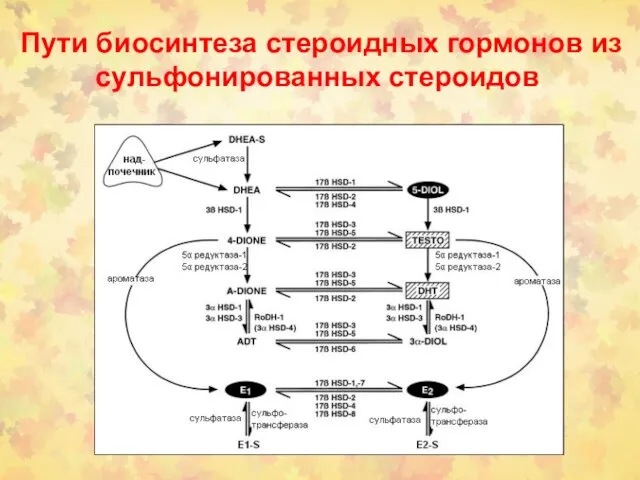
- 50. Пути биосинтеза стероидных гормонов из сульфонированных стероидов
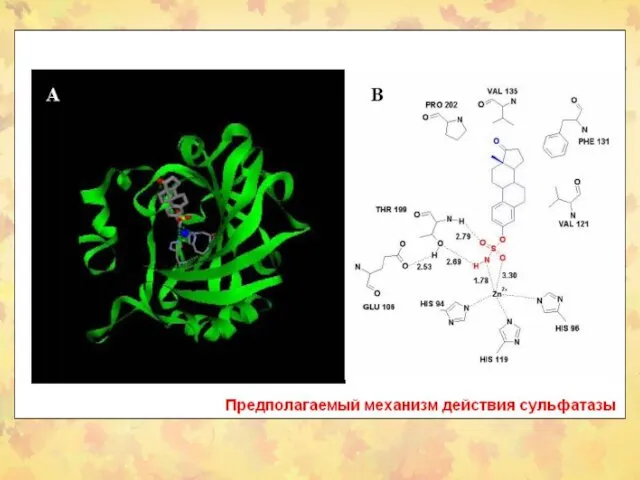
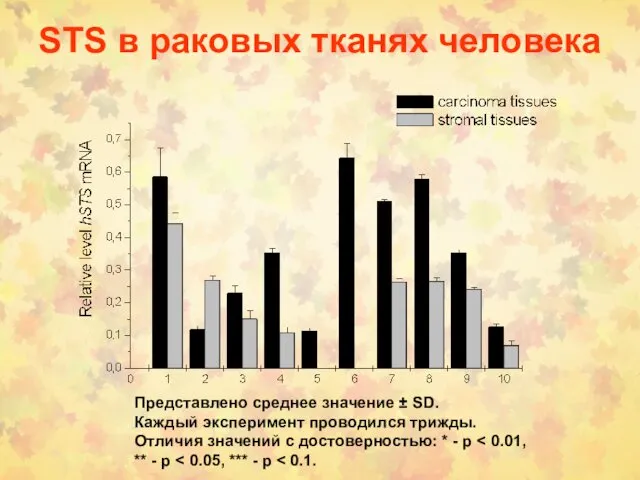
- 53. STS в раковых тканях человека Представлено среднее значение ± SD. Каждый эксперимент проводился трижды. Отличия значений
- 54. 3. Реакции, катализируемые глутатион S-трансферазами ГSТ могут катализировать нуклеофильные производные ароматических соединений, эпоксидов, восстановление гидропероксидов с
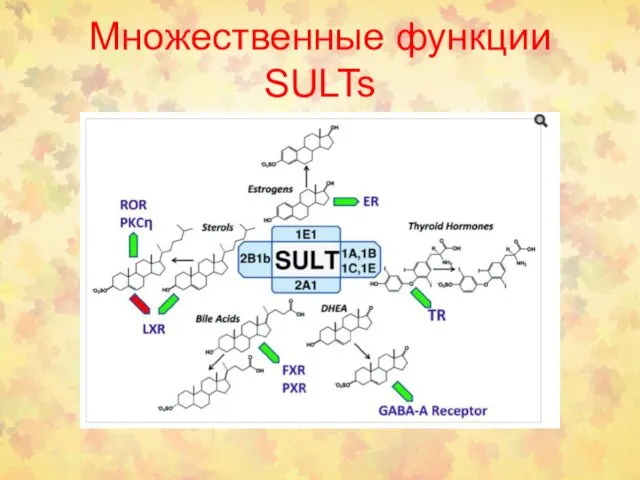
- 55. Множественные функции SULTs
- 56. Функции GSТs Каталитическая Лиганд-связывающая Механизм МЛР (MDR) ГSТs – 1. Цитозольные 2. Микросомальные Это мультигенное суперсемейство.
- 57. Механизм реакции Это димерные белки. Активный центр содержит тирозин(A), серин (B) или цистеин (C). Они взаимодействуют
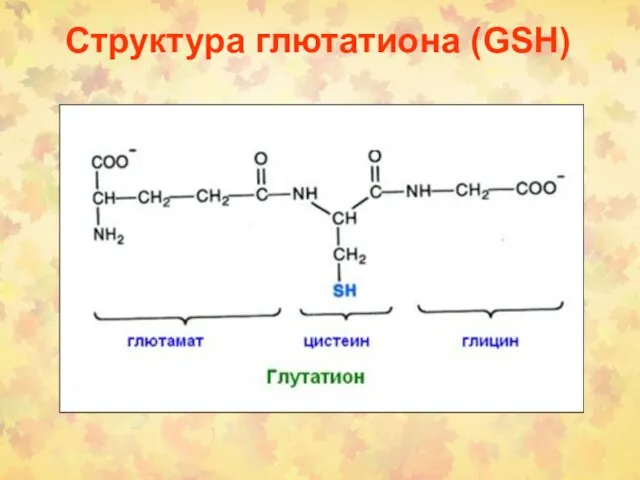
- 58. Структура глютатиона (GSH)
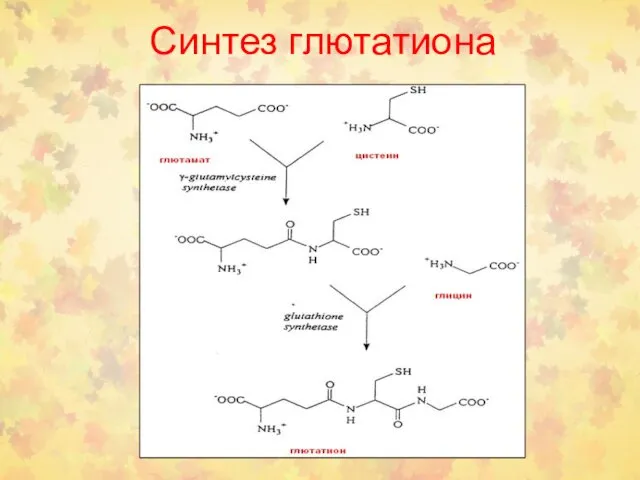
- 59. Синтез глютатиона
- 60. Функции GSH 1. Поставщик тиоловых групп 2. Защита тиолов белков от окисления в дисульфиды 3. Участие
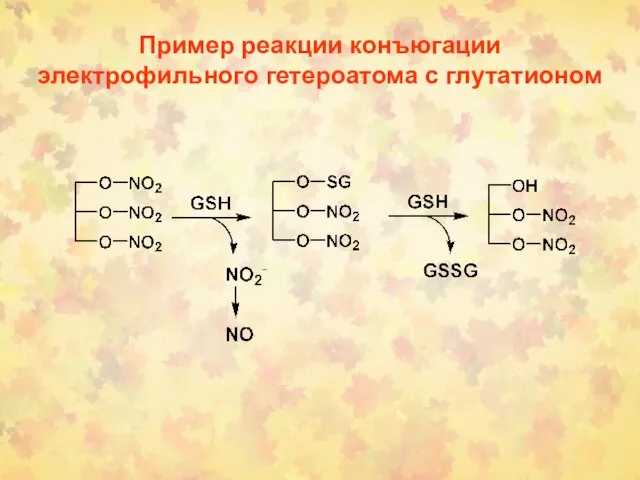
- 61. Пример реакции конъюгации электрофильного гетероатома с глутатионом
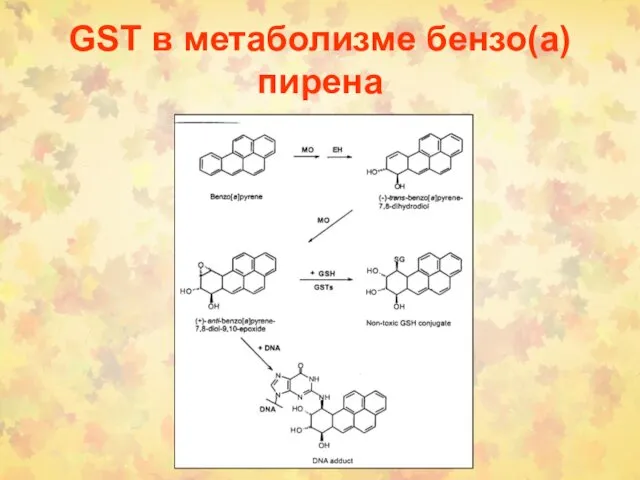
- 62. GSТ в метаболизме бензо(а)пирена
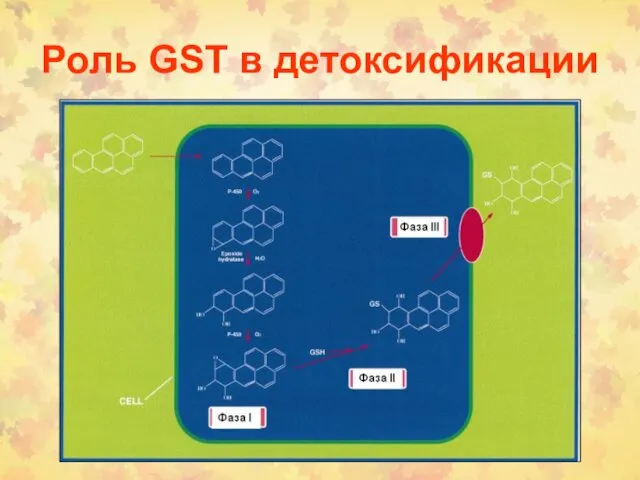
- 63. Роль GST в детоксификации
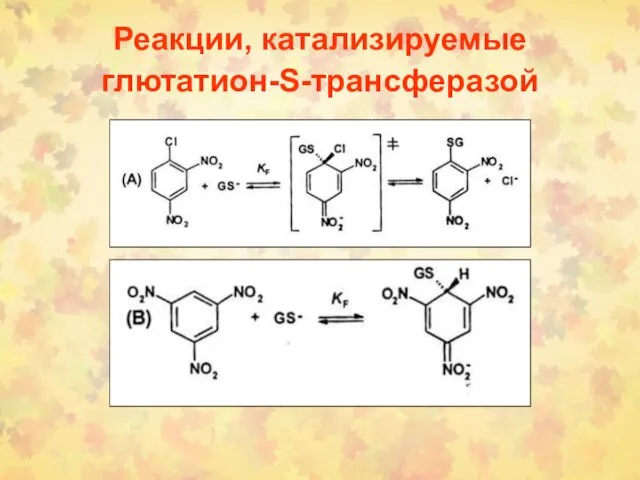
- 64. Реакции, катализируемые глютатион-S-трансферазой
- 65. Классификация GSTs Alpha/Mu/Pi classes Theta class Kappa class Zeta class Omega class Sigma class
- 66. Alpha-class GSTs Выявлено по крайней мере 6 типов субъединиц: A1, A2, A3, A4, A5 и A6
- 67. Mu-class GSTs По крайней мере 6 субъединиц Mu-class (M1, M2, M3, M4, M5 и M6 у
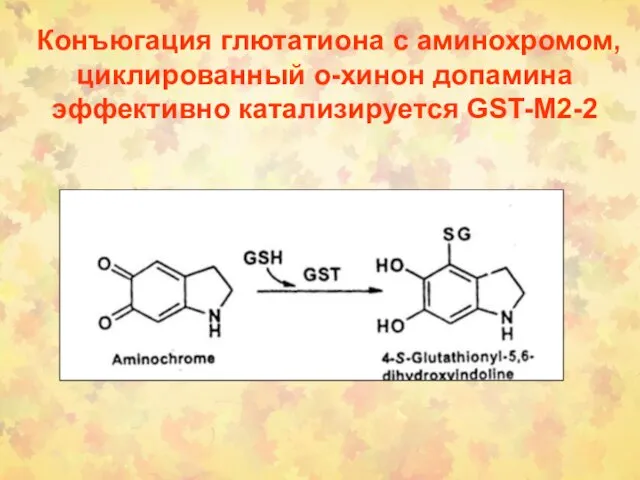
- 68. Конъюгация глютатиона с аминохромом, циклированный о-хинон допамина эффективно катализируется GST-M2-2
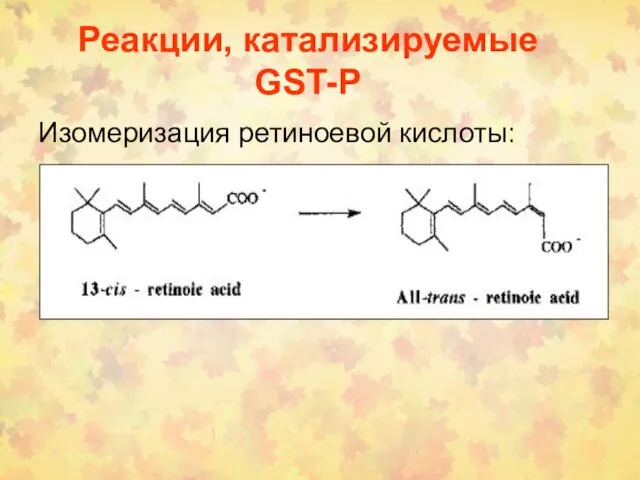
- 69. Реакции, катализируемые GST-P Изомеризация ретиноевой кислоты:
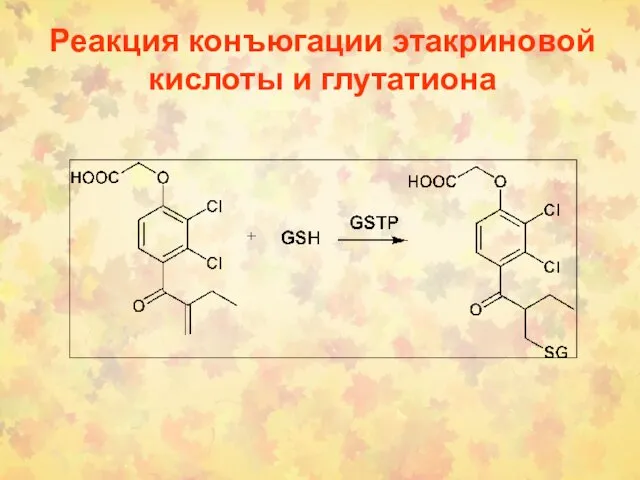
- 70. Реакция конъюгации этакриновой кислоты и глутатиона
- 71. GST theta class 7% гомологии с Alpha, Mu, Pi classes Не взаимодействует с 1-chloro-2,4-dinitrobenzene Имеет серин
- 72. GST kappa class В структуре белка нет SNAIL/TRAIL motif
- 73. GST omega class Высокая активность по отношению к CDNB, 7- chloro-4-nitrobenzo-2-oxa-1,3-diazole, p-nitrophenyl acetate. Обладает тиол-трансферазной и
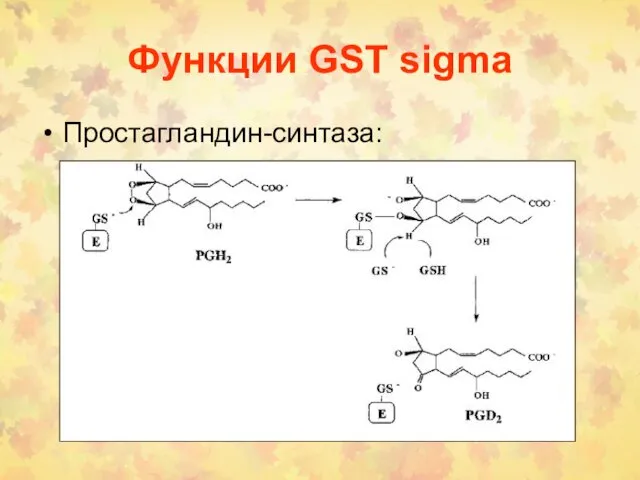
- 74. Функции GST sigma Простагландин-синтаза:
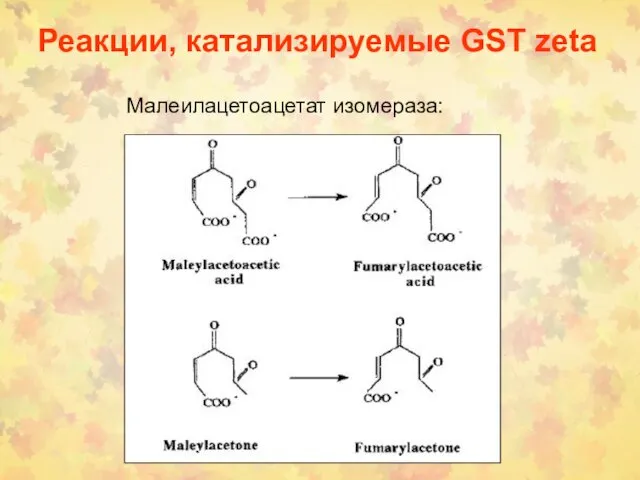
- 75. Реакции, катализируемые GST zeta Малеилацетоацетат изомераза:
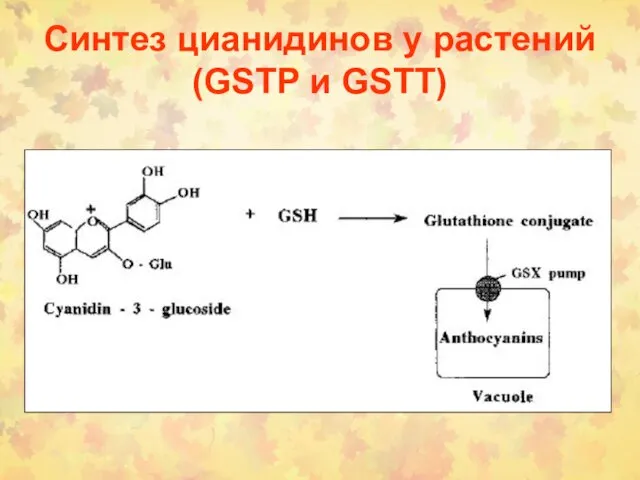
- 76. Синтез цианидинов у растений (GSTP и GSTT)
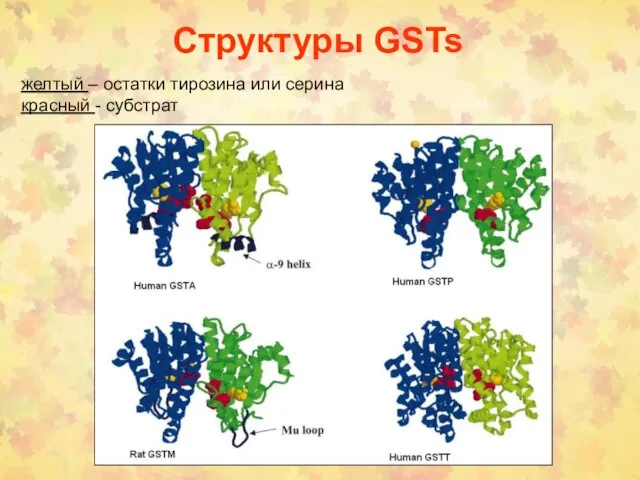
- 77. Структуры GSTs желтый – остатки тирозина или серина красный - субстрат
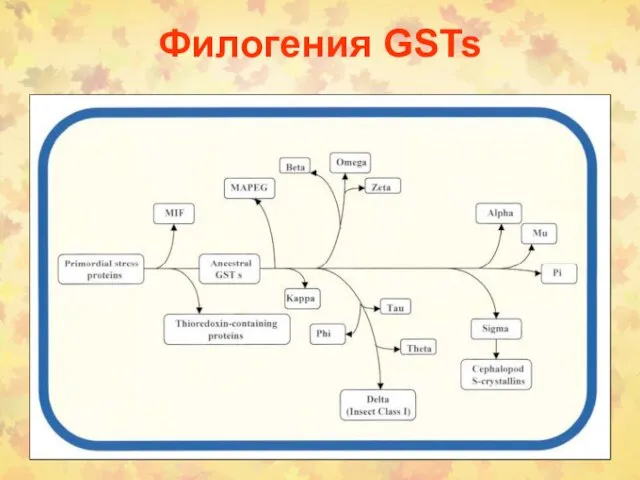
- 78. Филогения GSTs
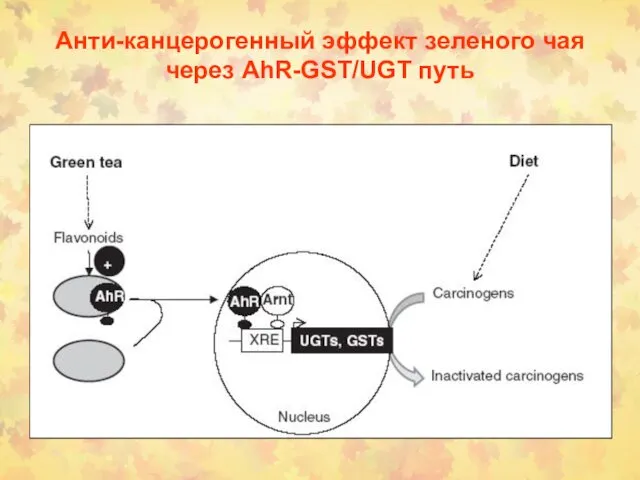
- 79. Анти-канцерогенный эффект зеленого чая через AhR-GST/UGT путь
- 80. 4. Реакции ацетилирования Ацетилирование соединений, содержащих амино-, гидроксил-сульфгидрильные группы. N-Ацетилирование – основной путь биотрансформации Ар. Аминов,
- 81. Кофактор ацетилирования
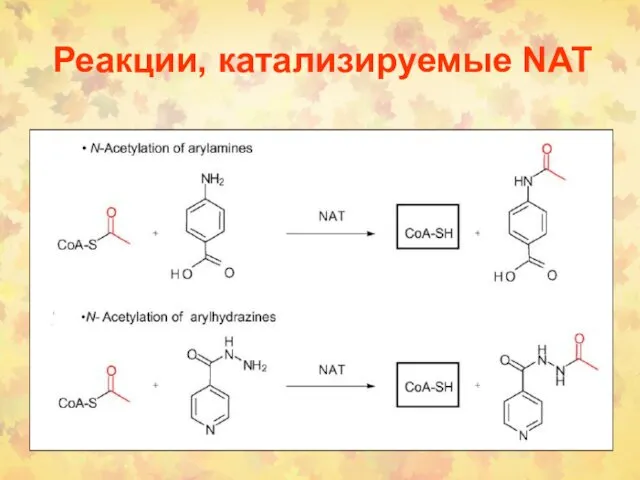
- 82. Реакции, катализируемые NAT
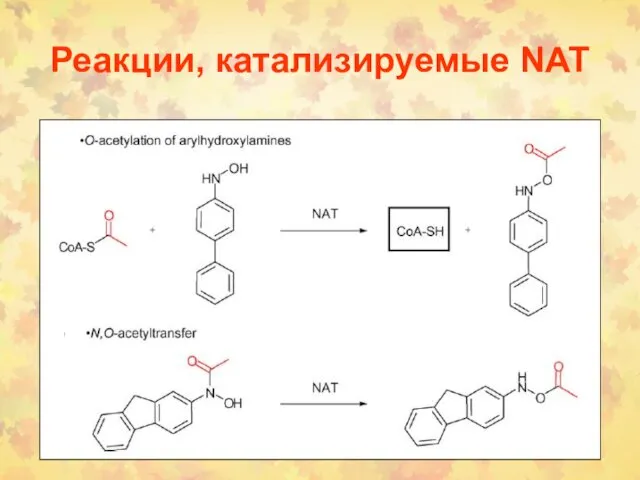
- 83. Реакции, катализируемые NAT
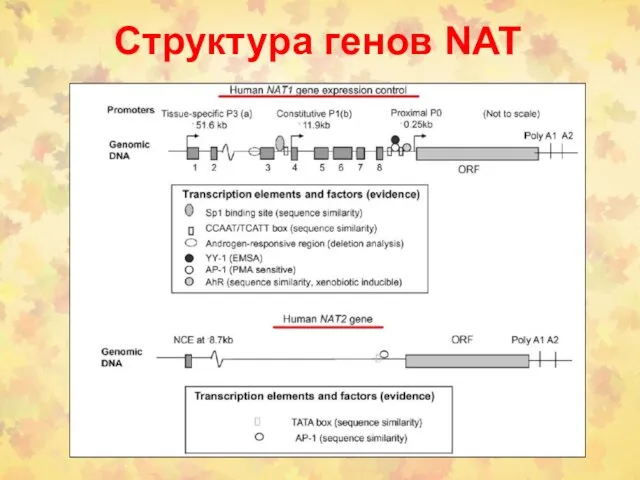
- 84. Структура генов NAT
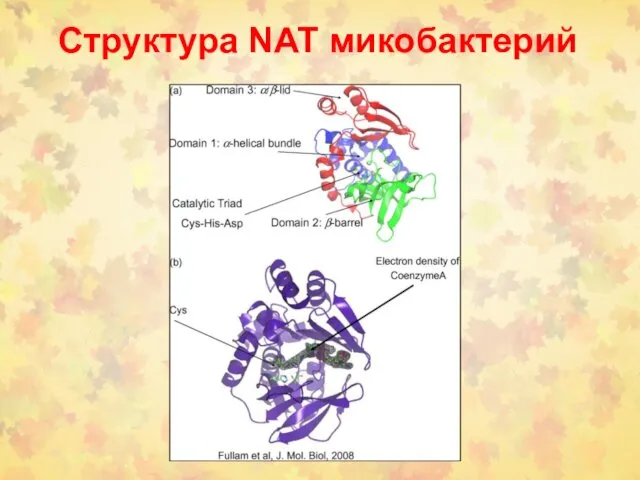
- 85. Структура NAT микобактерий
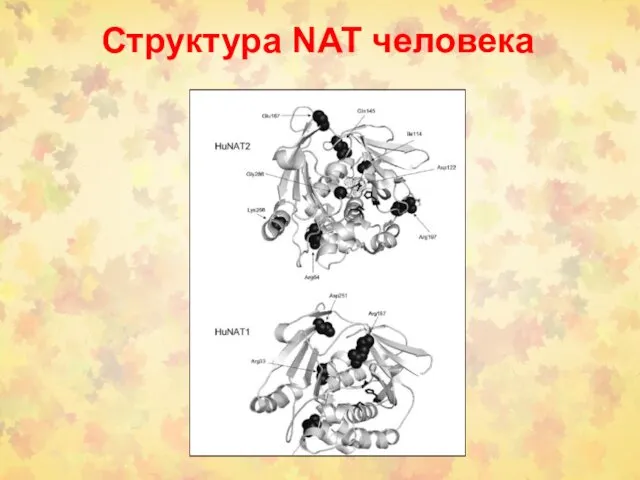
- 86. Структура NAT человека
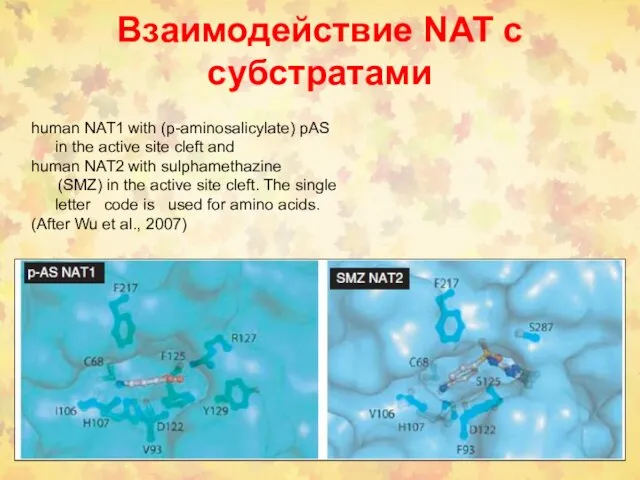
- 87. Взаимодействие NAT с субстратами human NAT1 with (p-aminosalicylate) pAS in the active site cleft and human
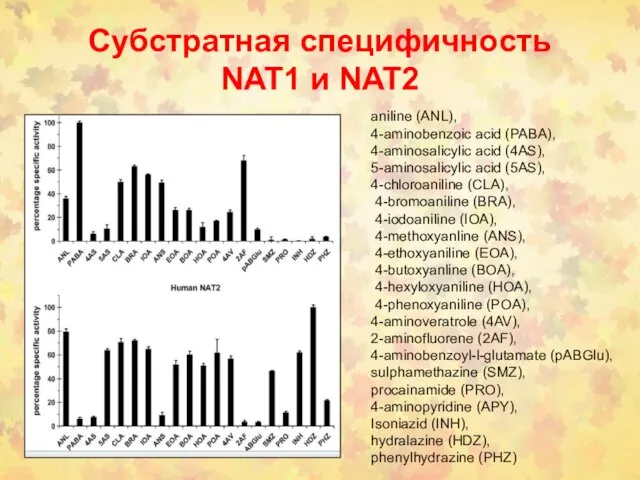
- 88. Субстратная специфичность NAT1 и NAT2 aniline (ANL), 4-aminobenzoic acid (PABA), 4-aminosalicylic acid (4AS), 5-aminosalicylic acid (5AS),
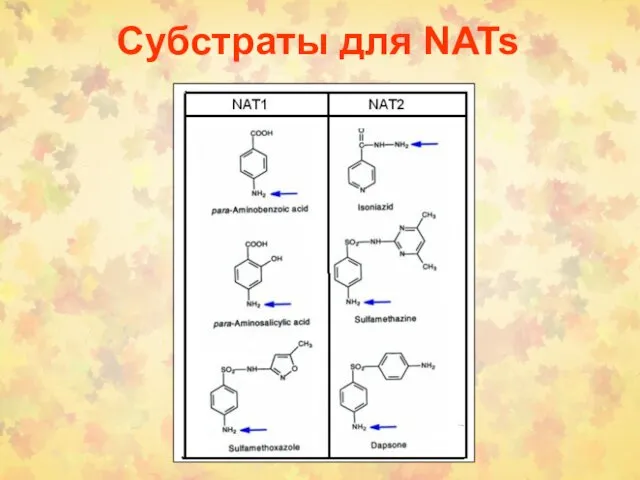
- 89. Субстраты для NATs
- 90. Ацетилирование лекарств Изониазид Сульфаметазин Гидралазин
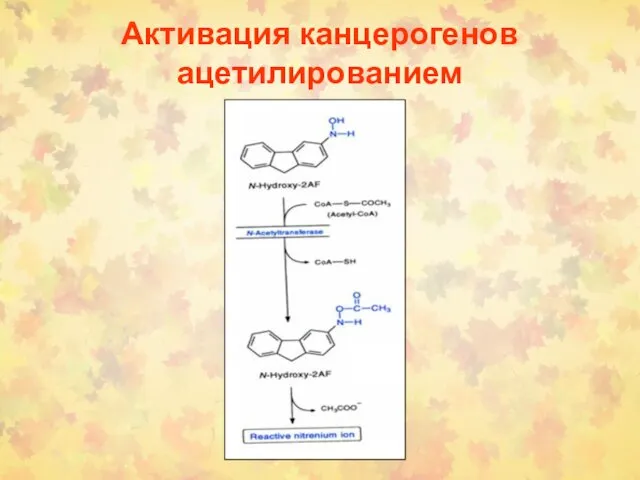
- 91. Активация канцерогенов ацетилированием
- 92. Генетический полиморфизм NAT1 и NAT2
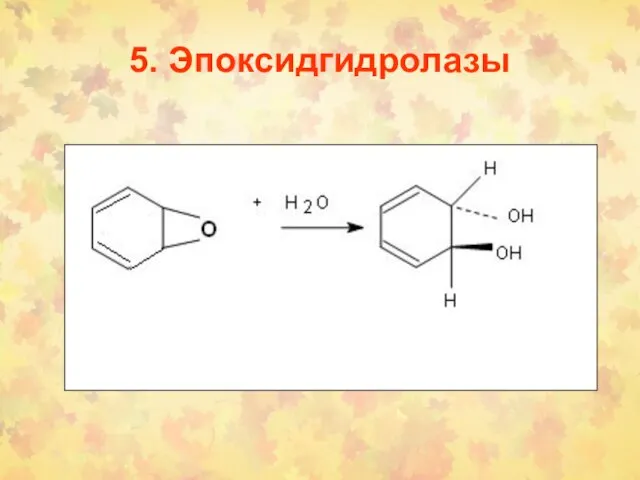
- 93. 5. Эпоксидгидролазы
- 94. Формы эпоксидгидролаз (EH) 1. Холестериновая 2. Лейкотриеновая 3.Гипоксилиновая 4. Микросомальная (Метаболизм КСБ) 5. Растворимая (Метаболизм КСБ)
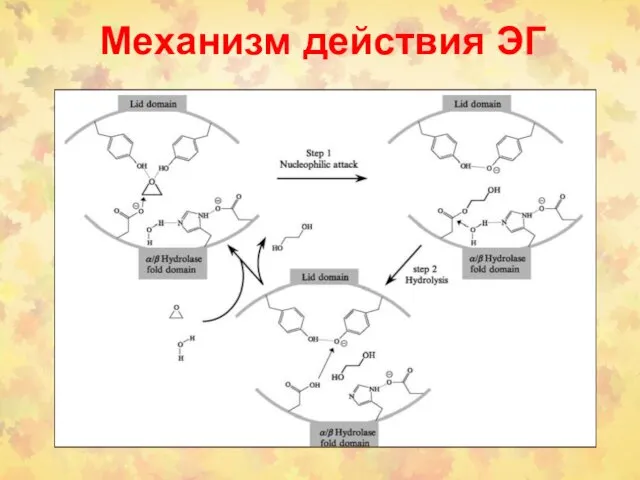
- 96. Механизм действия ЭГ
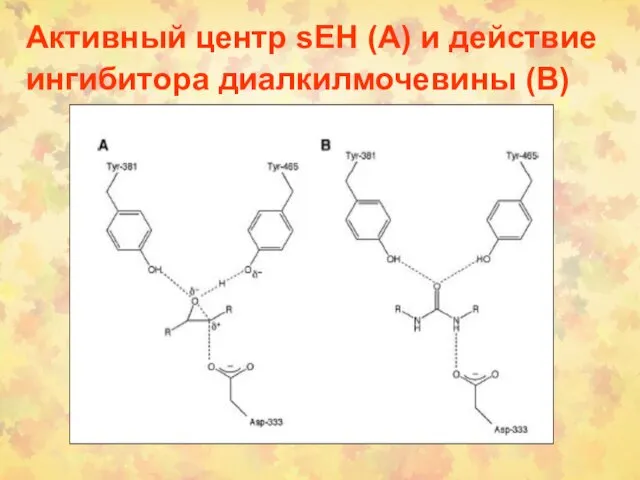
- 97. Активный центр sEH (А) и действие ингибитора диалкилмочевины (В)
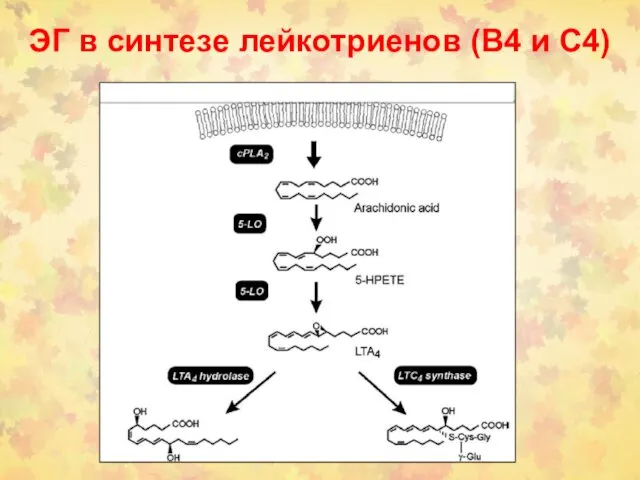
- 98. ЭГ в синтезе лейкотриенов (В4 и С4)
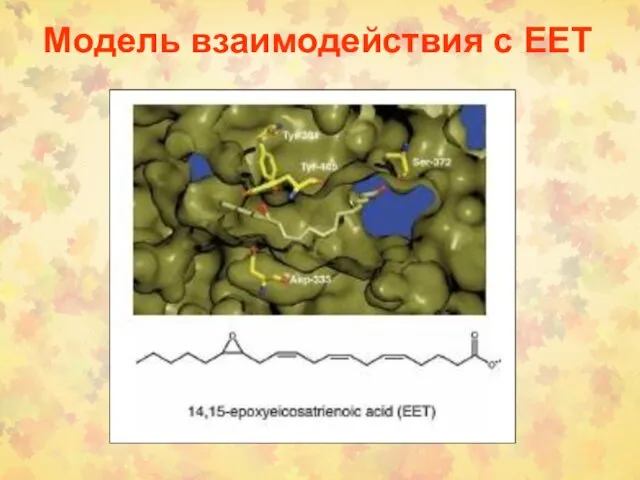
- 99. Модель взаимодействия с ЕЕТ
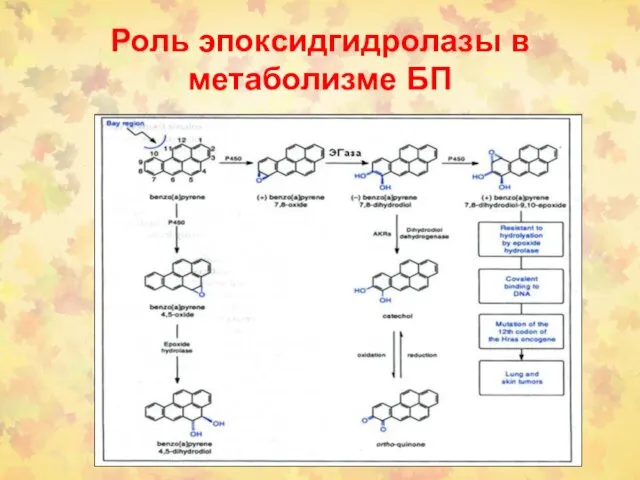
- 100. Роль эпоксидгидролазы в метаболизме БП
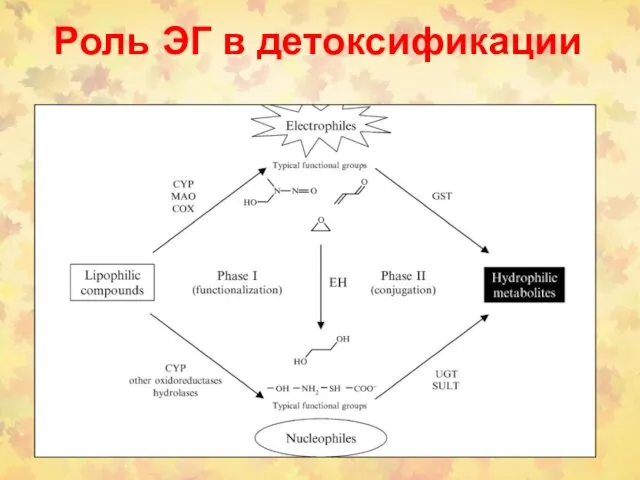
- 101. Роль ЭГ в детоксификации
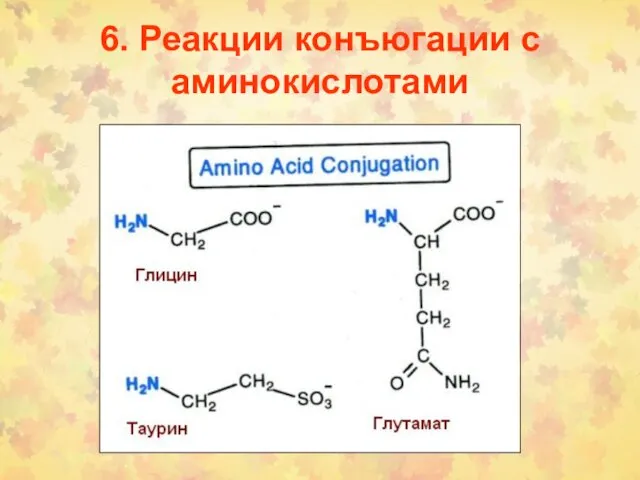
- 102. 6. Реакции конъюгации с аминокислотами
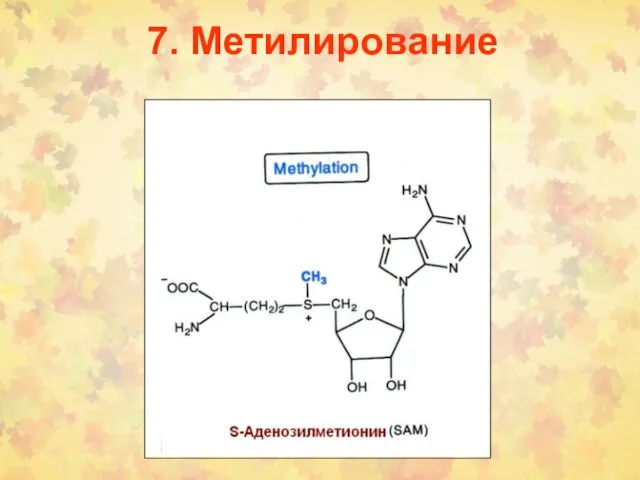
- 103. 7. Метилирование
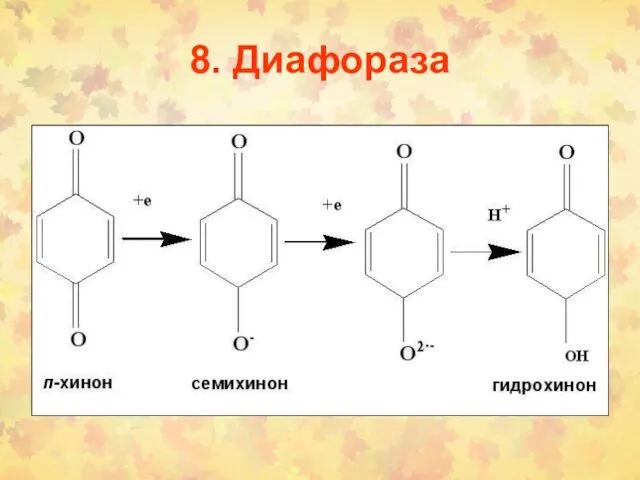
- 104. 8. Диафораза
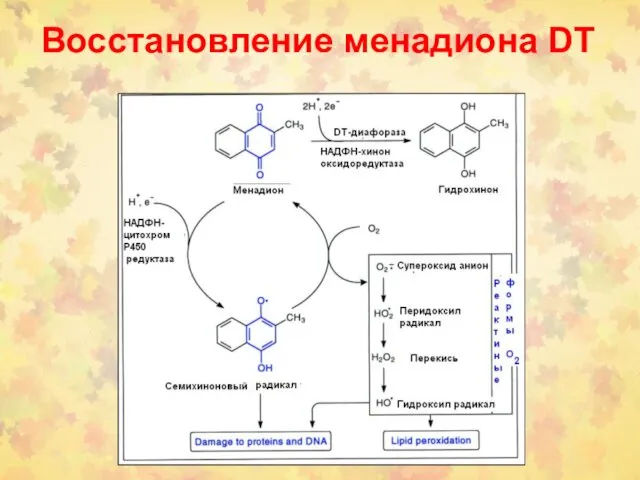
- 105. Восстановление менадиона DT
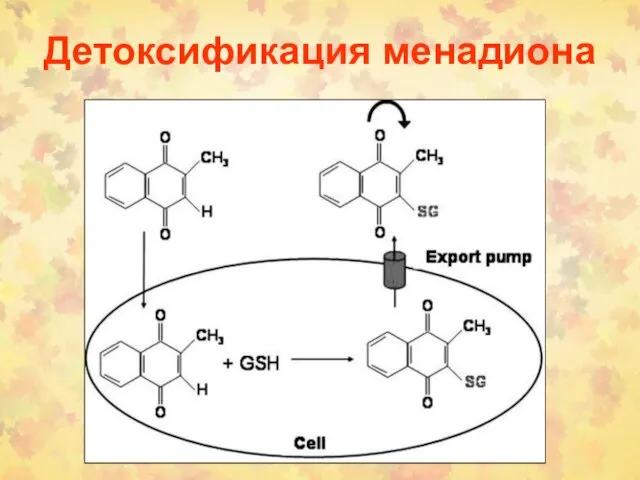
- 106. Детоксификация менадиона
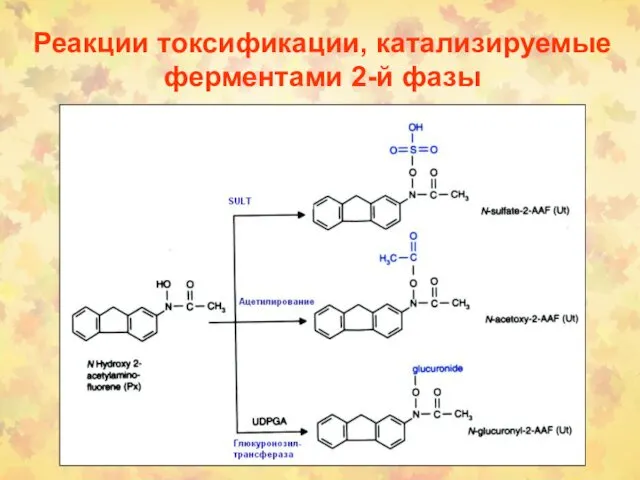
- 107. Реакции токсификации, катализируемые ферментами 2-й фазы
- 108. Полиморфные ферменты, метаболизирующие анти-раковые лекарства
- 109. Полиморфизм ферментов II фазы и рак
- 110. Полиморфизм ферментов II фазы и рак
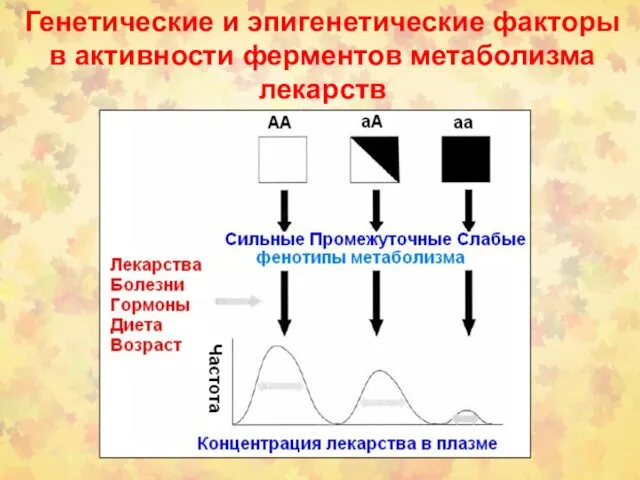
- 111. Генетические и эпигенетические факторы в активности ферментов метаболизма лекарств
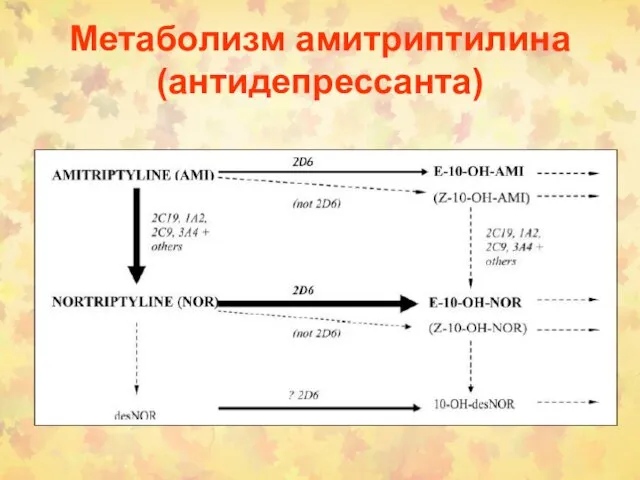
- 112. Метаболизм амитриптилина (антидепрессанта)
- 113. Фаза III. Транспортеры (1) ATP binding cassette (ABC) семейство (около 300 белков) ABCB1 (P-Glycoprotein, MDR1 или
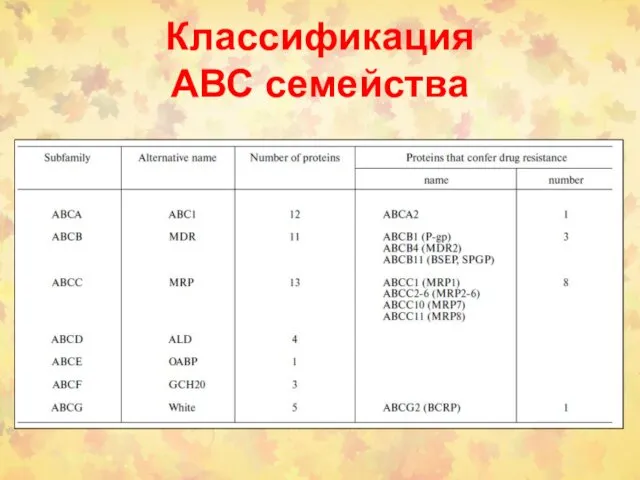
- 114. Классификация АВС семейства
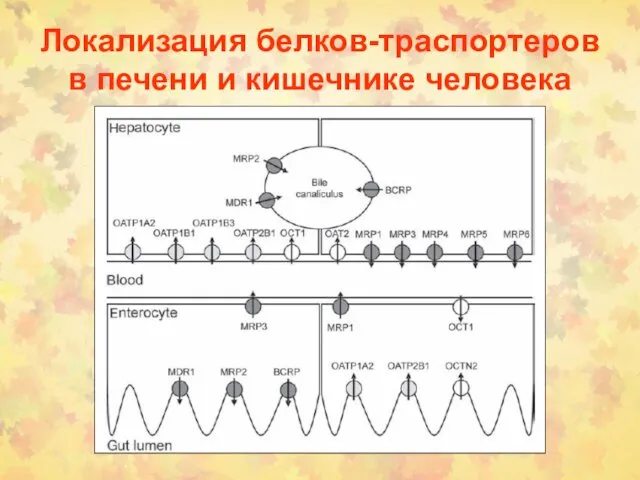
- 115. Локализация белков-траспортеров в печени и кишечнике человека
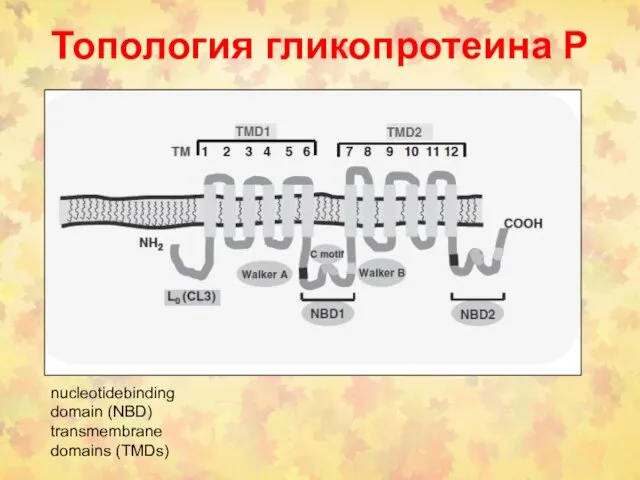
- 116. Топология гликопротеина Р nucleotidebinding domain (NBD) transmembrane domains (TMDs)
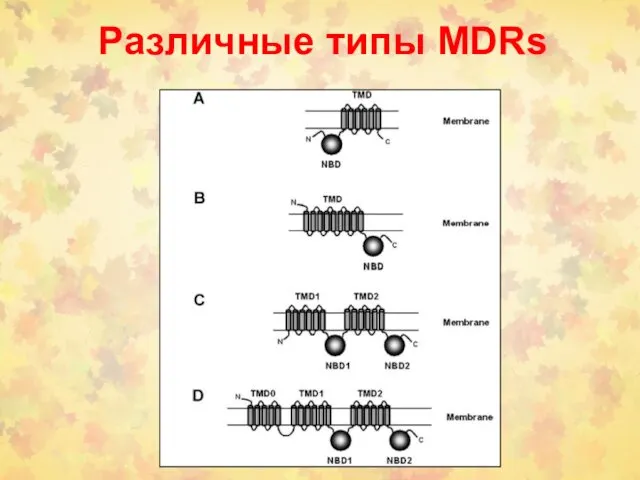
- 117. Различные типы MDRs
- 118. Антираковые лекарства и их транспортеры
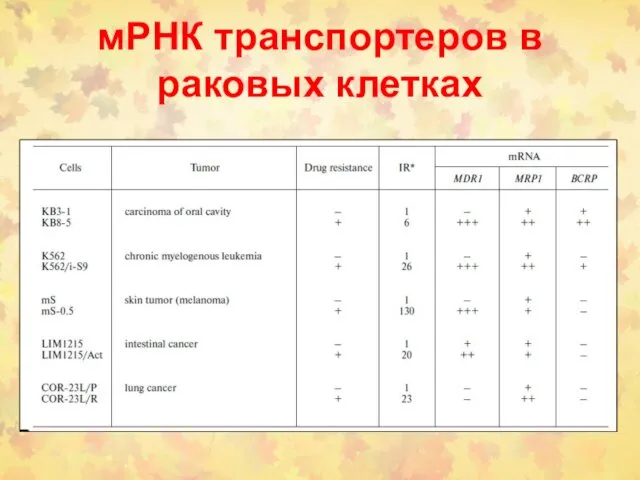
- 119. мРНК транспортеров в раковых клетках
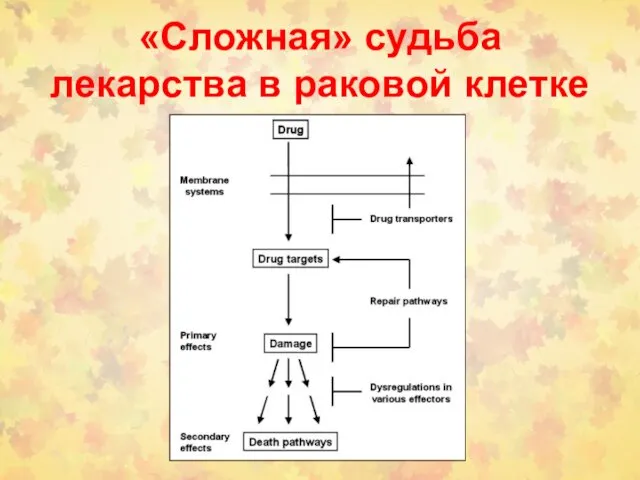
- 120. «Сложная» судьба лекарства в раковой клетке
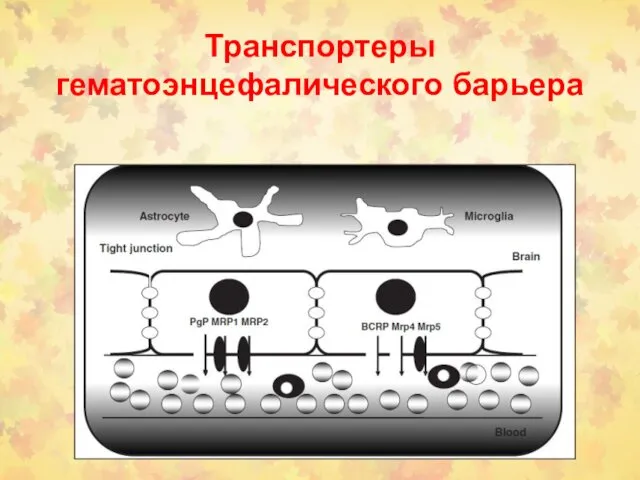
- 121. Транспортеры гематоэнцефалического барьера
- 122. Субстраты, индукторы, ингибиторы MDR1
- 124. Скачать презентацию

































 Разработка конструкции стенда для термовакуумной обработки изделий
Разработка конструкции стенда для термовакуумной обработки изделий Дифракция света. Принцип Гюйгенса-Френеля. Лекция 16(1)
Дифракция света. Принцип Гюйгенса-Френеля. Лекция 16(1) Нравственное воспитание врача
Нравственное воспитание врача Презентация для детей подготовительной группы детского сада о безопасности на дорогах Стань заметным!
Презентация для детей подготовительной группы детского сада о безопасности на дорогах Стань заметным! организация образовательного процесса
организация образовательного процесса Планирование дохода от реализации и объема продаж
Планирование дохода от реализации и объема продаж Презентация ГК Карекс
Презентация ГК Карекс Бланки документов
Бланки документов Урок в соответствии с ФГОС
Урок в соответствии с ФГОС Презентация Основные ошибки при создании презентации в программе PowerPoint
Презентация Основные ошибки при создании презентации в программе PowerPoint Жақ бет аймағын қалпына келтіру кезінде көп қабатты қиықтарды пайдалану. Микроқантамырлық хирургияның принциптері
Жақ бет аймағын қалпына келтіру кезінде көп қабатты қиықтарды пайдалану. Микроқантамырлық хирургияның принциптері Эволюция вселенной
Эволюция вселенной Основы медицинских знаний и профилактика инфекционных заболеваний
Основы медицинских знаний и профилактика инфекционных заболеваний Берілген нақты бір ғимараттың жылулық шығындарын есептеу әдістемесі
Берілген нақты бір ғимараттың жылулық шығындарын есептеу әдістемесі плетение браслетов из двух атласных лент
плетение браслетов из двух атласных лент техника для кухни
техника для кухни Презентация к родительскому собранию:Затруднение в обучении четвероклассников
Презентация к родительскому собранию:Затруднение в обучении четвероклассников Полезные ископаемые окрестностей села Кузнецкого
Полезные ископаемые окрестностей села Кузнецкого Эффективный урок
Эффективный урок Строгание. Виды рубанков
Строгание. Виды рубанков Стажировки компании МС
Стажировки компании МС Дифференцирование функции одного аргумента. Производная
Дифференцирование функции одного аргумента. Производная ррыавыв
ррыавыв 20231025_detskiy_fleshmob_s_ispolzovaniem_sovremennyh_i_russkih_narodnyh_dvizheniy_v_dou
20231025_detskiy_fleshmob_s_ispolzovaniem_sovremennyh_i_russkih_narodnyh_dvizheniy_v_dou Әлеуметтік медициналық көмектер
Әлеуметтік медициналық көмектер Добро пожаловать на сессию по уходу за кожей
Добро пожаловать на сессию по уходу за кожей Державна програма розвитку ринку інновацій в Україні
Державна програма розвитку ринку інновацій в Україні Обследование и картирование ценных участков акватории нижнего Днестра для обеспечения жизнедеятельности рыб
Обследование и картирование ценных участков акватории нижнего Днестра для обеспечения жизнедеятельности рыб