Содержание
- 2. II закон термодинамики подразделяет все процессы, не противоречащие I закону, на самопроизвольные (протекают необратимо до установления
- 3. Вечный двигатель 2-го рода не существует. Энергия Вселенной постоянна, а её энтропия возрастает. Теплота наиболее холодного
- 4. Существует экстенсивная функция состояния системы – энтропия S, которая возрастает в необратимых процессах и остается неизменной
- 7. Статистический характер II закона термодинамики Не абсолютный закон природы, применим только к макроскопическим системам. Энтропия –
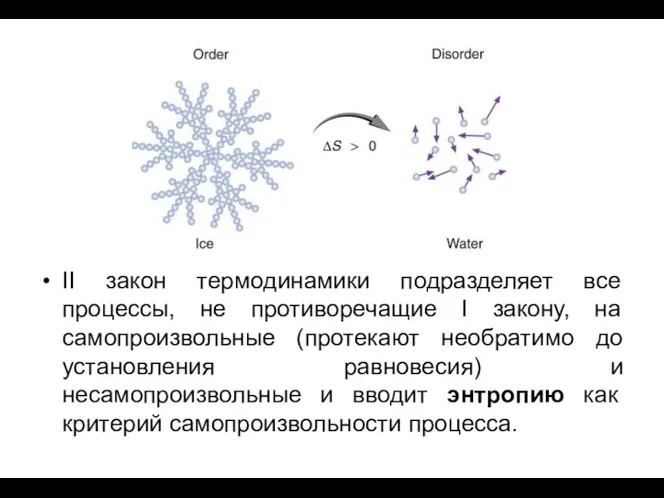
- 8. Вероятностный характер II закона термодинамики. В необратимом самопроизвольном процессе система переходит от порядка к беспорядку, из
- 9. S = KlnW W – термодинамическая вероятность (число способов, которыми можно осуществить данное состояние системы) ;
- 11. Расчет изменения энтропии в различных процессах
- 14. Постулат Планка (третий закон термодинамики) Абсолютная энтропия
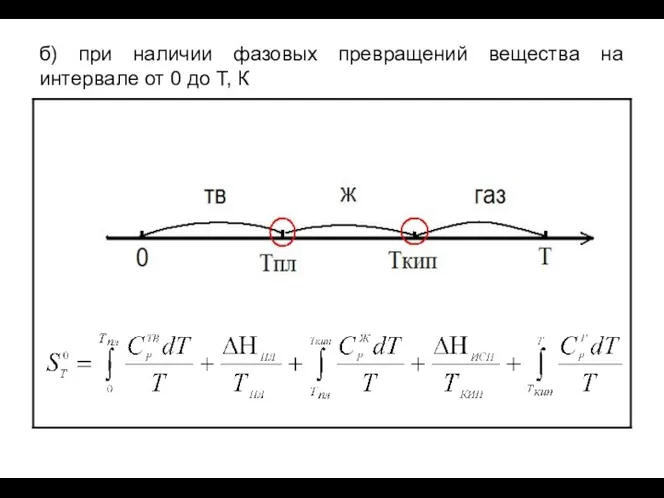
- 16. б) при наличии фазовых превращений вещества на интервале от 0 до Т, К
- 17. Следствия из постулата Планка
- 19. Скачать презентацию














 Разработка конструкции стенда для термовакуумной обработки изделий
Разработка конструкции стенда для термовакуумной обработки изделий Дифракция света. Принцип Гюйгенса-Френеля. Лекция 16(1)
Дифракция света. Принцип Гюйгенса-Френеля. Лекция 16(1) Нравственное воспитание врача
Нравственное воспитание врача Презентация для детей подготовительной группы детского сада о безопасности на дорогах Стань заметным!
Презентация для детей подготовительной группы детского сада о безопасности на дорогах Стань заметным! организация образовательного процесса
организация образовательного процесса Планирование дохода от реализации и объема продаж
Планирование дохода от реализации и объема продаж Презентация ГК Карекс
Презентация ГК Карекс Бланки документов
Бланки документов Урок в соответствии с ФГОС
Урок в соответствии с ФГОС Презентация Основные ошибки при создании презентации в программе PowerPoint
Презентация Основные ошибки при создании презентации в программе PowerPoint Жақ бет аймағын қалпына келтіру кезінде көп қабатты қиықтарды пайдалану. Микроқантамырлық хирургияның принциптері
Жақ бет аймағын қалпына келтіру кезінде көп қабатты қиықтарды пайдалану. Микроқантамырлық хирургияның принциптері Эволюция вселенной
Эволюция вселенной Основы медицинских знаний и профилактика инфекционных заболеваний
Основы медицинских знаний и профилактика инфекционных заболеваний Берілген нақты бір ғимараттың жылулық шығындарын есептеу әдістемесі
Берілген нақты бір ғимараттың жылулық шығындарын есептеу әдістемесі плетение браслетов из двух атласных лент
плетение браслетов из двух атласных лент техника для кухни
техника для кухни Презентация к родительскому собранию:Затруднение в обучении четвероклассников
Презентация к родительскому собранию:Затруднение в обучении четвероклассников Полезные ископаемые окрестностей села Кузнецкого
Полезные ископаемые окрестностей села Кузнецкого Эффективный урок
Эффективный урок Строгание. Виды рубанков
Строгание. Виды рубанков Стажировки компании МС
Стажировки компании МС Дифференцирование функции одного аргумента. Производная
Дифференцирование функции одного аргумента. Производная ррыавыв
ррыавыв 20231025_detskiy_fleshmob_s_ispolzovaniem_sovremennyh_i_russkih_narodnyh_dvizheniy_v_dou
20231025_detskiy_fleshmob_s_ispolzovaniem_sovremennyh_i_russkih_narodnyh_dvizheniy_v_dou Әлеуметтік медициналық көмектер
Әлеуметтік медициналық көмектер Добро пожаловать на сессию по уходу за кожей
Добро пожаловать на сессию по уходу за кожей Державна програма розвитку ринку інновацій в Україні
Державна програма розвитку ринку інновацій в Україні Обследование и картирование ценных участков акватории нижнего Днестра для обеспечения жизнедеятельности рыб
Обследование и картирование ценных участков акватории нижнего Днестра для обеспечения жизнедеятельности рыб