Содержание
- 2. Матричные синтезы Синтез сложных полимерных биоорганических соединений, координируемый другим полимерным соединением – матрицей. Это такие процессы
- 3. Информация Информация – управляющие взаимодействия Источник управляющего сигнала обычно расходует гораздо меньше энергии, чем расходует система-приемник
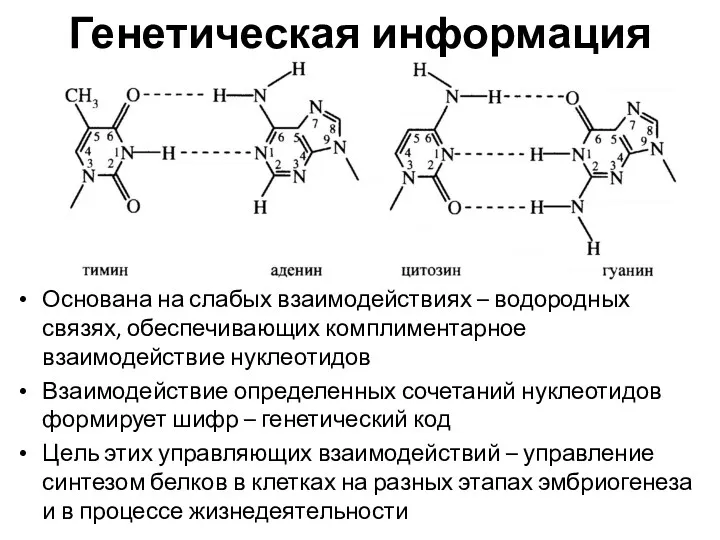
- 4. Генетическая информация Основана на слабых взаимодействиях – водородных связях, обеспечивающих комплиментарное взаимодействие нуклеотидов Взаимодействие определенных сочетаний
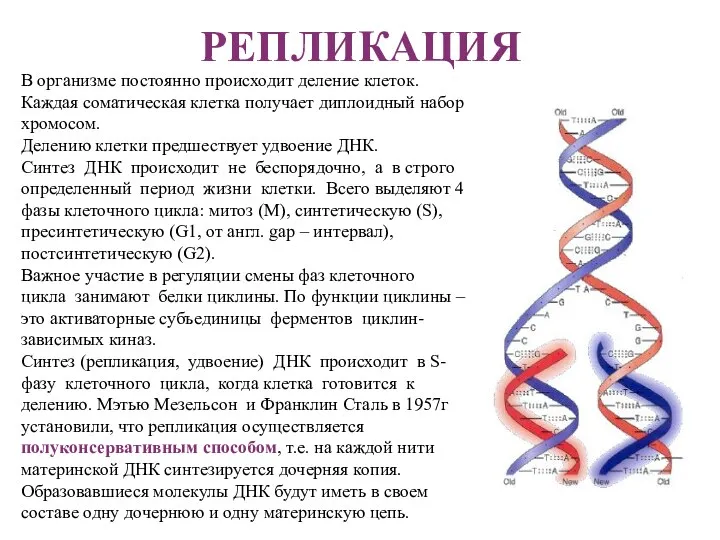
- 5. РЕПЛИКАЦИЯ В организме постоянно происходит деление клеток. Каждая соматическая клетка получает диплоидный набор хромосом. Делению клетки
- 6. РЕПЛИКАЦИЯ Фазы репликации: Инициация Элонгация Терминация Репликация требует наличия нескольких компонентов: Матрица – в ее роли
- 7. ИНИЦИАЦИЯ Запускается факторами роста. 1) В определенных участках, получивших название точка ori (англ. origin – начало,
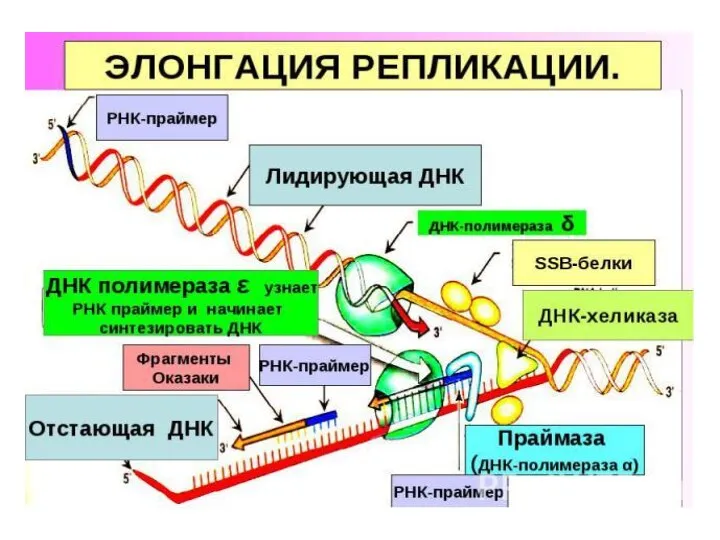
- 8. ЭЛОНГАЦИЯ Включает в себя процесс образования новых цепей. Синтез идет в направлении 5‘-3‘. Осуществляется под действием
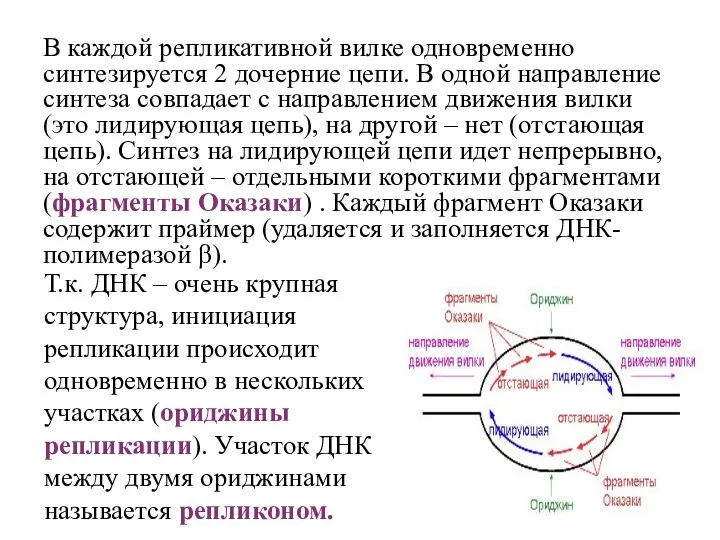
- 10. В каждой репликативной вилке одновременно синтезируется 2 дочерние цепи. В одной направление синтеза совпадает с направлением
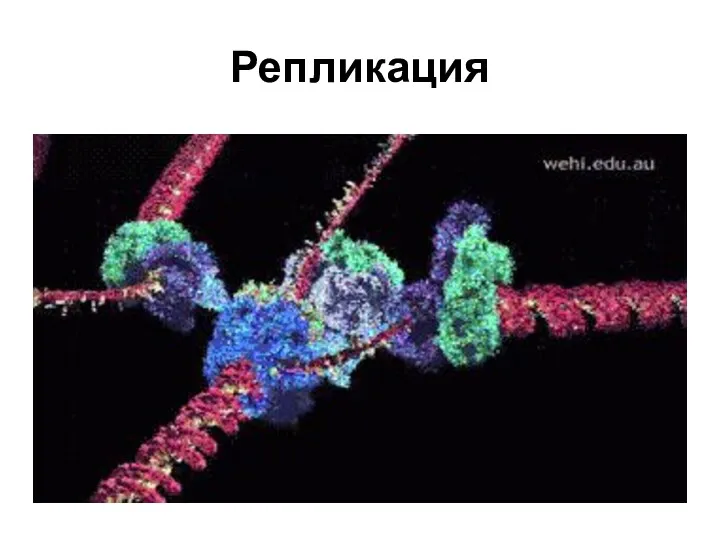
- 11. Репликация
- 12. ТРАНСКРИПЦИЯ это процесс синтеза РНК на матрице ДНК Принципы: Матричность Комплементарность Антипараллельность Условия: ДНК-матрица Нуклеотиды (ATP,
- 13. ТРАНСКРИПЦИЯ Синтез РНК начинается в определенных участках ДНК (промоторах) и заканчивается в терминальных участках (сайтах терминации).
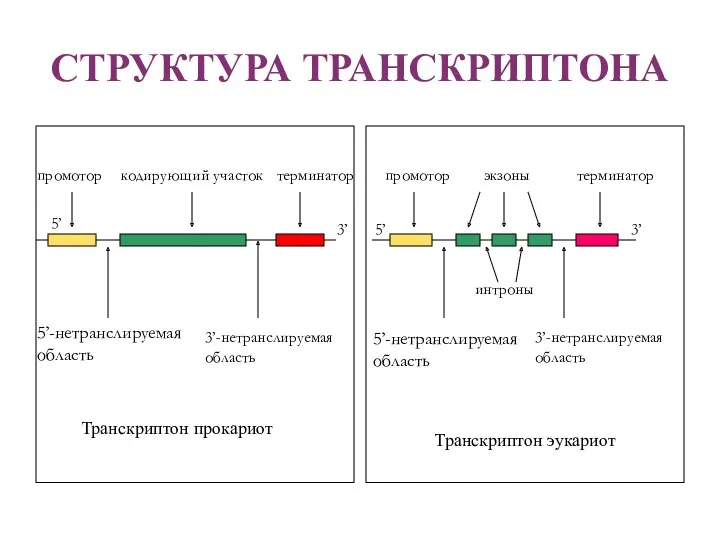
- 14. СТРУКТУРА ТРАНСКРИПТОНА 5’ 3’ промотор 5’-нетранслируемая область 3’-нетранслируемая область кодирующий участок терминатор Транскриптон прокариот 5’-нетранслируемая область
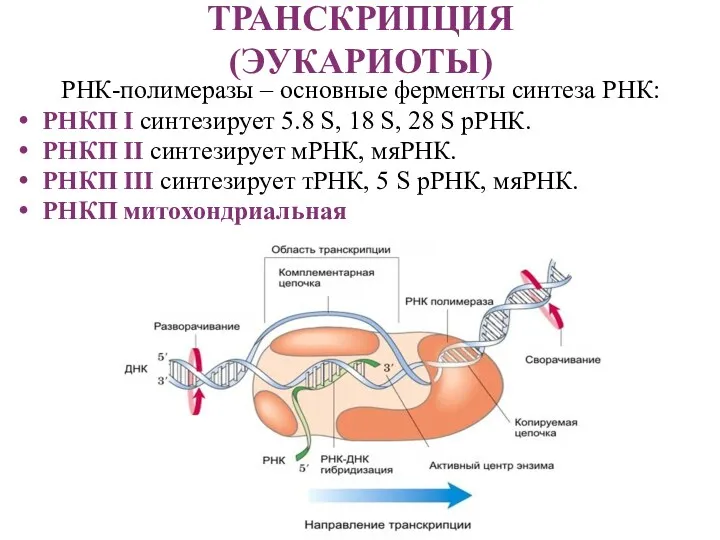
- 15. ТРАНСКРИПЦИЯ (ЭУКАРИОТЫ) РНК-полимеразы – основные ферменты синтеза РНК: РНКП I синтезирует 5.8 S, 18 S, 28
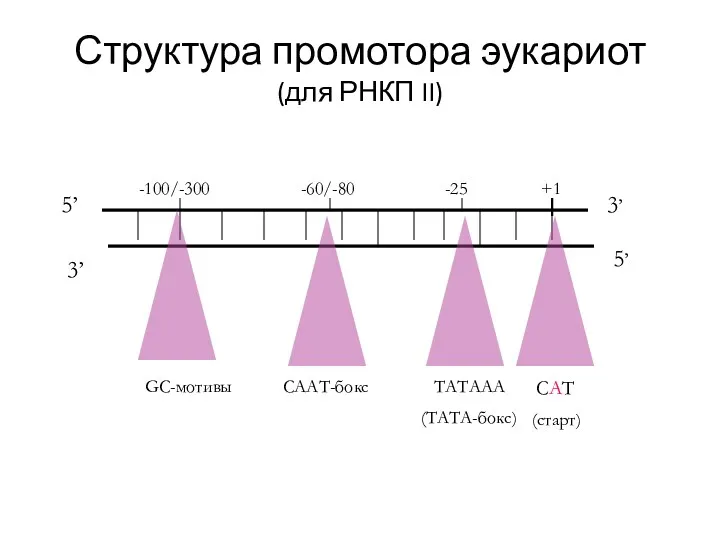
- 16. Структура промотора эукариот (для РНКП II) 5’ 3’ 5’ 3’ +1 -25 -60/-80 -100/-300 CAT (старт)
- 17. ТРАНСКРИПЦИЯ Начинается с активатора промотра белком ТАТА-фактором. Он присоединяется к специфической последовательности в промоторе ТАТА-боксу. После
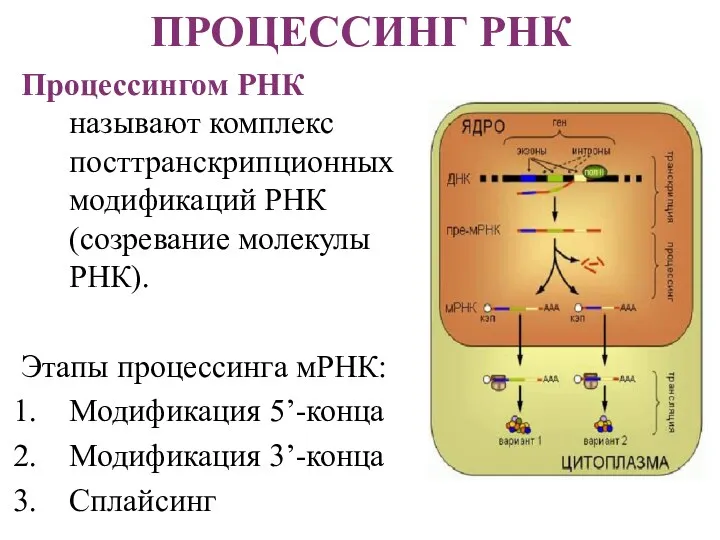
- 18. ПРОЦЕССИНГ РНК Процессингом РНК называют комплекс посттранскрипционных модификаций РНК (созревание молекулы РНК). Этапы процессинга мРНК: Модификация
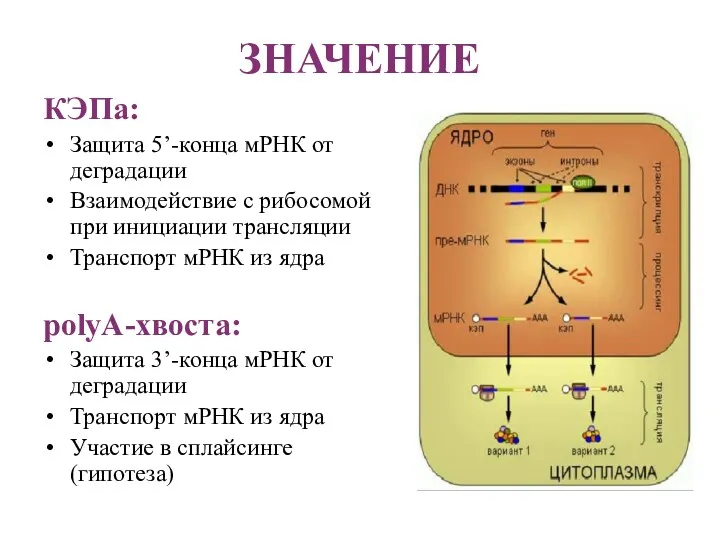
- 19. ЗНАЧЕНИЕ КЭПа: Защита 5’-конца мРНК от деградации Взаимодействие с рибосомой при инициации трансляции Транспорт мРНК из
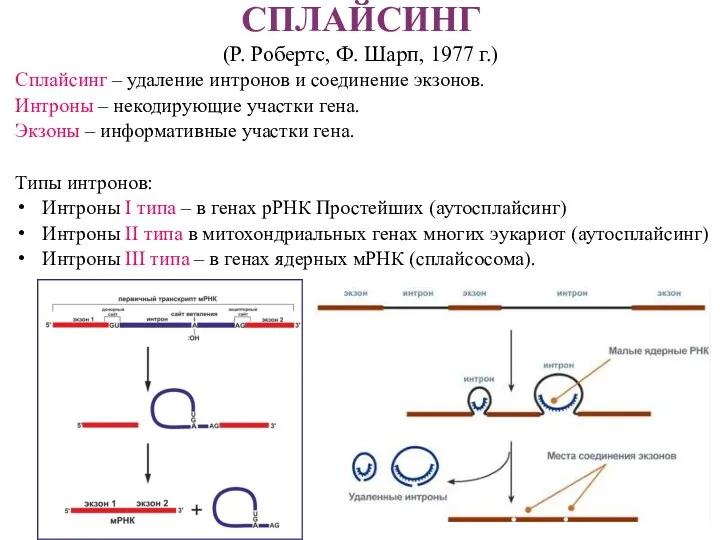
- 20. СПЛАЙСИНГ (Р. Робертс, Ф. Шарп, 1977 г.) Сплайсинг – удаление интронов и соединение экзонов. Интроны –
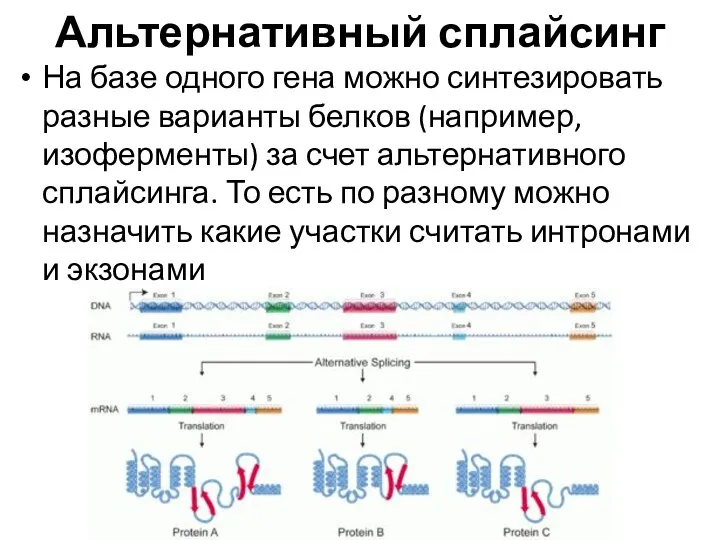
- 21. Альтернативный сплайсинг На базе одного гена можно синтезировать разные варианты белков (например, изоферменты) за счет альтернативного
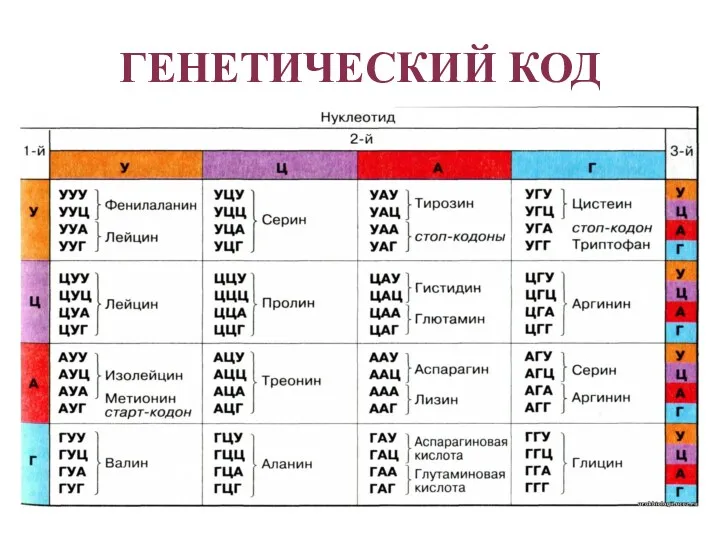
- 22. ГЕНЕТИЧЕСКИЙ КОД Ген – участок молекулы ДНК , который кодирует последовательность аминокислот белка (структурные гены) либо
- 23. ГЕНЕТИЧЕСКИЙ КОД
- 24. СВОЙСТВА ГЕНЕТИЧЕСКОГО КОДА Триплетность – три нуклеотида формируют кодон, кодирующий аминокислоту. Всего насчитывают 61 смысловой кодон
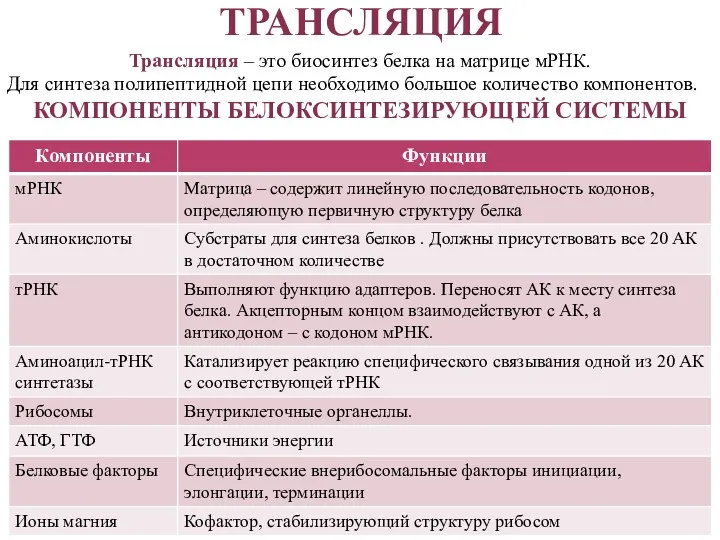
- 25. ТРАНСЛЯЦИЯ Трансляция – это биосинтез белка на матрице мРНК. Для синтеза полипептидной цепи необходимо большое количество
- 26. После переноса информации с ДНК на матричную РНК начинается синтез белков. Каждая зрелая мРНК несет информацию
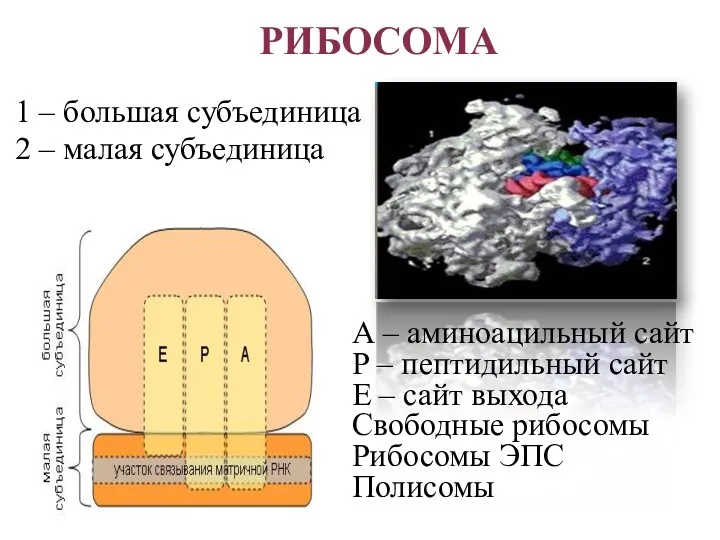
- 27. РИБОСОМА 1 – большая субъединица 2 – малая субъединица А – аминоацильный сайт Р – пептидильный
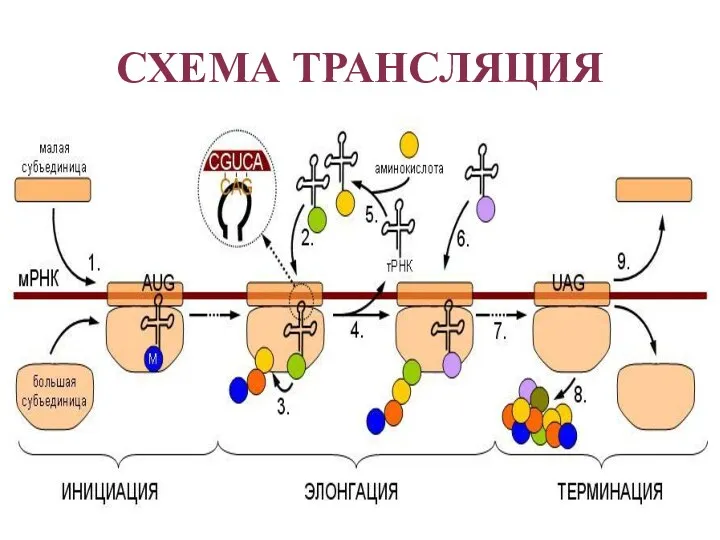
- 28. Выделяют три основных стадии трансляции: Инициация Элонгация Терминация Синтезу белка предшествует процесс активации аминокислот. Процесс осуществляется
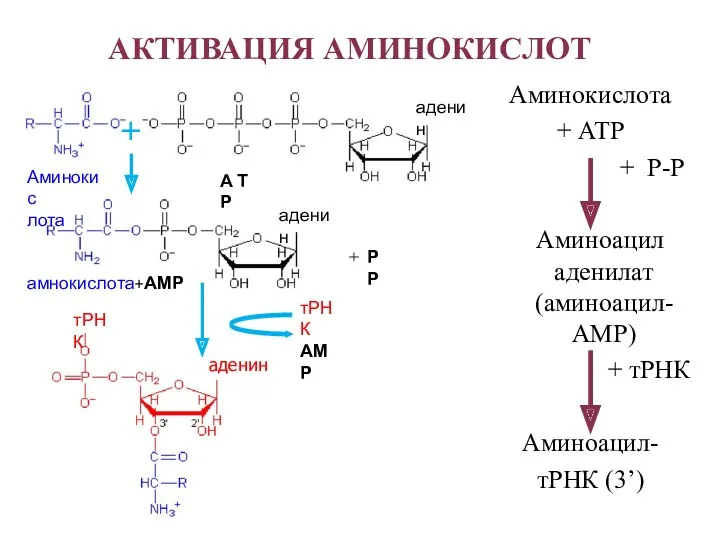
- 29. АКТИВАЦИЯ АМИНОКИСЛОТ Аминокис лота А Т Р аденин аденин амнокислота+АМР РР тРНК аденин + тРНК АМР
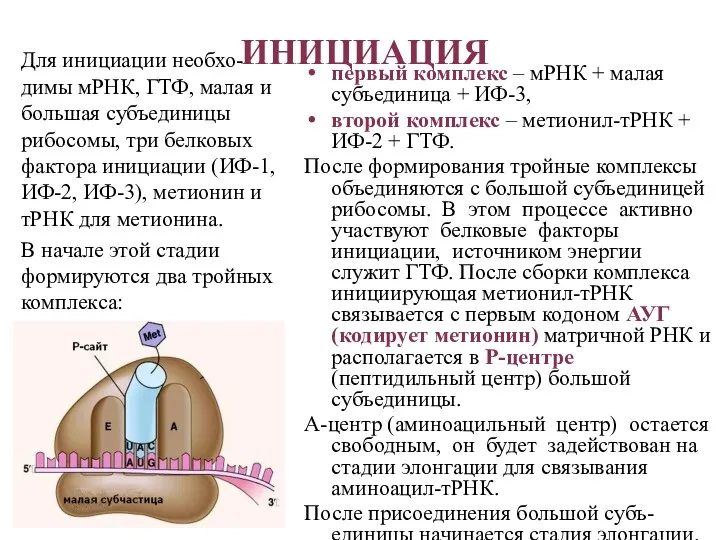
- 30. ИНИЦИАЦИЯ первый комплекс – мРНК + малая субъединица + ИФ-3, второй комплекс – метионил-тРНК + ИФ-2
- 31. ЭЛОНГАЦИЯ Для этой стадии необходимы все 20 аминокислот, тРНК для всех аминокислот, белковые факторы элонгации, ГТФ.
- 32. Затем следует повторение цикла. Оно начинается с присоединения третьей аминоацил-тРНК к третьему кодону мРНК, аминокислота-3 становится
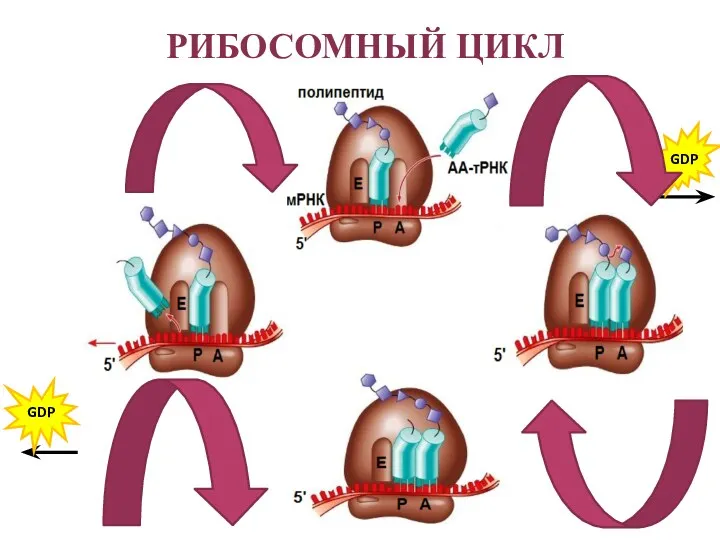
- 33. РИБОСОМНЫЙ ЦИКЛ GDP GDP
- 34. СХЕМА ТРАНСЛЯЦИЯ
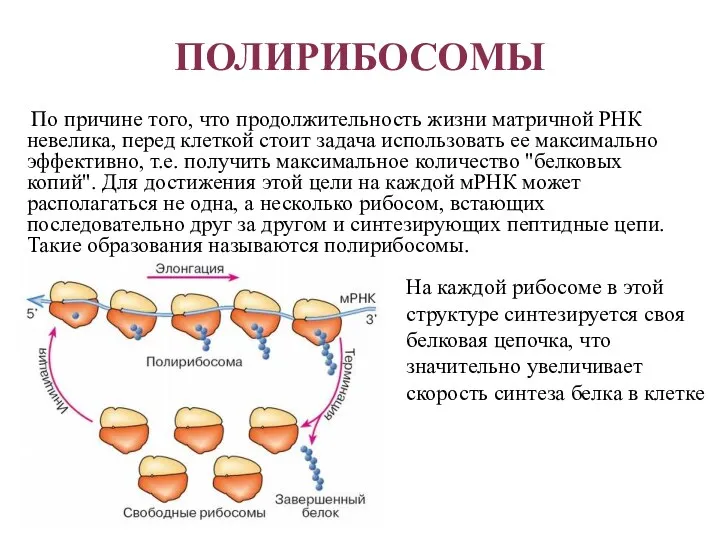
- 35. ПОЛИРИБОСОМЫ По причине того, что продолжительность жизни матричной РНК невелика, перед клеткой стоит задача использовать ее
- 36. ПОСТТРАНСЛЯЦИОННАЯ МОДИФИКАЦИЯ БЕЛКОВ В результате трансляции полипептидные цепи образуются в неактивной форме, поэтому необходимы дополнительные изменения
- 37. метильной группы – например, метилирование аргинина и лизина в составе гистонов используется для регуляции активности генома
- 38. РЕГУЛЯЦИЯ ТРАНСКРИПЦИИ Так как транскрипция связывает ядро клетки и белки, клетки, то от качества и активности
- 39. СТРУКТУРА ОПЕРОНА В структуре оперона выделяют определенные участки: Конституитивные ферменты – те, которые присутствуют в клетках
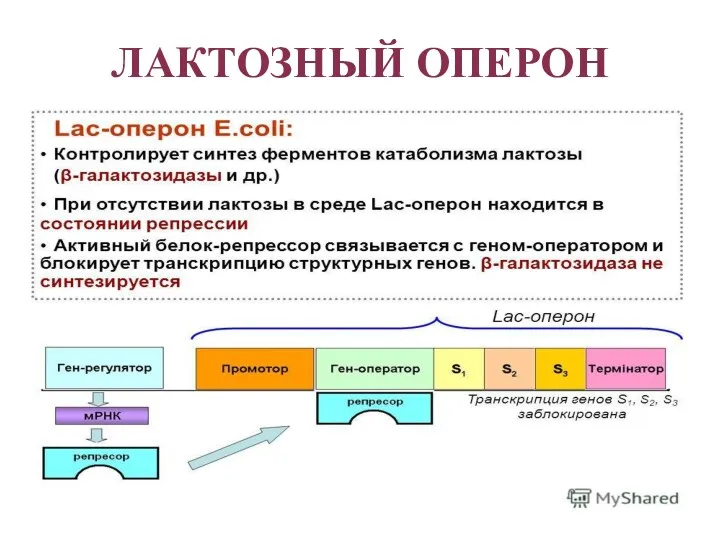
- 40. ЛАКТОЗНЫЙ ОПЕРОН Лактозный оперон в целом отвечает за катаболизм лактозы. При изучении E.coli было замечено, что
- 41. ЛАКТОЗНЫЙ ОПЕРОН
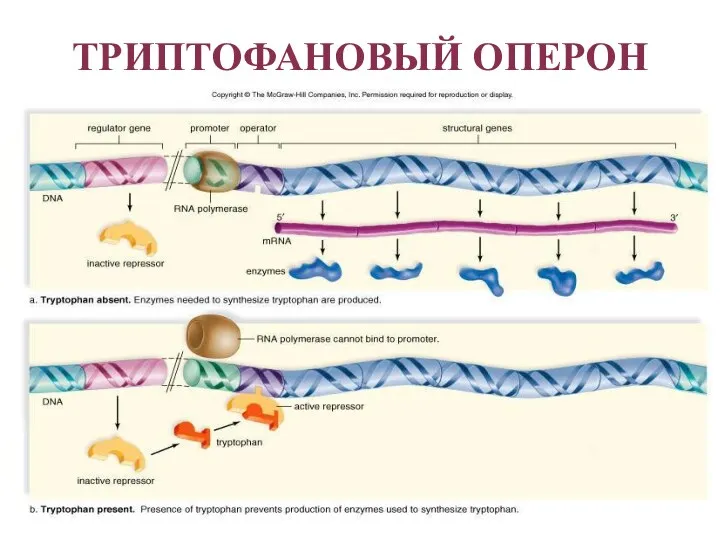
- 42. ТРИПТОФАНОВЫЙ ОПЕРОН Триптофановый оперон в целом отвечает за синтез триптофана. Функционирование триптофанового оперона в некотором смысле
- 43. ТРИПТОФАНОВЫЙ ОПЕРОН
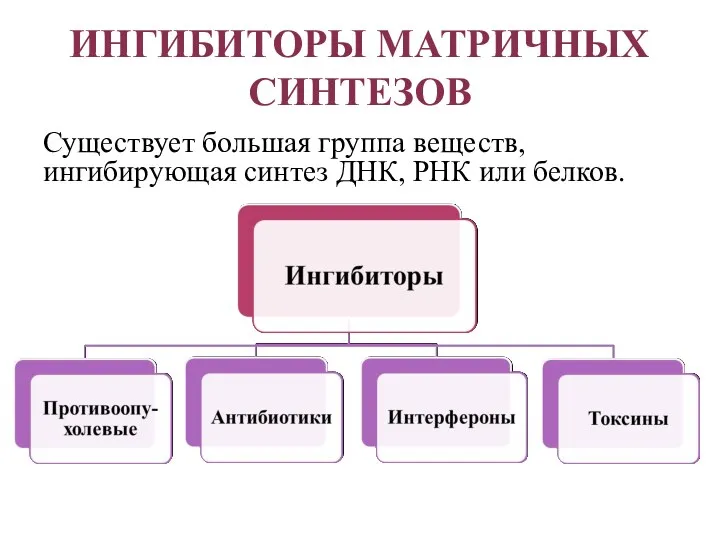
- 44. ИНГИБИТОРЫ МАТРИЧНЫХ СИНТЕЗОВ Существует большая группа веществ, ингибирующая синтез ДНК, РНК или белков.
- 45. ИНГИБИТОРЫ РЕПЛИКАЦИИ Ингибиторы репликации и транскрипции используются в качестве противоопухолевых препаратов.
- 46. ИНГИБИТОРЫ ТРАНСКРИПЦИИ К ним относятся лекарственные вещества, обладающие противобактериальным действием. В эту группу входит антибиотик рифампицин.
- 47. ИНГИБИТОРЫ ТРАНСЛЯЦИИ Эта группа лекарственных веществ широко применяется в качестве антибактериальных средств.
- 48. ИНГИБИТОРЫ МАТРИЧНЫХ СИНТЕЗОВ Действие интерферонов на матричные синтезы заключается в инактивации факторов инициации трансляции. Интерферон активирует
- 50. Скачать презентацию
























 Удобрения, их свойства и применение
Удобрения, их свойства и применение Понятие Сбалансированное питание
Понятие Сбалансированное питание Фізіологія занього, середнього та проміжного мозку
Фізіологія занього, середнього та проміжного мозку Соединительные ткани
Соединительные ткани Сон и сновидения
Сон и сновидения Russian desman
Russian desman Изменчивость: наследственная и ненаследственная
Изменчивость: наследственная и ненаследственная Пентозо-фосфатный путь окисления глюкозы
Пентозо-фосфатный путь окисления глюкозы Кровеносная система. Внутренняя среда организма. Кровь
Кровеносная система. Внутренняя среда организма. Кровь Презентация по биологии Своя игра (обобщение по всему курсу) 8 класс
Презентация по биологии Своя игра (обобщение по всему курсу) 8 класс Микробиология зерновых продуктов
Микробиология зерновых продуктов Строение и работа сердца
Строение и работа сердца Итоговая контрольная работа. 6 класс
Итоговая контрольная работа. 6 класс Цели физического воспитания
Цели физического воспитания Способы культивирования вирусов
Способы культивирования вирусов Термодинамика биологических процессов(new)
Термодинамика биологических процессов(new) Химический состав клетки. Нуклеиновые кислоты. ДНК
Химический состав клетки. Нуклеиновые кислоты. ДНК Мутационная изменчивость
Мутационная изменчивость Гормоны поджелудочной железы
Гормоны поджелудочной железы Отряд Перепончатокрылые
Отряд Перепончатокрылые Урок на тему :Совместная жизнь видов в биогеоценозе.
Урок на тему :Совместная жизнь видов в биогеоценозе. Неорганические вещества клетки
Неорганические вещества клетки Презентация по теме Кайнозойская эра, 11 класс
Презентация по теме Кайнозойская эра, 11 класс Водоросли и их классификация
Водоросли и их классификация Строение и функции кожи
Строение и функции кожи Генетика. Наследственность. Изменчивость
Генетика. Наследственность. Изменчивость Энзимология. Структура и механизм действия ферментов. (Лекция 2)
Энзимология. Структура и механизм действия ферментов. (Лекция 2) Подготовка к ЕГЭ по биологии. 10 класс
Подготовка к ЕГЭ по биологии. 10 класс