Содержание
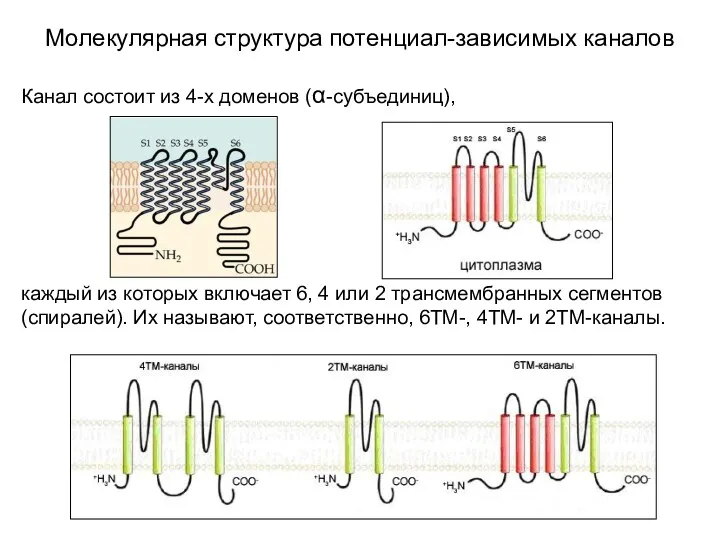
- 2. Молекулярная структура потенциал-зависимых каналов Канал состоит из 4-х доменов (α-субъединиц), каждый из которых включает 6, 4
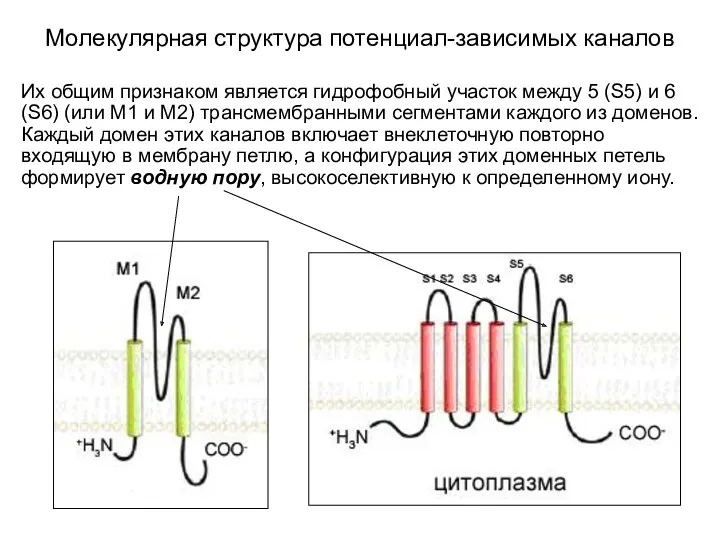
- 3. Молекулярная структура потенциал-зависимых каналов Их общим признаком является гидрофобный участок между 5 (S5) и 6 (S6)
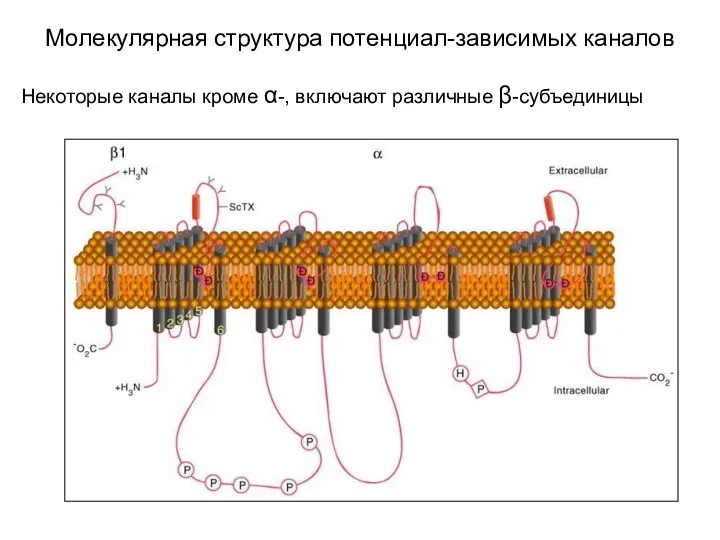
- 4. Молекулярная структура потенциал-зависимых каналов Некоторые каналы кроме α-, включают различные β-субъединицы
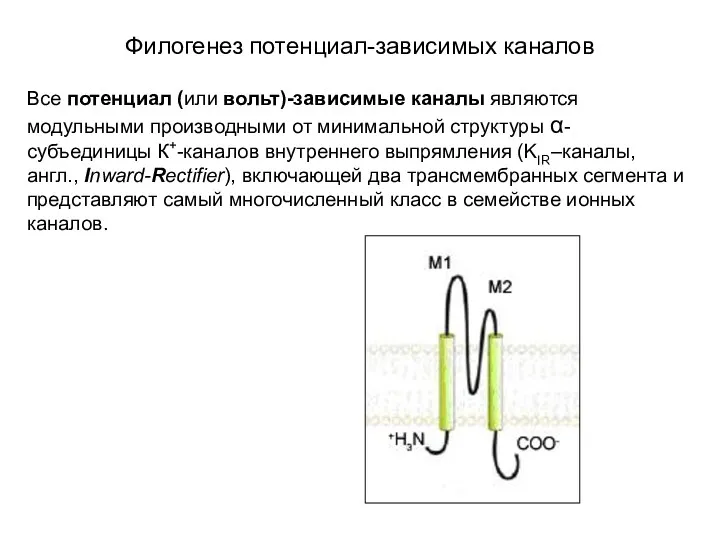
- 5. Филогенез потенциал-зависимых каналов Все потенциал (или вольт)-зависимые каналы являются модульными производными от минимальной структуры α-субъединицы К+-каналов
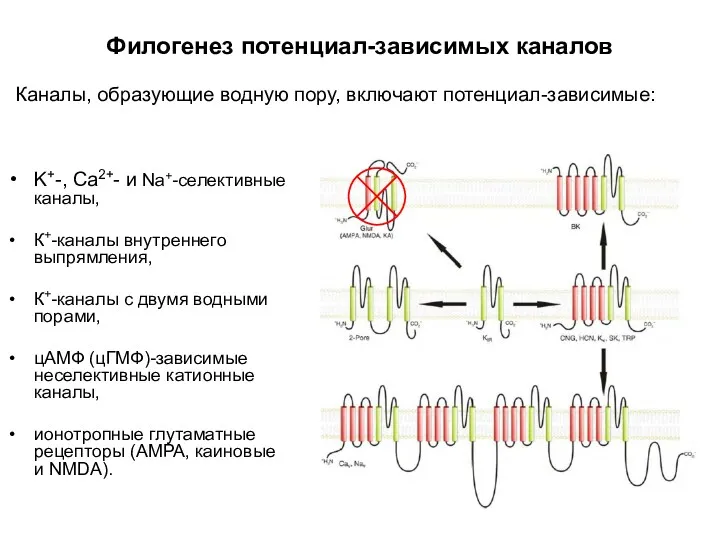
- 6. Филогенез потенциал-зависимых каналов Каналы, образующие водную пору, включают потенциал-зависимые: K+-, Ca2+- и Na+-селективные каналы К+-каналы внутреннего
- 7. Филогенез потенциал-зависимых каналов Каналы, образующие водную пору, включают потенциал-зависимые: K+-, Ca2+- и Na+-селективные каналы, К+-каналы внутреннего
- 8. Филогенез потенциал-зависимых каналов
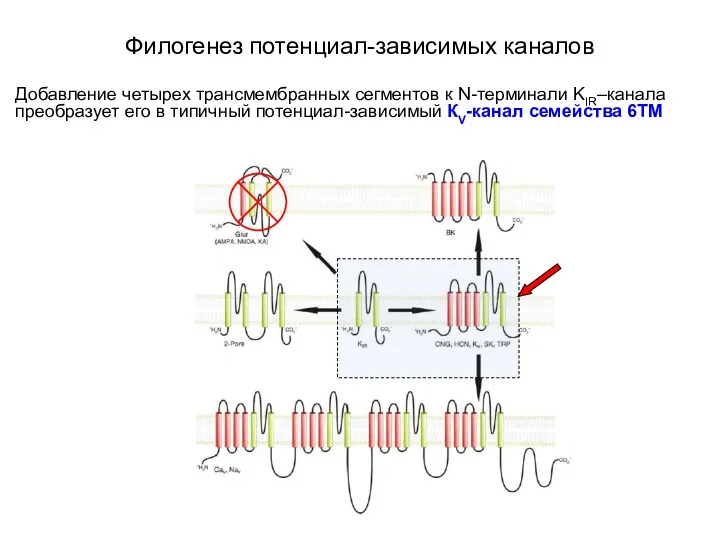
- 9. Филогенез потенциал-зависимых каналов Добавление четырех трансмембранных сегментов к N-терминали KIR–канала преобразует его в типичный потенциал-зависимый КV-канал
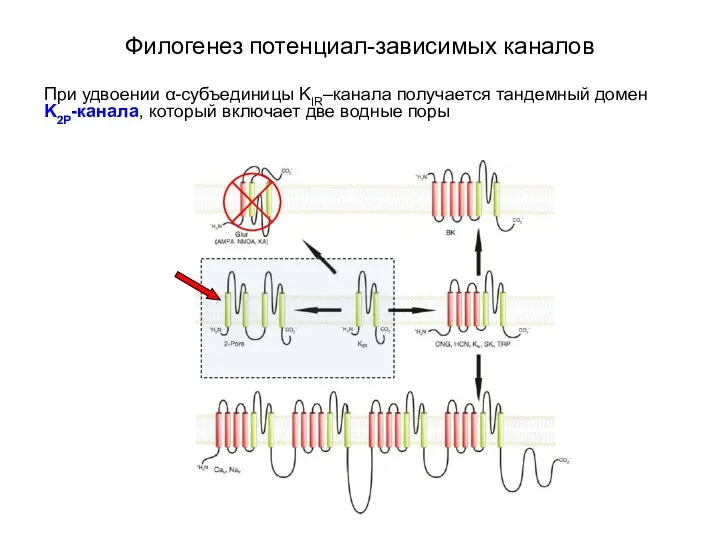
- 10. Филогенез потенциал-зависимых каналов При удвоении α-субъединицы KIR–канала получается тандемный домен K2P-канала, который включает две водные поры
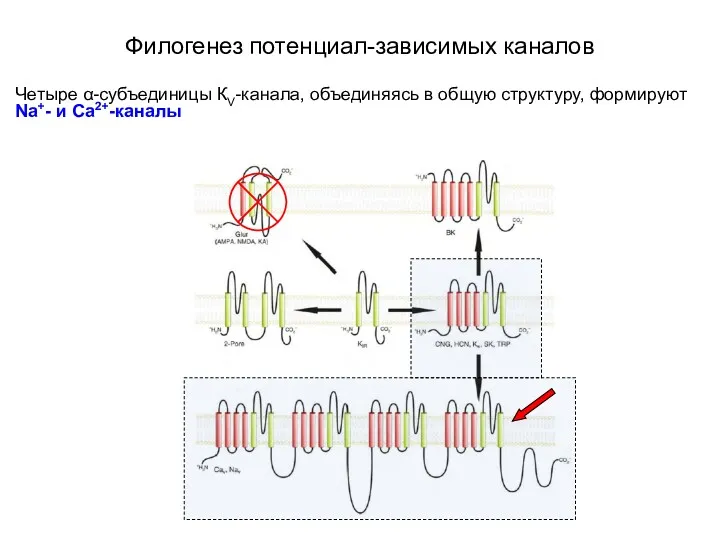
- 11. Филогенез потенциал-зависимых каналов Четыре α-субъединицы КV-канала, объединяясь в общую структуру, формируют Na+- и Ca2+-каналы
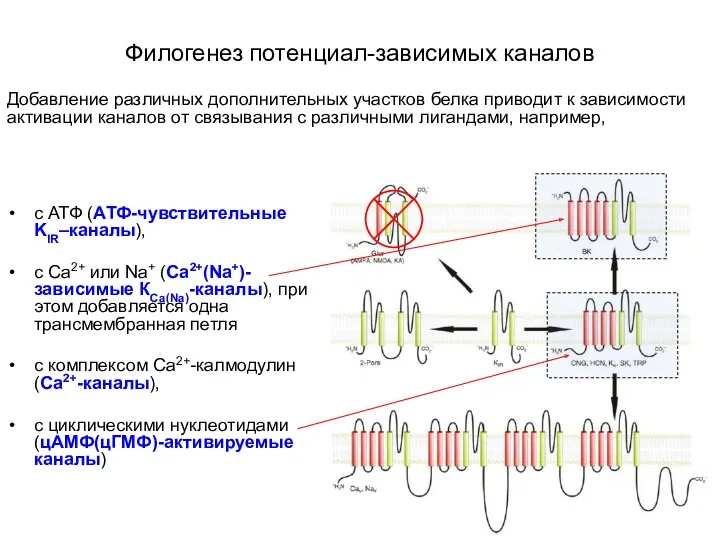
- 12. Филогенез потенциал-зависимых каналов Добавление различных дополнительных участков белка приводит к зависимости активации каналов от связывания с
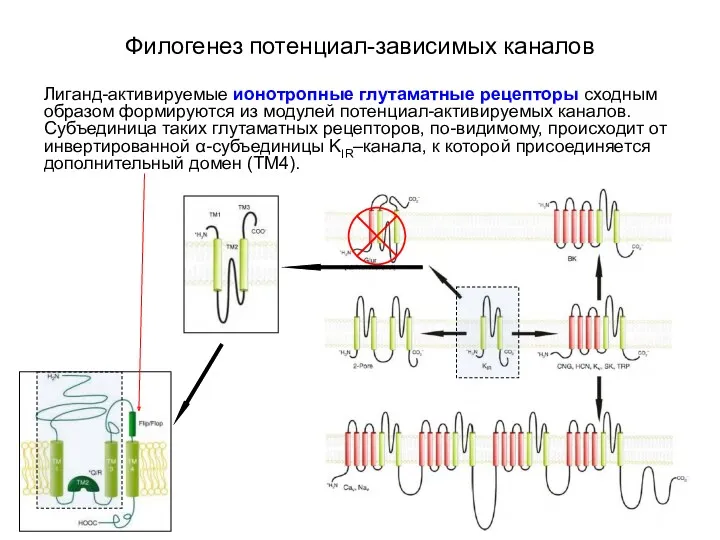
- 13. Филогенез потенциал-зависимых каналов Лиганд-активируемые ионотропные глутаматные рецепторы сходным образом формируются из модулей потенциал-активируемых каналов. Субъединица таких
- 14. К+-каналы С 1980-х г.г. идентифицировано более 80 генов, кодирующих различные вариации α-субъединиц определенных К+-каналов. Каждый К+-канал
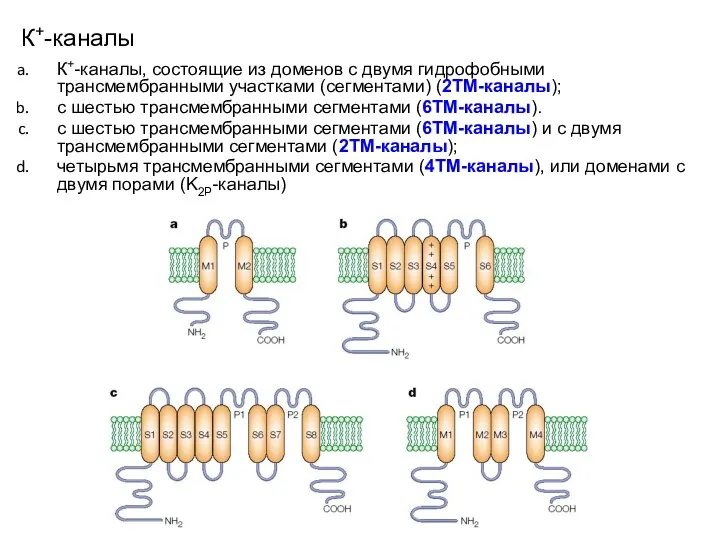
- 15. К+-каналы К+-каналы, состоящие из доменов c двумя гидрофобными трансмембранными участками (сегментами) (2ТМ-каналы); с шестью трансмембранными сегментами
- 16. К+-каналы C шестью трансмембранными сегментами (6ТМ-каналы) и c двумя трансмембранными сегментами (2ТМ-каналы); 8TM/2P channels, which are
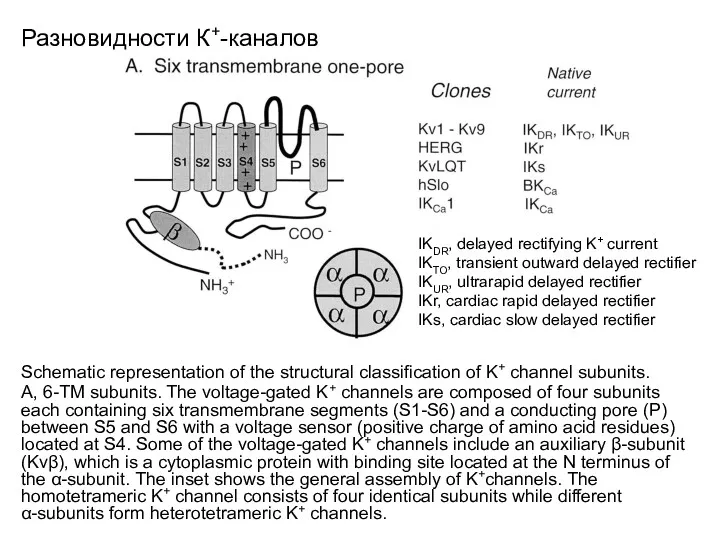
- 17. Разновидности К+-каналов Schematic representation of the structural classification of K+ channel subunits. A, 6-TM subunits. The
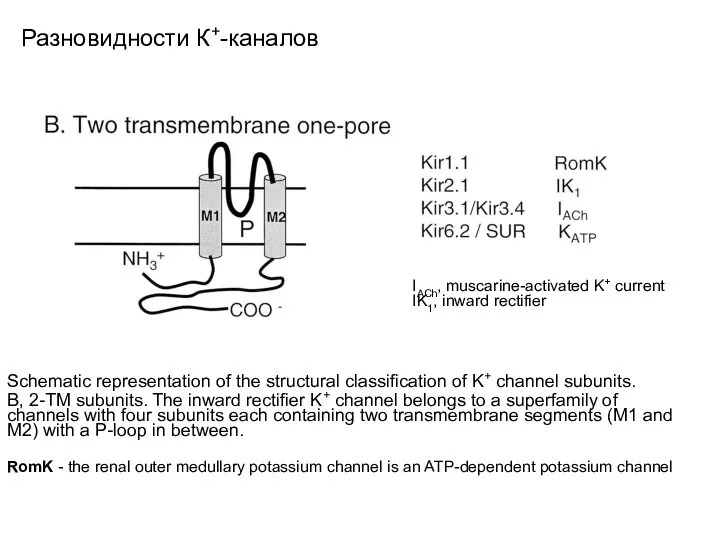
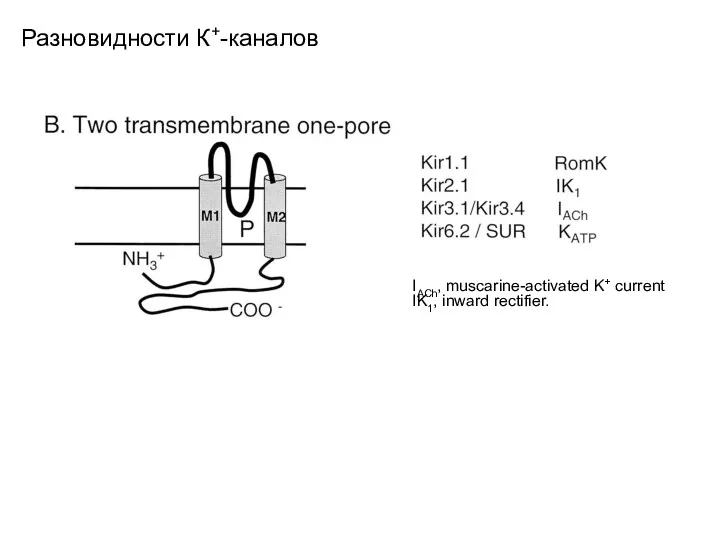
- 18. Разновидности К+-каналов Schematic representation of the structural classification of K+ channel subunits. B, 2-TM subunits. The
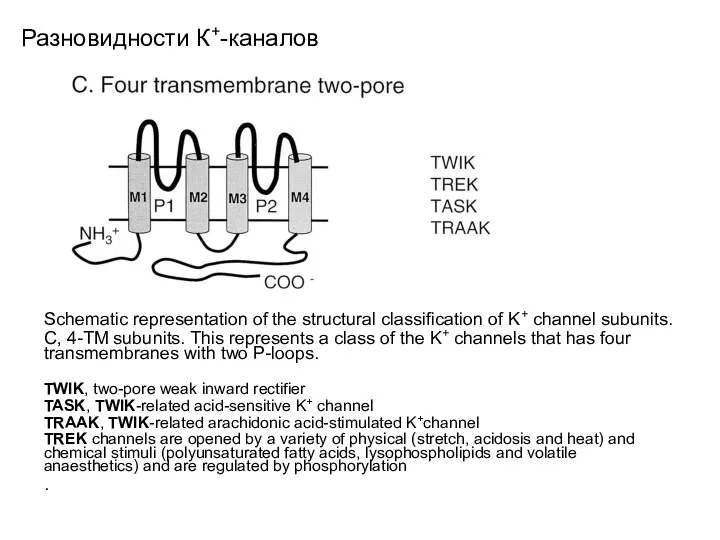
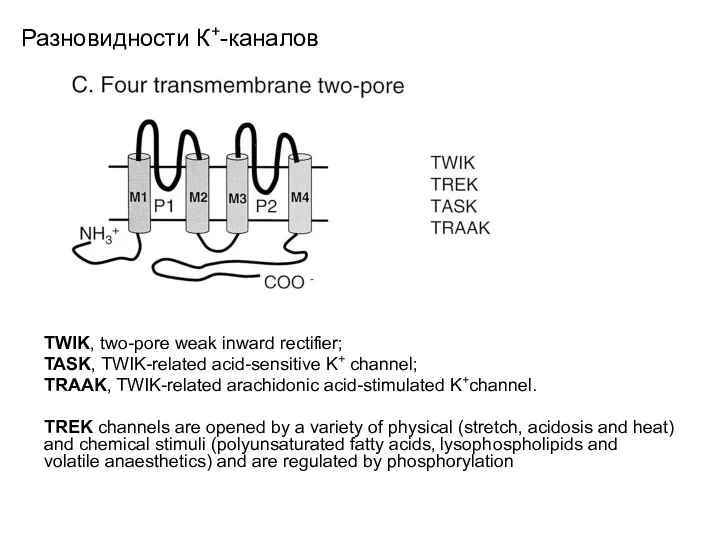
- 19. Разновидности К+-каналов Schematic representation of the structural classification of K+ channel subunits. C, 4-TM subunits. This
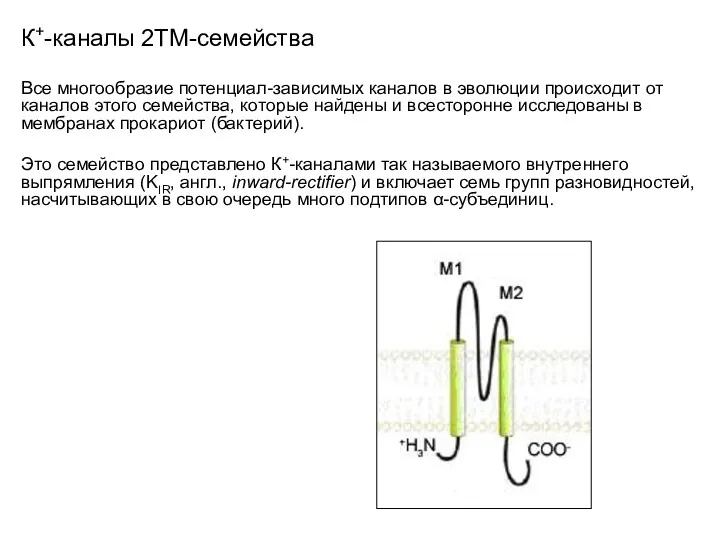
- 20. К+-каналы 2ТМ-семейства Все многообразие потенциал-зависимых каналов в эволюции происходит от каналов этого семейства, которые найдены и
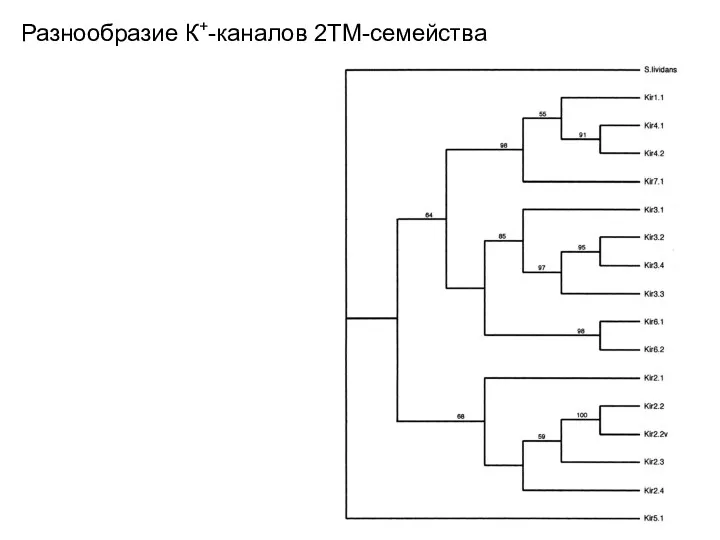
- 21. Разнообразие К+-каналов 2ТМ-семейства
- 22. Разновидности К+-каналов IACh, muscarine-activated K+ current IK1, inward rectifier.
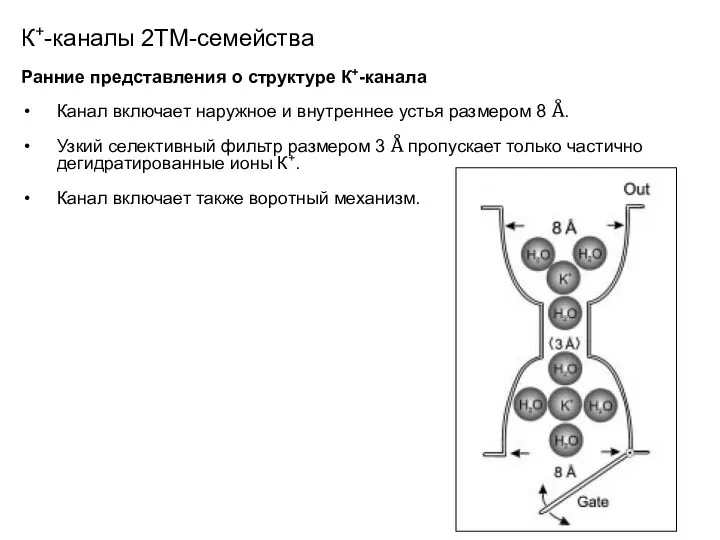
- 23. К+-каналы 2ТМ-семейства Ранние представления о структуре К+-канала Канал включает наружное и внутреннее устья размером 8 Å.
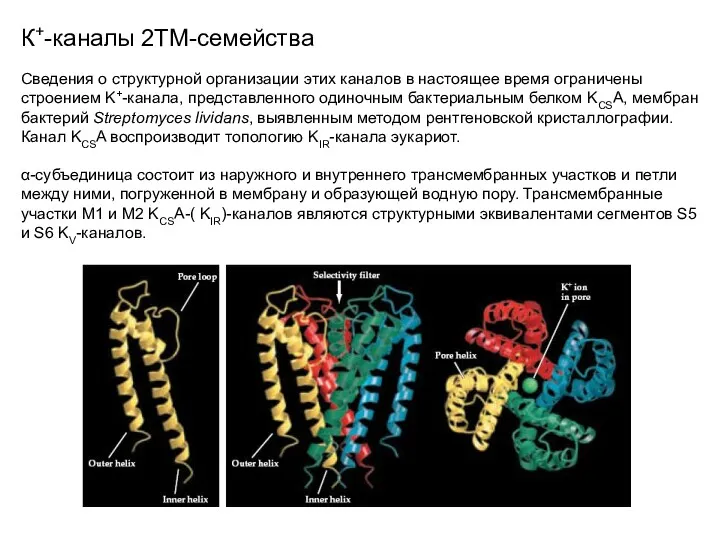
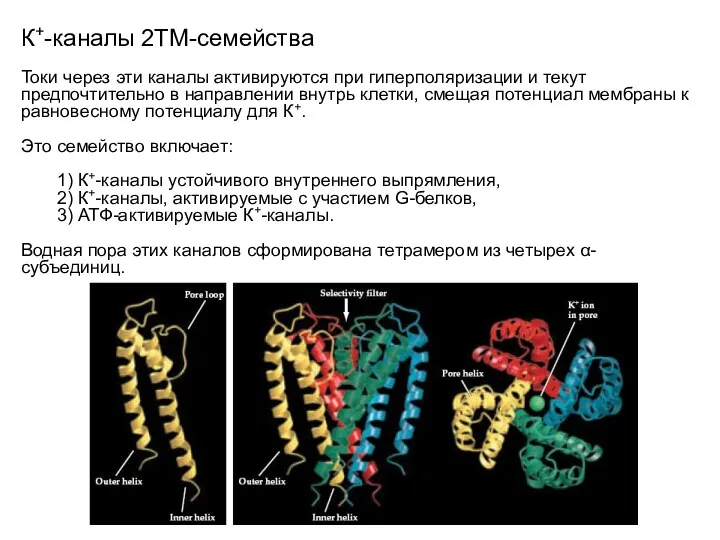
- 24. К+-каналы 2ТМ-семейства Сведения о структурной организации этих каналов в настоящее время ограничены строением K+-канала, представленного одиночным
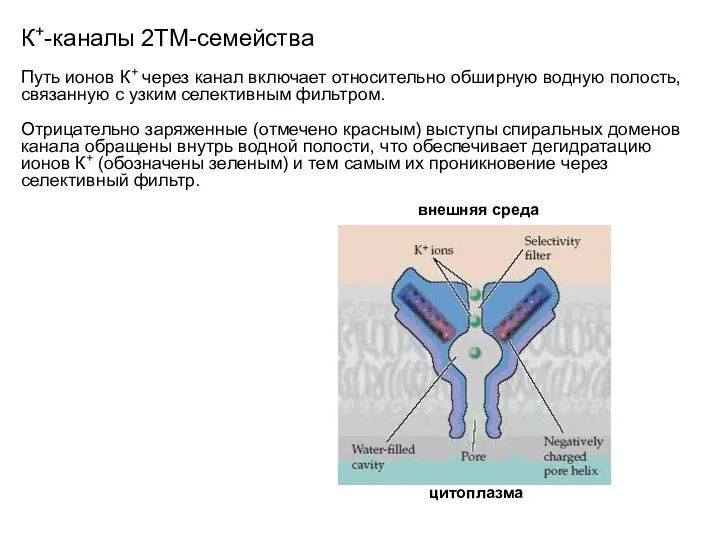
- 25. К+-каналы 2ТМ-семейства Путь ионов К+ через канал включает относительно обширную водную полость, связанную с узким селективным
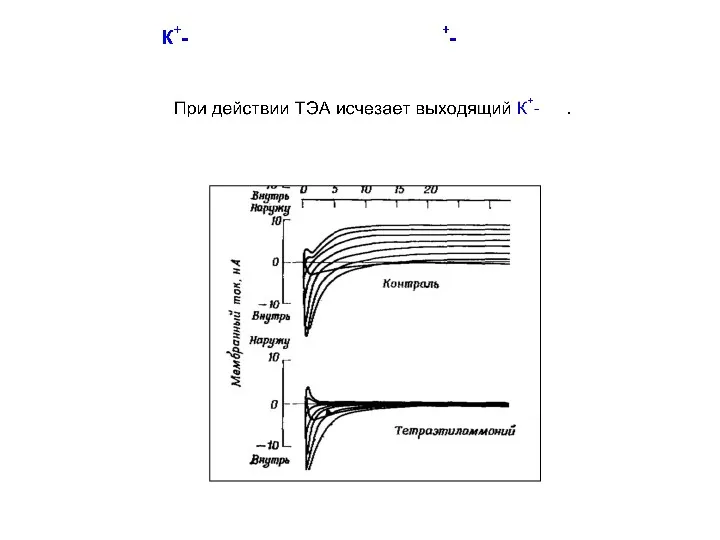
- 26. К+-каналы 2ТМ-семейства Токи через эти каналы активируются при гиперполяризации и текут предпочтительно в направлении внутрь клетки,
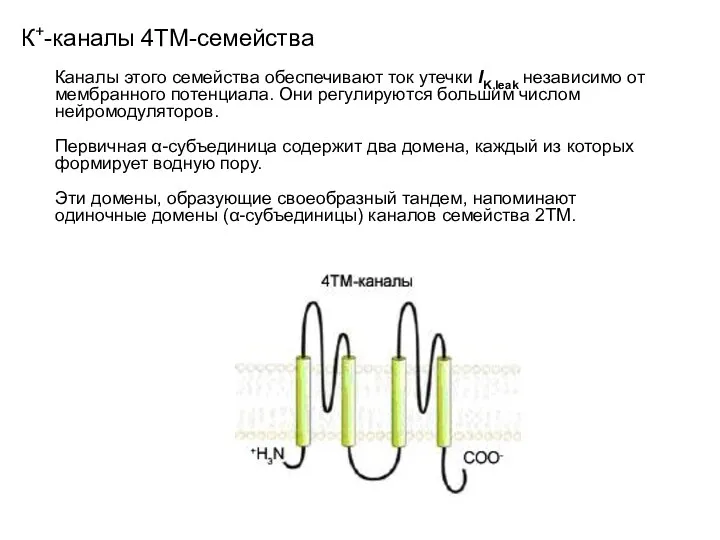
- 27. К+-каналы 4ТМ-семейства Каналы этого семейства обеспечивают ток утечки IK,leak независимо от мембранного потенциала. Они регулируются большим
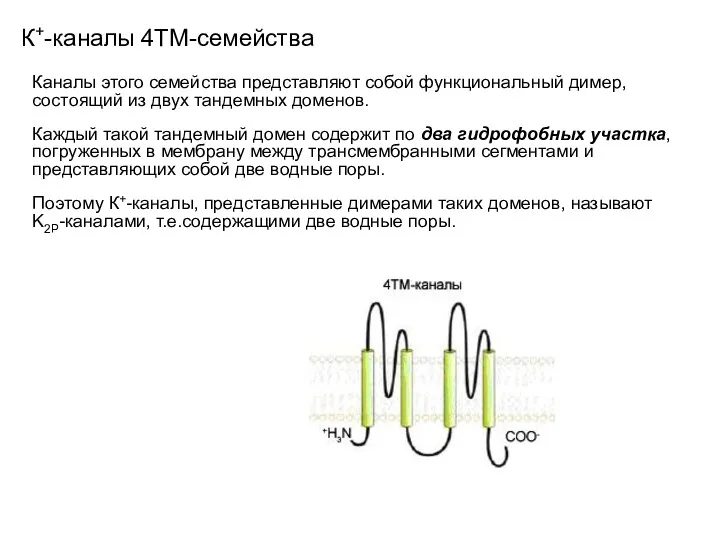
- 28. К+-каналы 4ТМ-семейства Каналы этого семейства представляют собой функциональный димер, состоящий из двух тандемных доменов. Каждый такой
- 29. К+-каналы 4ТМ-семейства
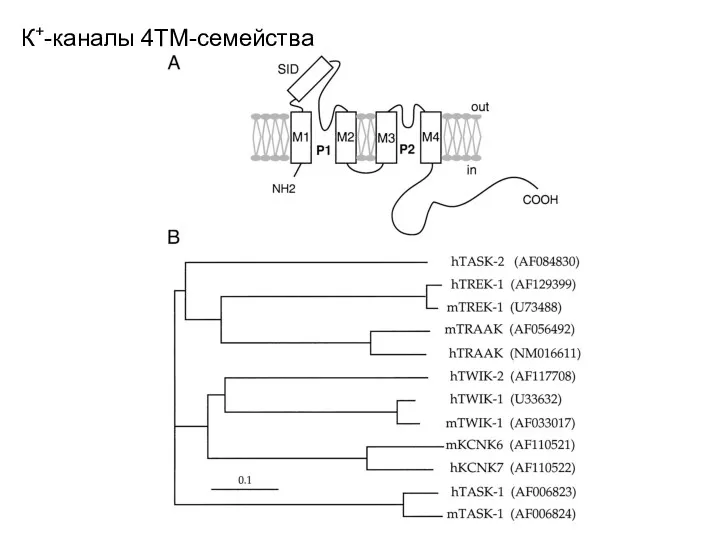
- 30. Разновидности К+-каналов TWIK, two-pore weak inward rectifier; TASK, TWIK-related acid-sensitive K+ channel; TRAAK, TWIK-related arachidonic acid-stimulated
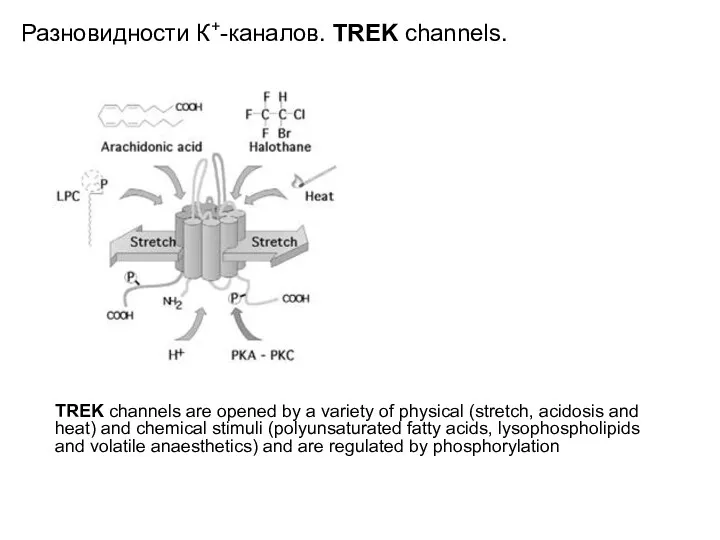
- 31. Разновидности К+-каналов. TREK channels. TREK channels are opened by a variety of physical (stretch, acidosis and
- 32. К+-каналы 6ТМ-семейства Сегменты S5 и S6 α-субъединиц этих каналов являются эквивалентами сегментов М1 и М2 α-субъединиц
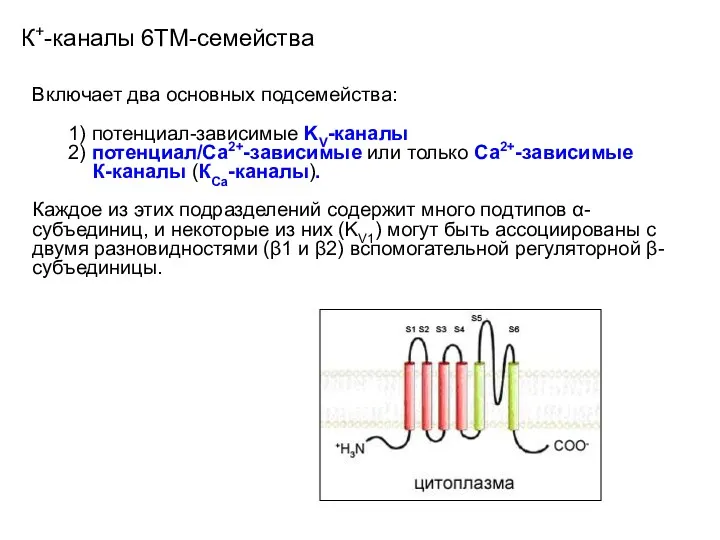
- 33. К+-каналы 6ТМ-семейства Включает два основных подсемейства: 1) потенциал-зависимые KV-каналы 2) потенциал/Са2+-зависимые или только Са2+-зависимые К-каналы (КСа-каналы).
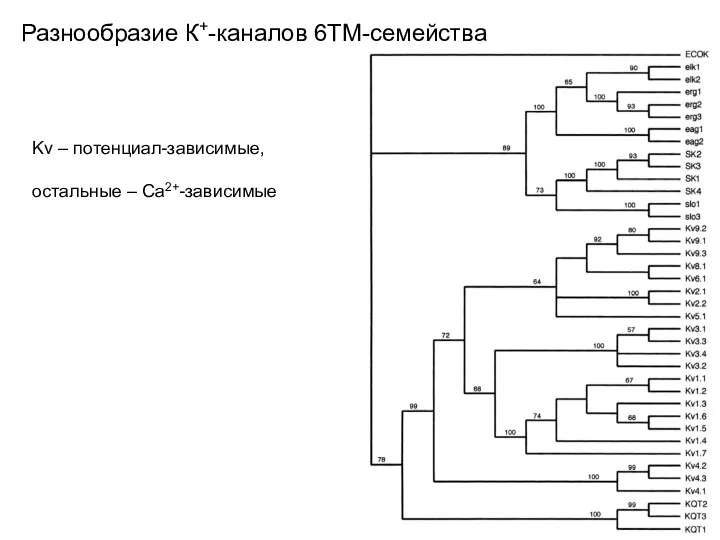
- 34. Разнообразие К+-каналов 6ТМ-семейства Kv – потенциал-зависимые, остальные – Са2+-зависимые
- 35. К+-каналы 6ТМ-семейства Подсемейство потенциал-зависимых KV-каналов Одна группа KV-каналов (KV1-4) включает функциональные К+-каналы задержанного выпрямления (англ., delayed
- 36. Разделение IK и IA
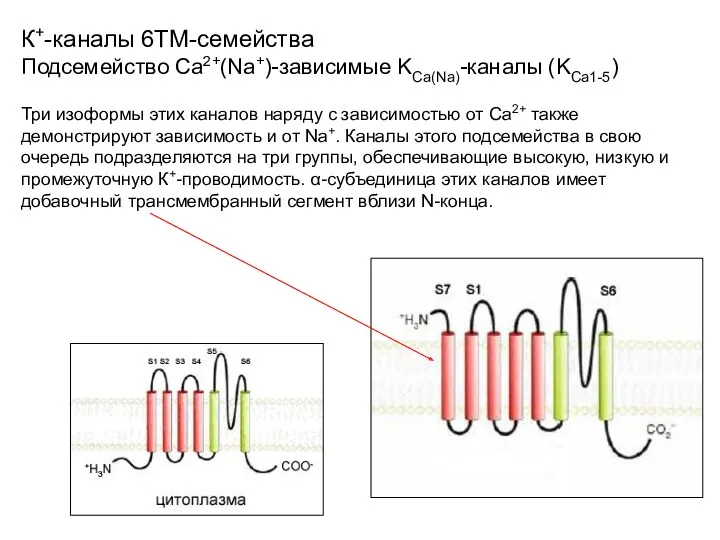
- 37. К+-каналы 6ТМ-семейства Подсемейство Са2+(Nа+)-зависимые KСа(Na)-каналы (KСа1-5) Три изоформы этих каналов наряду с зависимостью от Са2+ также
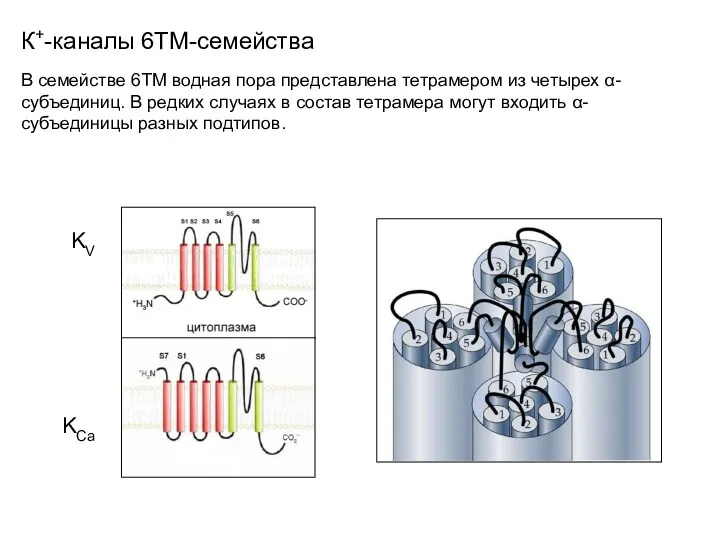
- 38. К+-каналы 6ТМ-семейства В семействе 6TM водная пора представлена тетрамером из четырех α-субъединиц. В редких случаях в
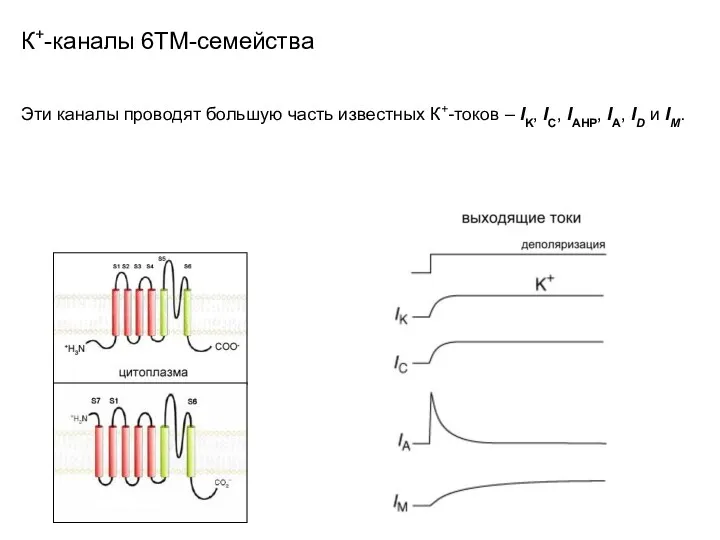
- 39. К+-каналы 6ТМ-семейства Эти каналы проводят большую часть известных К+-токов – IK, IC, IAHP, IA, ID и
- 40. Селективный фильтр К+-каналов Уникальный и консервативный селективный фильтр представлен пятью кислотными остатками (-COO-), которые образуют кольцо
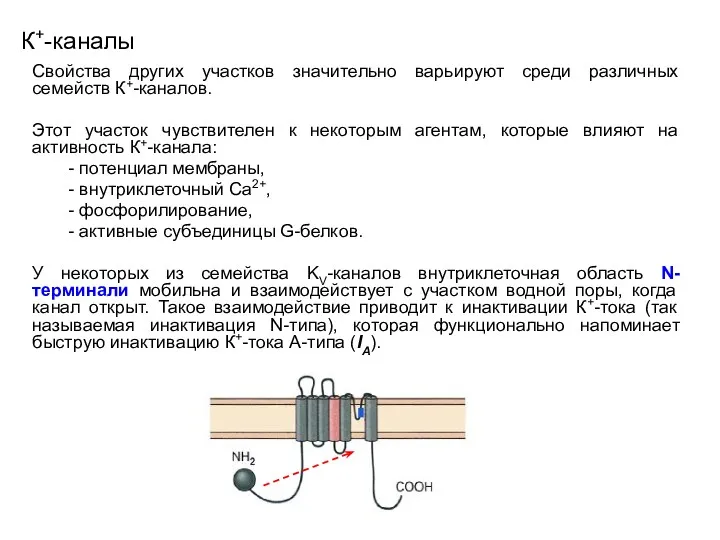
- 41. К+-каналы Свойства другого участка значительно варьируют среди различных семейств К+-каналов. Этот участок чувствителен к некоторым агентам,
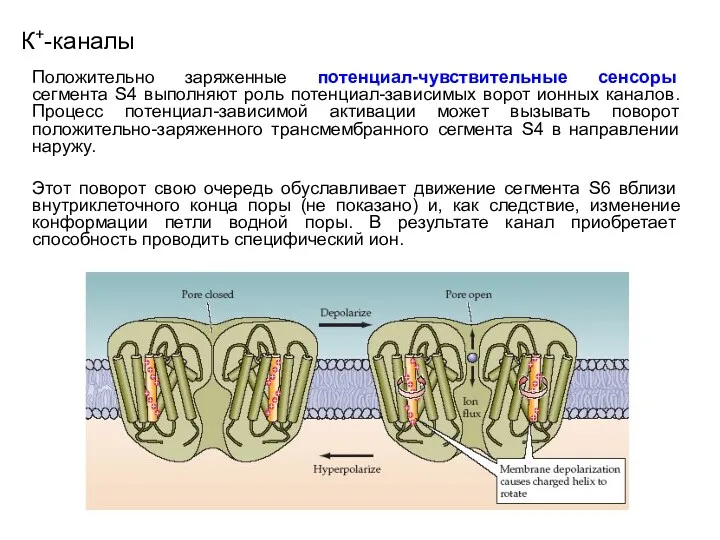
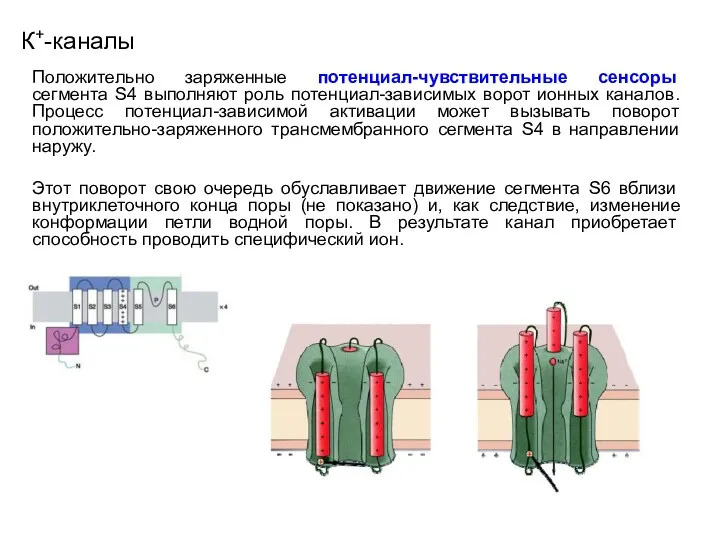
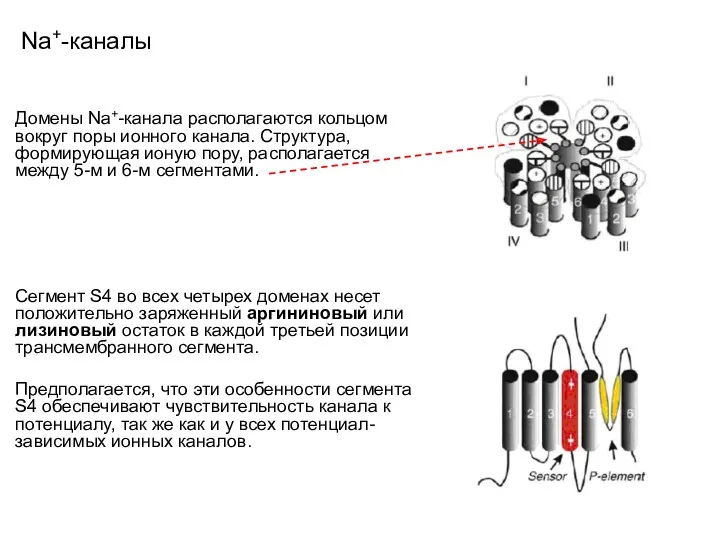
- 42. К+-каналы Положительно заряженные потенциал-чувствительные сенсоры сегмента S4 выполняют роль потенциал-зависимых ворот ионных каналов. Процесс потенциал-зависимой активации
- 43. К+-каналы Положительно заряженные потенциал-чувствительные сенсоры сегмента S4 выполняют роль потенциал-зависимых ворот ионных каналов. Процесс потенциал-зависимой активации
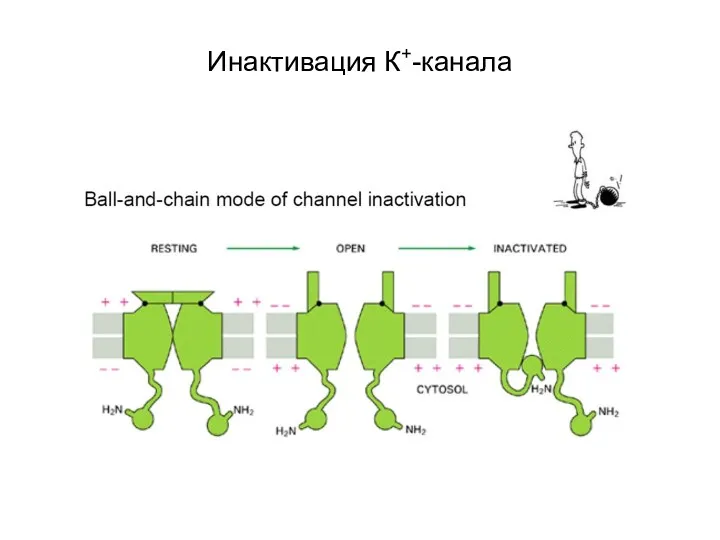
- 44. Инактивация К+-канала
- 45. К+-каналы Свойства других участков значительно варьируют среди различных семейств К+-каналов. Этот участок чувствителен к некоторым агентам,
- 48. Модель бактериального К+-канала
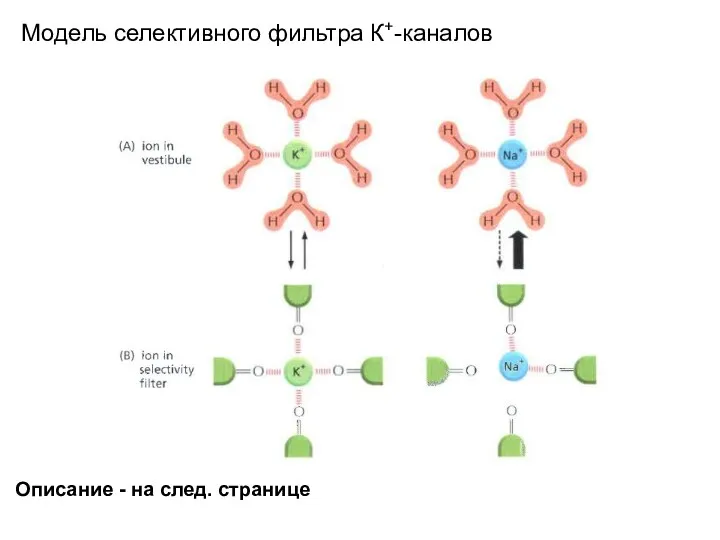
- 49. Модель селективного фильтра К+-каналов Описание - на след. странице
- 50. K+ specificity of the selectivity filter in a K+ channel. The drawing shows K+ and Na+
- 51. Селективный фильтр К+-каналов Уникальный и консервативный селективный фильтр представлен пятью кислотными остатками (-COO-), которые образуют кольцо
- 55. Энергетический профиль К-канала
- 56. Энергетический профиль К-канала
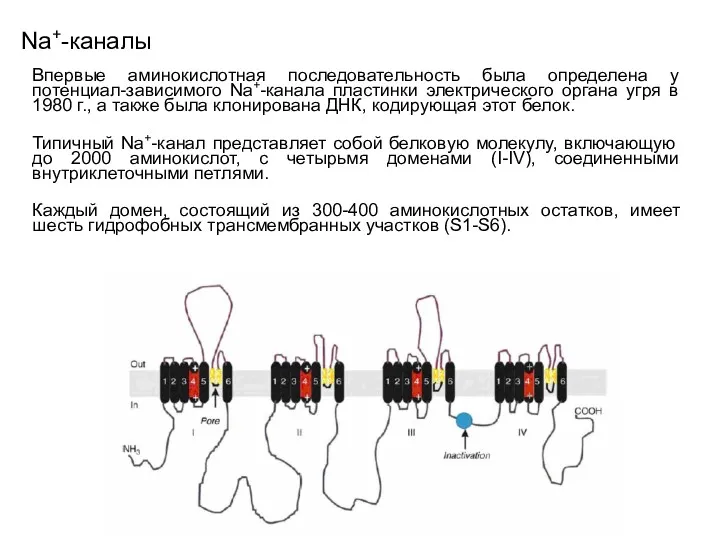
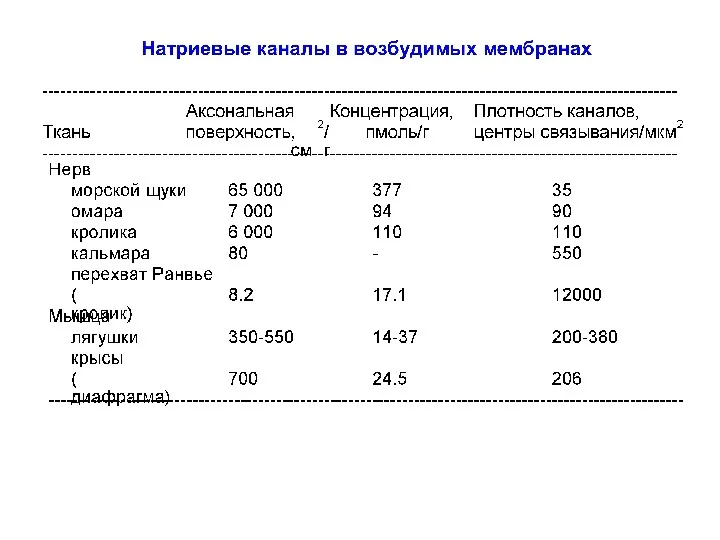
- 57. Na+-каналы Впервые аминокислотная последовательность была определена у потенциал-зависимого Na+-канала пластинки электрического органа угря в 1980 г.,
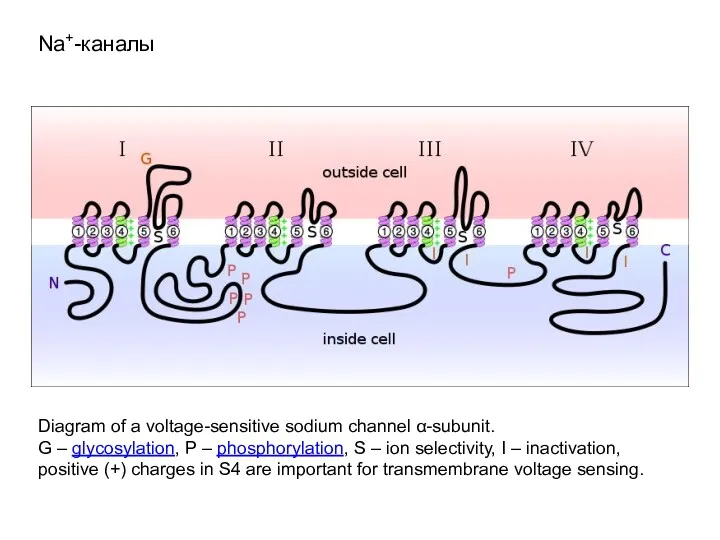
- 58. Na+-каналы Diagram of a voltage-sensitive sodium channel α-subunit. G – glycosylation, P – phosphorylation, S –
- 59. β-субъединицы Na+-каналов The channel purified from mammalian brain consists of the large α-subunit (260 kDa) with
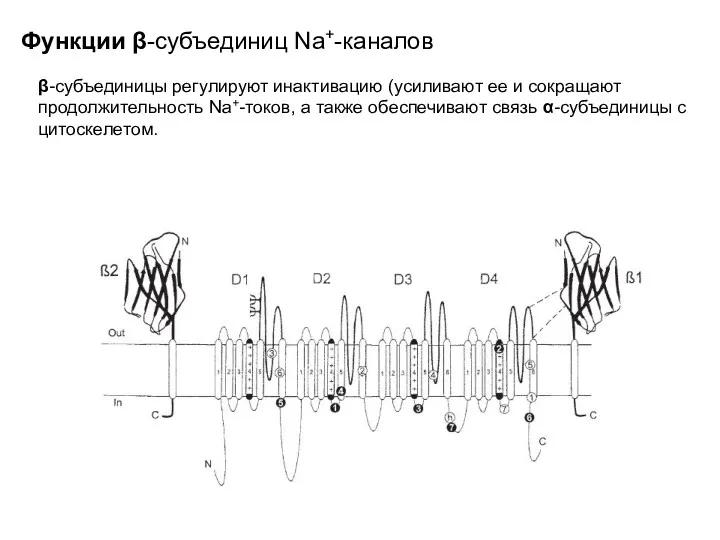
- 60. Функции β-субъединиц Na+-каналов β-субъединицы регулируют инактивацию (усиливают ее и сокращают продолжительность Na+-токов, а также обеспечивают связь
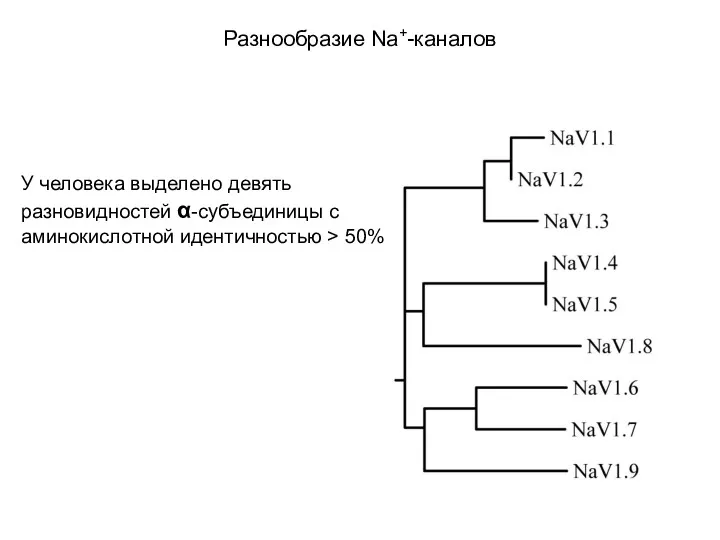
- 61. Разнообразие Na+-каналов У человека выделено девять разновидностей α-субъединицы с аминокислотной идентичностью > 50%
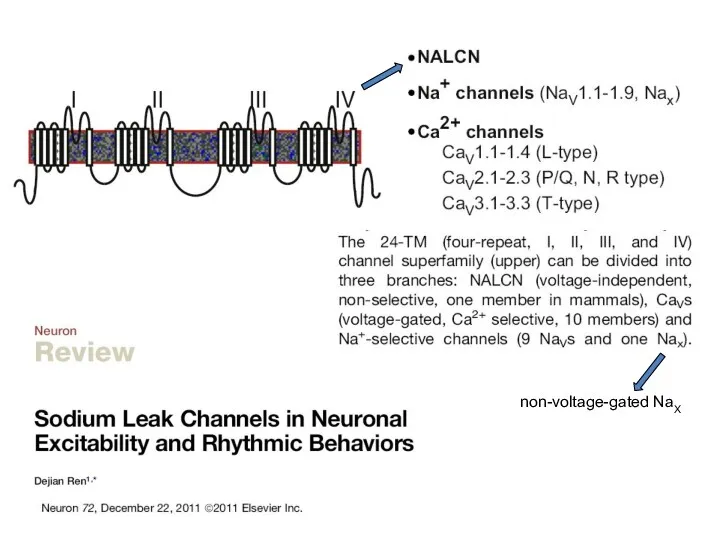
- 62. non-voltage-gated NaX
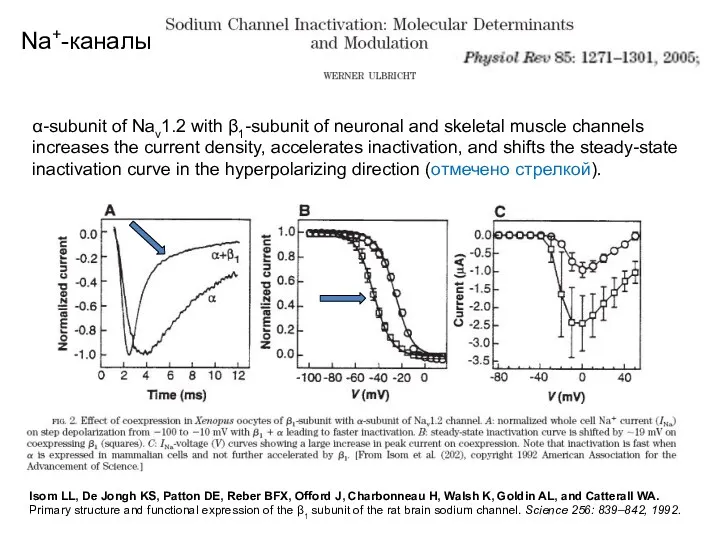
- 63. Na+-каналы α-subunit of Nav1.2 with β1-subunit of neuronal and skeletal muscle channels increases the current density,
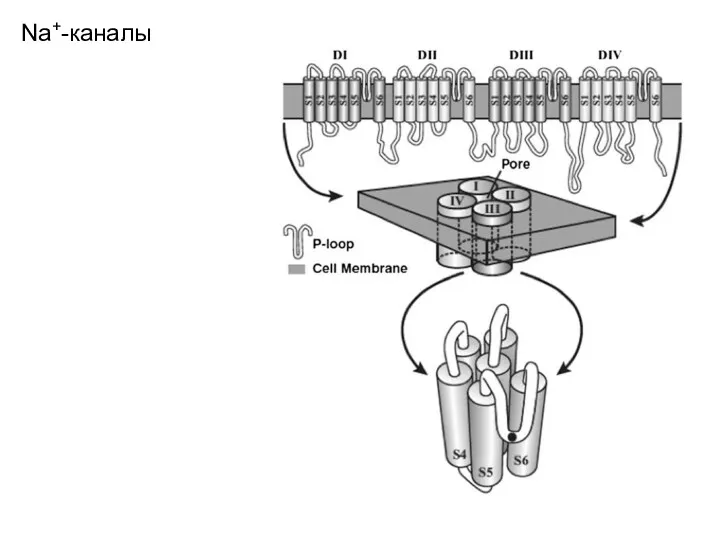
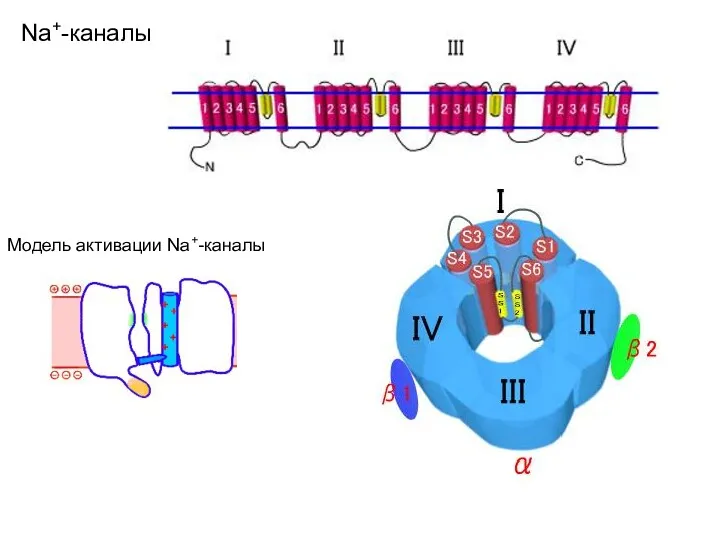
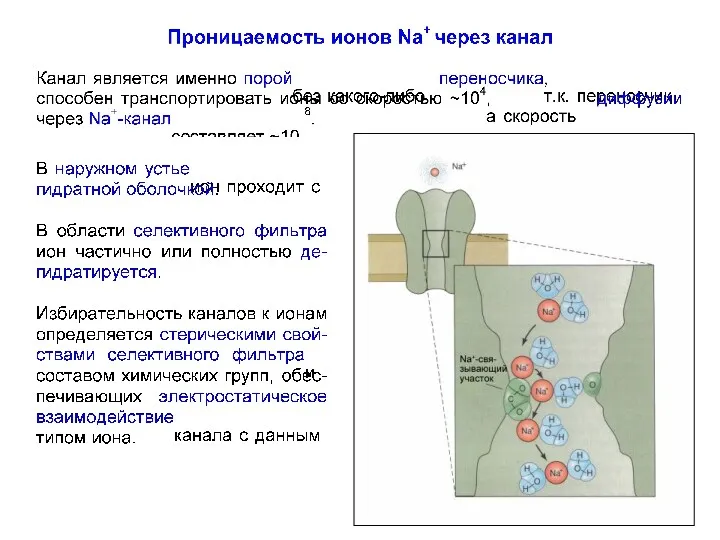
- 64. Na+-каналы Домены Na+-канала располагаются кольцом вокруг поры ионного канала. Структура, формирующая ионую пору, располагается между 5-м
- 65. Na+-каналы
- 66. Na+-каналы Модель активации Na+-каналы
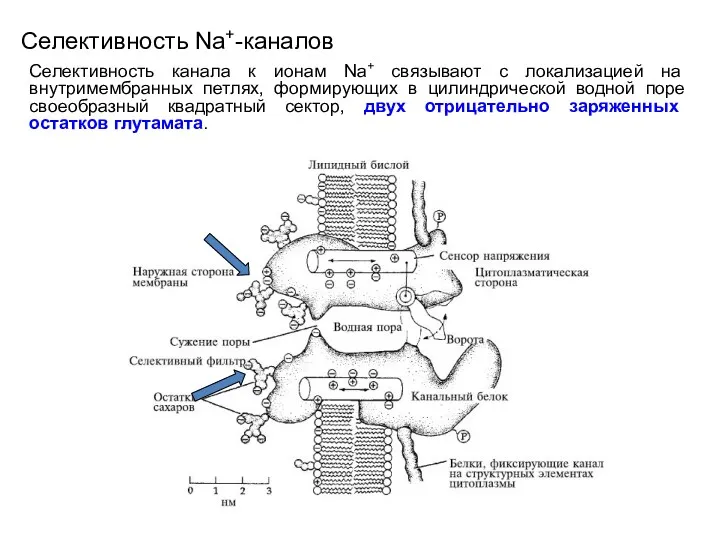
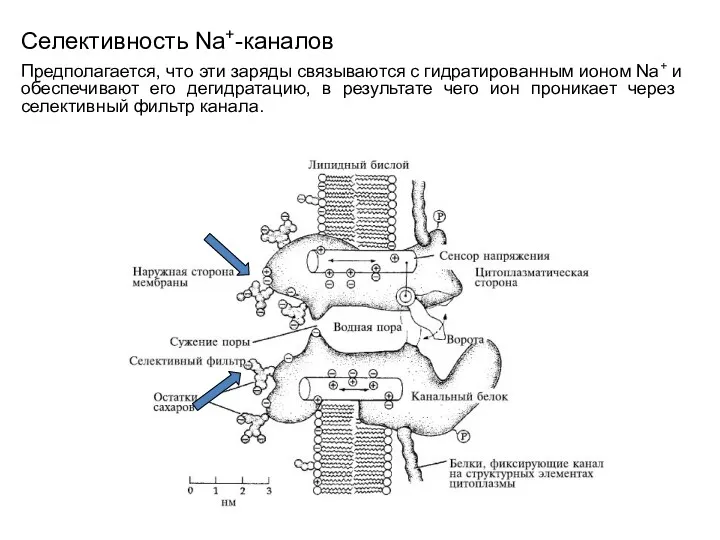
- 67. Селективность Na+-каналов Селективность канала к ионам Na+ связывают с локализацией на внутримембранных петлях, формирующих в цилиндрической
- 68. Селективность Na+-каналов Предполагается, что эти заряды связываются с гидратированным ионом Na+ и обеспечивают его дегидратацию, в
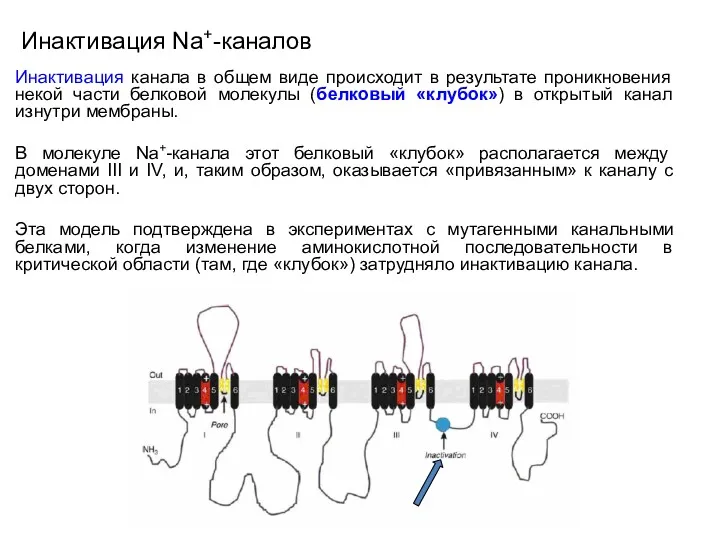
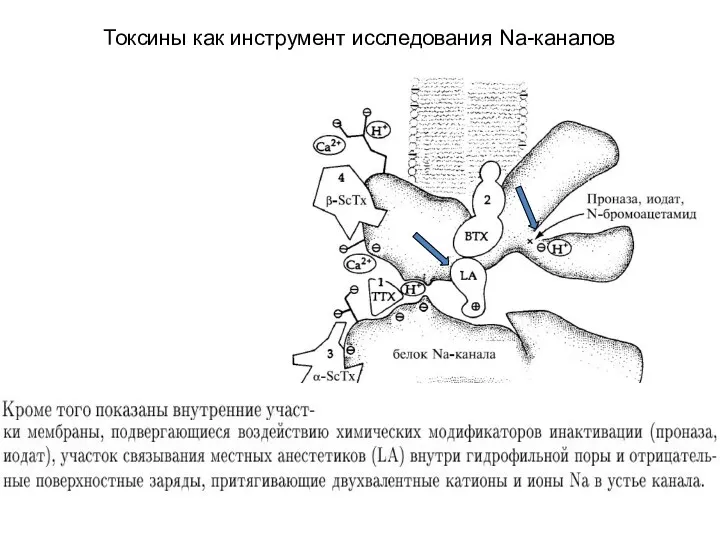
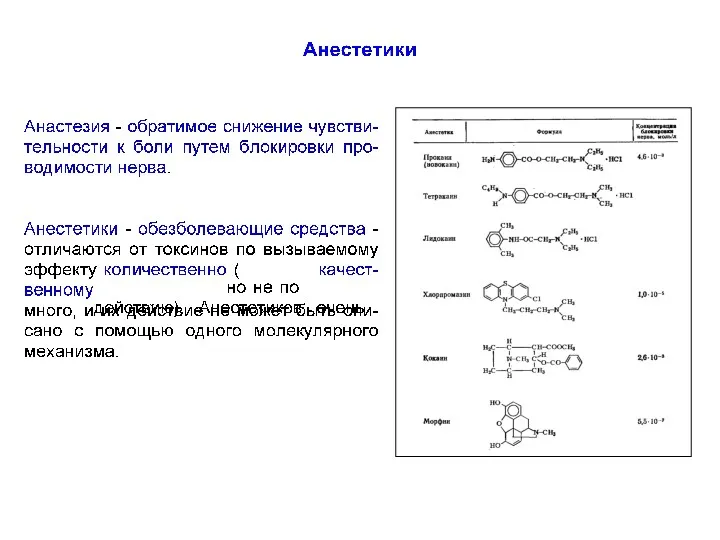
- 69. Инактивация Na+-каналов Инактивация канала в общем виде происходит в результате проникновения некой части белковой молекулы (белковый
- 70. гуанидиновая группировка
- 75. At the binding site the positive charge of the ion is stabilized by a negatively charged
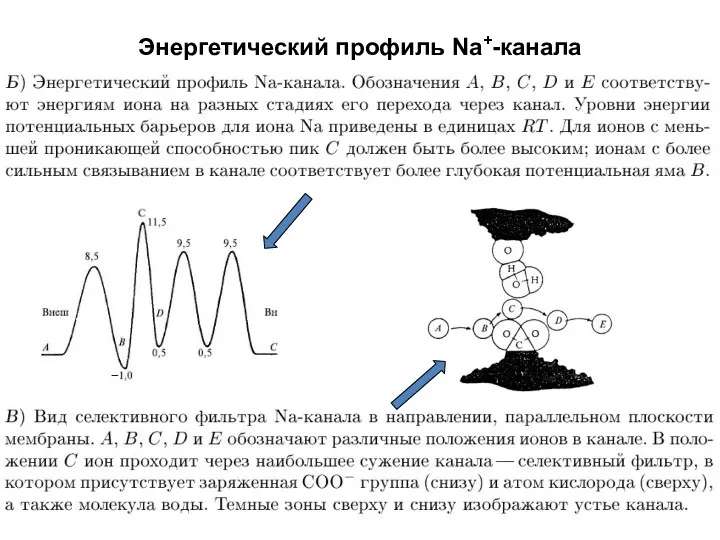
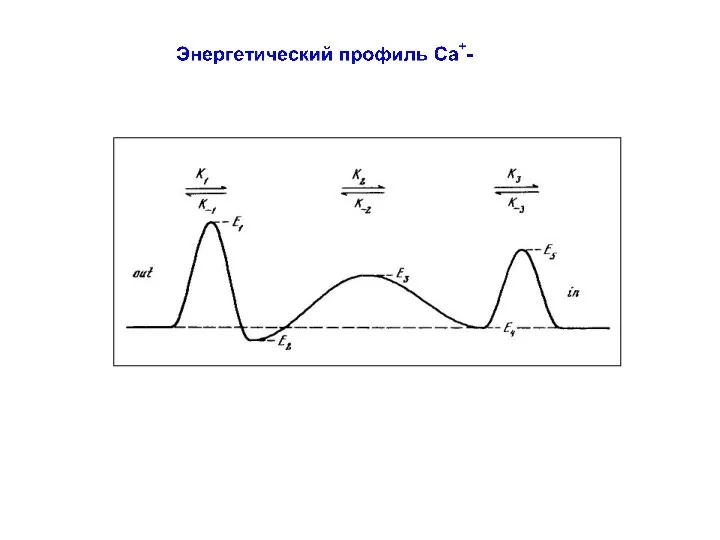
- 77. Энергетический профиль Na+-канала
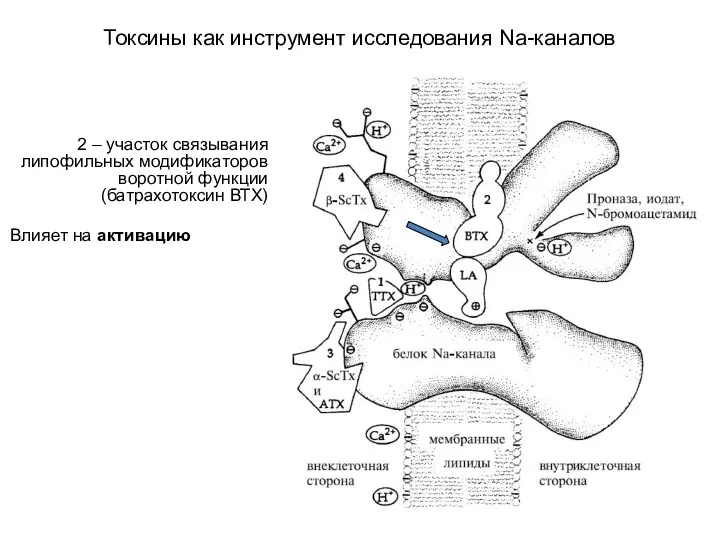
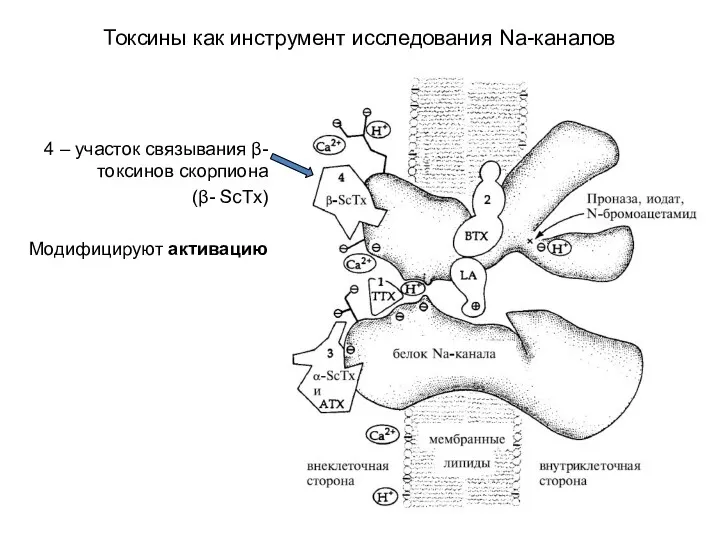
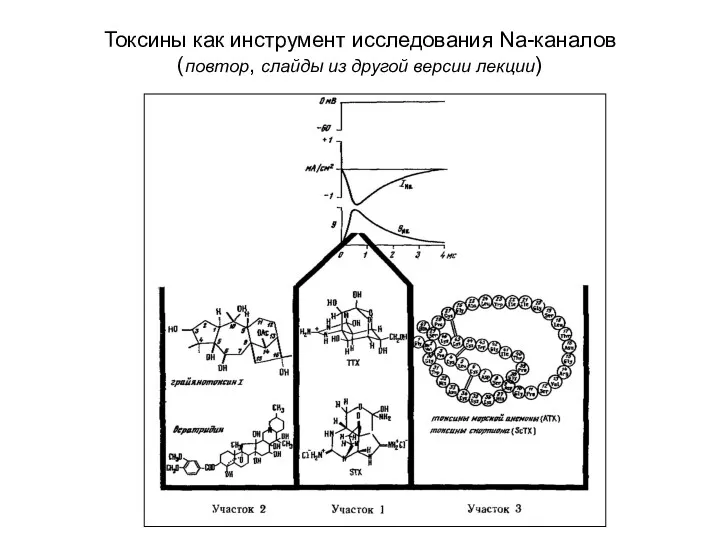
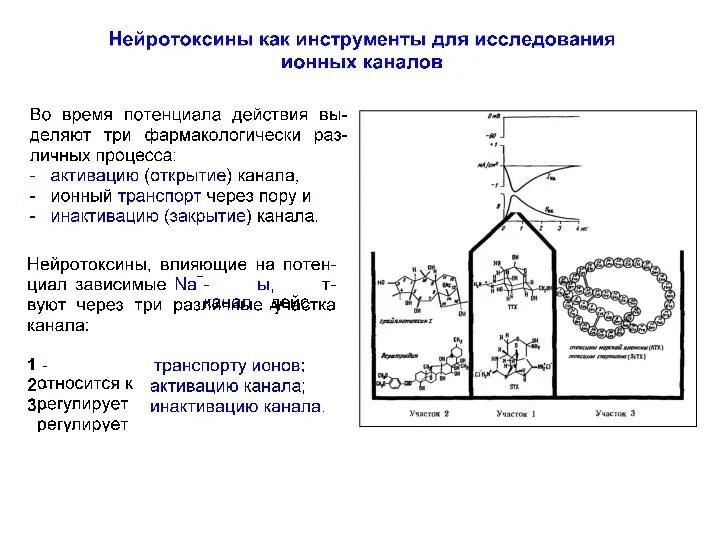
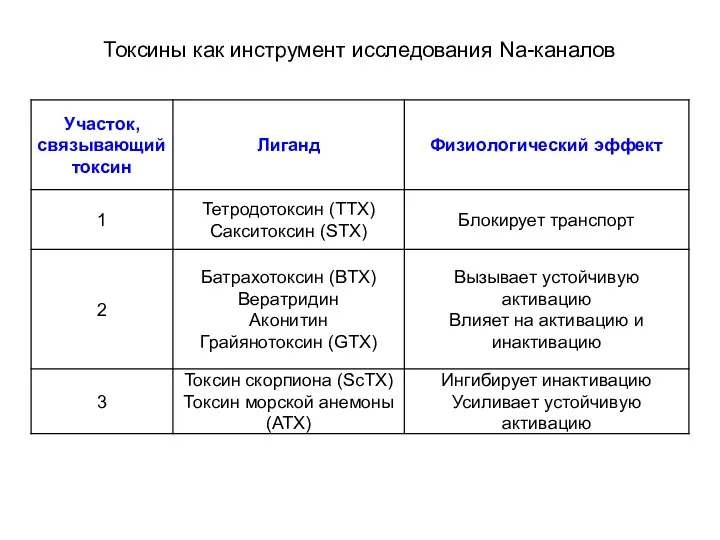
- 79. Токсины как инструмент исследования Na-каналов 1-4 – рецепторные участки канала связываются с разными токсинами
- 80. Токсины как инструмент исследования Na-каналов 1 – участок связывания с тетродотоксина и сакситоксина Влияют на проводимость
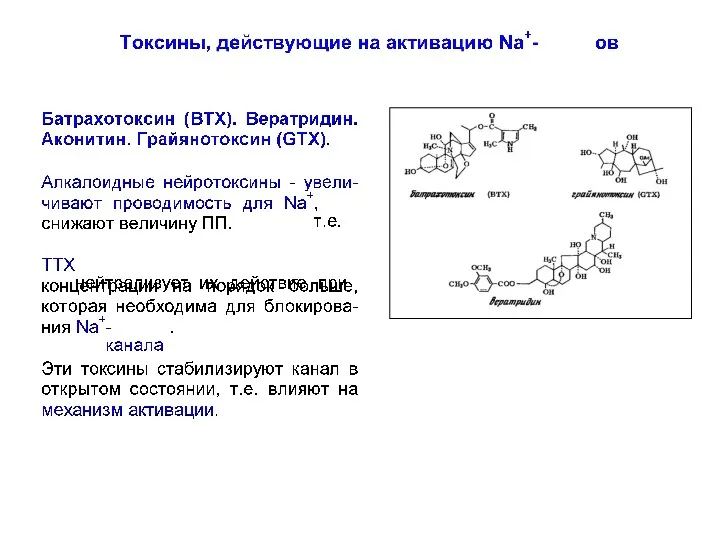
- 81. Токсины как инструмент исследования Na-каналов 2 – участок связывания липофильных модификаторов воротной функции (батрахотоксин ВТХ) Влияет
- 82. Токсины как инструмент исследования Na-каналов 3 – участок связывания пептидных токсинов скорпиона (α-ScTx) и актинии (ATX)
- 83. Токсины как инструмент исследования Na-каналов 4 – участок связывания β- токсинов скорпиона (β- ScTx) Модифицируют активацию
- 84. Токсины как инструмент исследования Na-каналов
- 85. Токсины как инструмент исследования Na-каналов (повтор, слайды из другой версии лекции)
- 95. Токсины как инструмент исследования Na-каналов
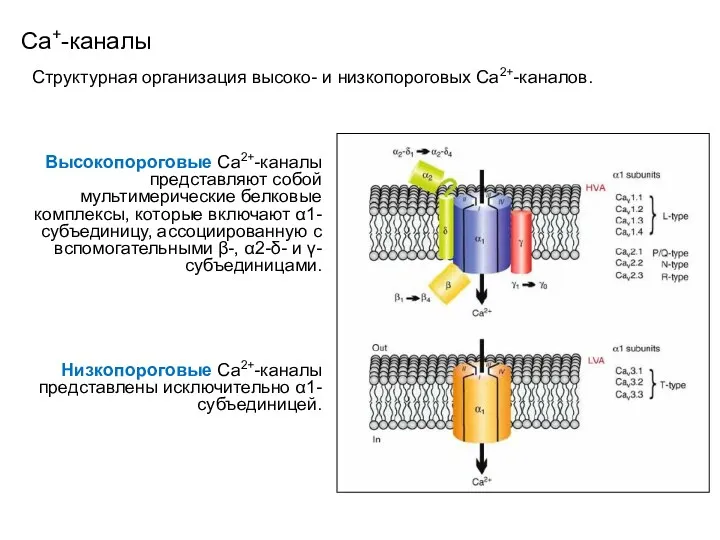
- 96. Высокопороговые Сa+-каналы Структура α1-субъединицы Са2+-каналов сходна со структурой α1-субъединицы Na+-канала. Цитоплазматические петли, соединяющие четыре домена, структурно
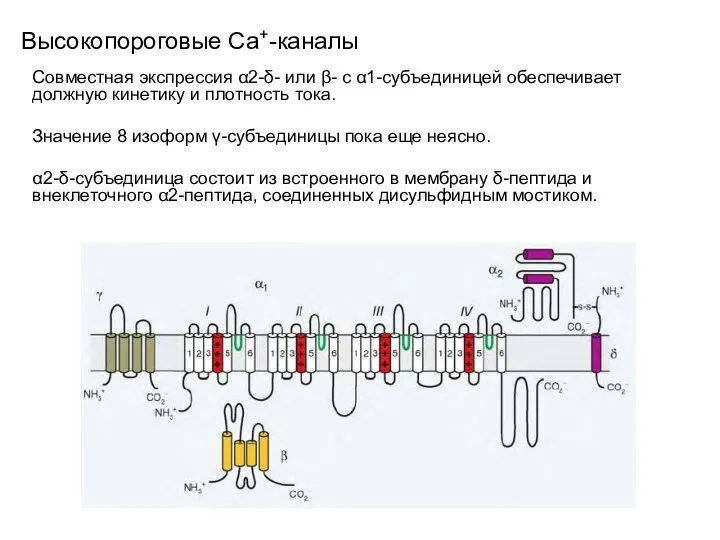
- 97. Высокопороговые Сa+-каналы Совместная экспрессия α2-δ- или β- с α1-субъединицей обеспечивает должную кинетику и плотность тока. Значение
- 98. Высокопороговые Сa+-каналы В настоящее время выделено четыре гена, кодирующих 4 изоформы δ-пептида. 4 изоформы β-субъединицы локализованы
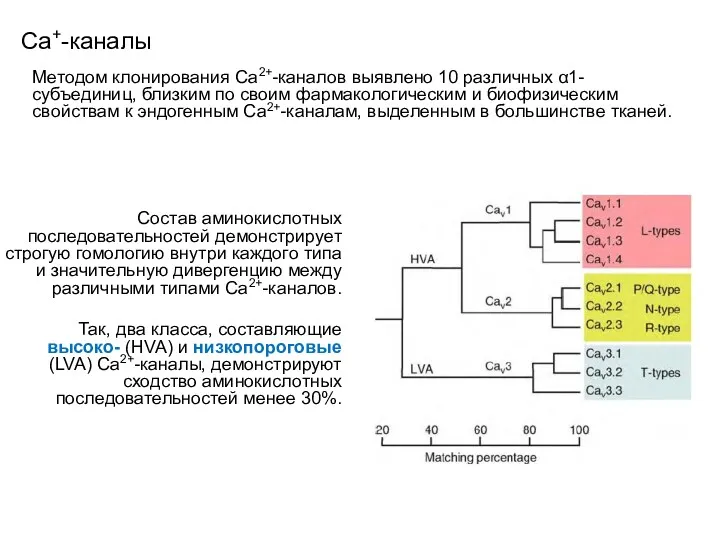
- 99. Сa+-каналы Методом клонирования Са2+-каналов выявлено 10 различных α1-субъединиц, близким по своим фармакологическим и биофизическим свойствам к
- 100. Сa+-каналы Структурная организация высоко- и низкопороговых Са2+-каналов. Высокопороговые Са2+-каналы представляют собой мультимерические белковые комплексы, которые включают
- 101. Селективность Сa+-каналов Селективная проницаемость Са2+-каналов обеспечивается специализированной областью, содержащей кольцо отрицательных заряженных групп (остатков определенных аминокислот)
- 103. цАМФ (цГМФ)-зависимые катионные каналы Активность этих каналов зависит от их связывания с циклическими нуклеотидами цАМФ и
- 104. цАМФ (цГМФ)-зависимые катионные каналы Их молекулярная структура принципиально совпадает со структурой других потенциал-зависимых каналов. Сегмент 4
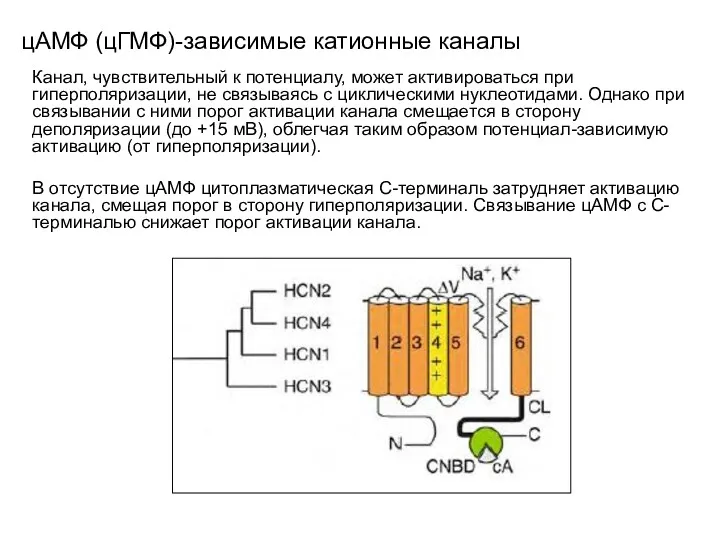
- 105. цАМФ (цГМФ)-зависимые катионные каналы В канале, независимом от потенциала, связывание с циклическими нуклеотидами запускает последовательность аллостерических
- 106. цАМФ (цГМФ)-зависимые катионные каналы Канал, чувствительный к потенциалу, может активироваться при гиперполяризации, не связываясь с циклическими
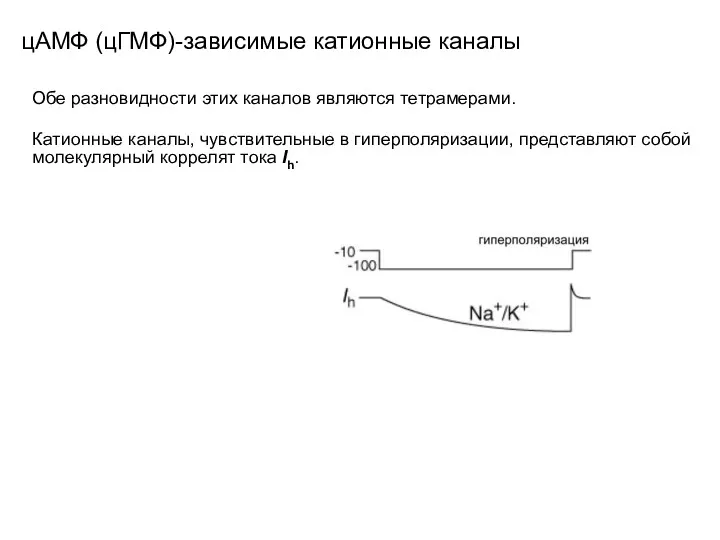
- 107. цАМФ (цГМФ)-зависимые катионные каналы Обе разновидности этих каналов являются тетрамерами. Катионные каналы, чувствительные в гиперполяризации, представляют
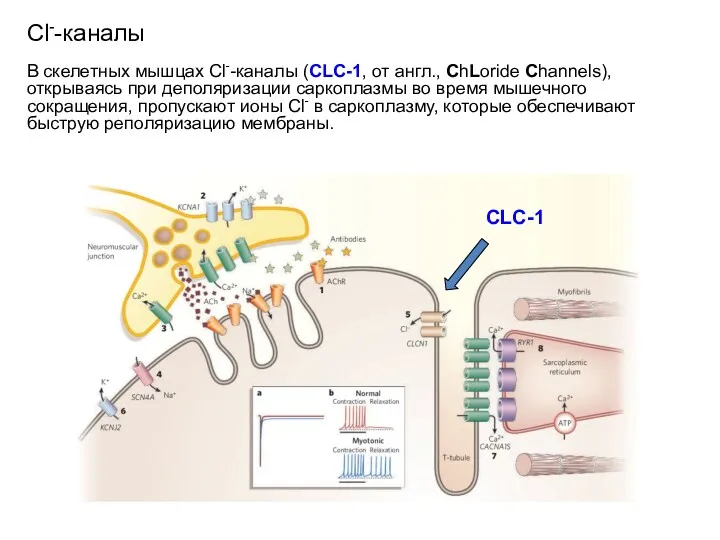
- 108. Сl--каналы В скелетных мышцах Cl--каналы (CLC-1, от англ., ChLoride Channels), открываясь при деполяризации саркоплазмы во время
- 109. CLC-1 Сl--каналы В скелетных мышцах Cl--каналы (CLC-1, от англ., ChLoride Channels), открываясь при деполяризации саркоплазмы во
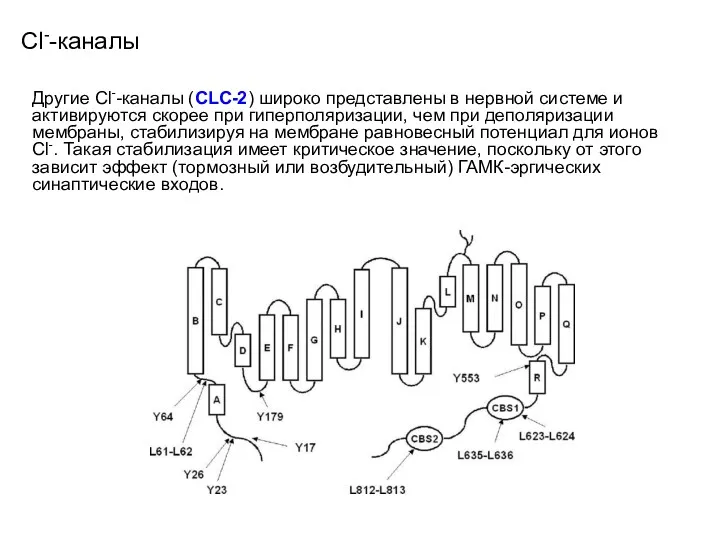
- 110. Сl--каналы Другие Cl--каналы (CLC-2) широко представлены в нервной системе и активируются скорее при гиперполяризации, чем при
- 112. Скачать презентацию






































 В мире животных
В мире животных Биоокисление. Метаболизм углеводов. Тема 6
Биоокисление. Метаболизм углеводов. Тема 6 Влияние приемов выращивания на урожайность и качество озимой пшеницы в центральной зоне Краснодарского края
Влияние приемов выращивания на урожайность и качество озимой пшеницы в центральной зоне Краснодарского края Химический состав клетки - технологическая карта урока.
Химический состав клетки - технологическая карта урока. Тутовый шелкопряд
Тутовый шелкопряд Перелётные птицы
Перелётные птицы Моллюски. Класс брюхоногие. Виноградная улитка
Моллюски. Класс брюхоногие. Виноградная улитка Физиология мышц и синапсов
Физиология мышц и синапсов Популяция как биологическая система
Популяция как биологическая система Живое вещество. Уровни организации живого
Живое вещество. Уровни организации живого Перелітні та осілі птахи Уманщини
Перелітні та осілі птахи Уманщини Глаз человека как оптическая система. Построение изображения на сетчатке
Глаз человека как оптическая система. Построение изображения на сетчатке Бактерии. Грибы. Общая характеристика грибов
Бактерии. Грибы. Общая характеристика грибов Plant Diversity II: The Evolution of Seed Plants
Plant Diversity II: The Evolution of Seed Plants Polymers and amino acids
Polymers and amino acids Нормальная микрофлора тела животных. Роль микроорганизмов в круговороте веществ в природе
Нормальная микрофлора тела животных. Роль микроорганизмов в круговороте веществ в природе Жизнь в морях и океанах
Жизнь в морях и океанах Гриби
Гриби Действие физических факторов на микроорганизмы. (Лекция 10)
Действие физических факторов на микроорганизмы. (Лекция 10) Белый медведь
Белый медведь Полідисперсна система молока
Полідисперсна система молока Încrengătura Annelida Viermii inelaţi
Încrengătura Annelida Viermii inelaţi Многообразие и значение земноводных
Многообразие и значение земноводных Углеводы липиды_химсостав клетки
Углеводы липиды_химсостав клетки Меловой период (мел)
Меловой период (мел) iPavlov: Conversational Intelligence Project
iPavlov: Conversational Intelligence Project Загальна характеристика гормонів
Загальна характеристика гормонів Функциональная анатомия кровеносной системы
Функциональная анатомия кровеносной системы