Содержание
- 2. Електролітична дисоціація
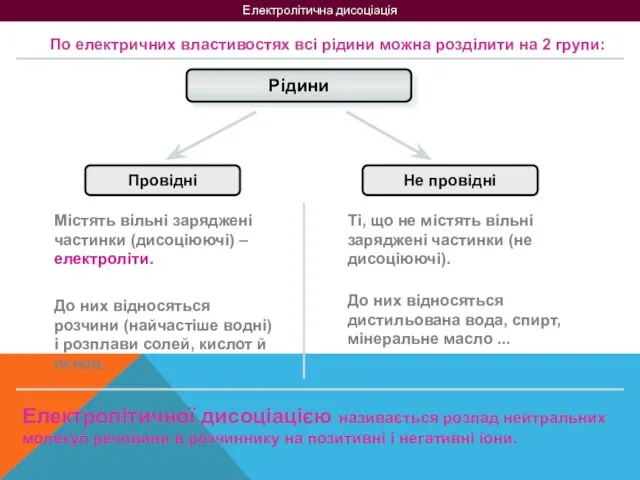
- 3. Електролітична дисоціація По електричних властивостях всі рідини можна розділити на 2 групи: Рідини Провідні Не провідні
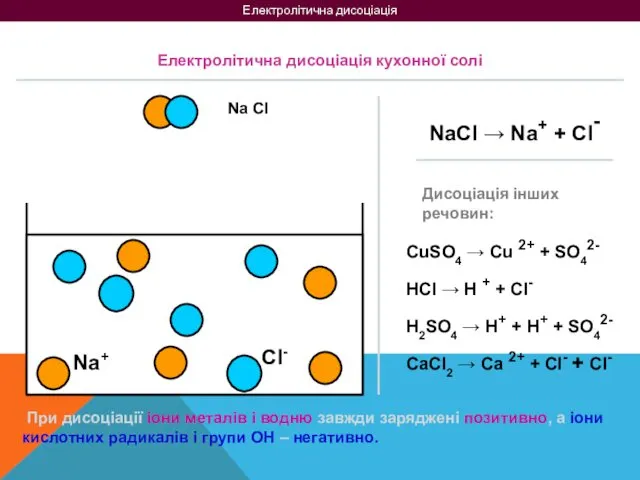
- 4. Електролітична дисоціація Na Cl Na+ Cl- Електролітична дисоціація кухонної солі NaCl → Na+ + Cl- Дисоціація
- 5. Електричний струм в електролітах. Електроліз
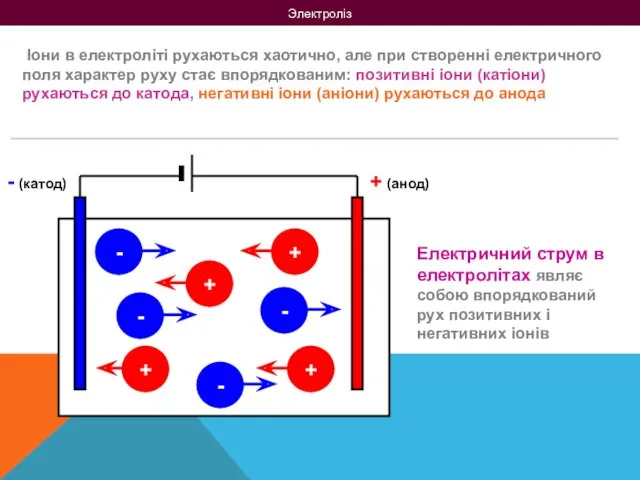
- 6. Электроліз Іони в електроліті рухаються хаотично, але при створенні електричного поля характер руху стає впорядкованим: позитивні
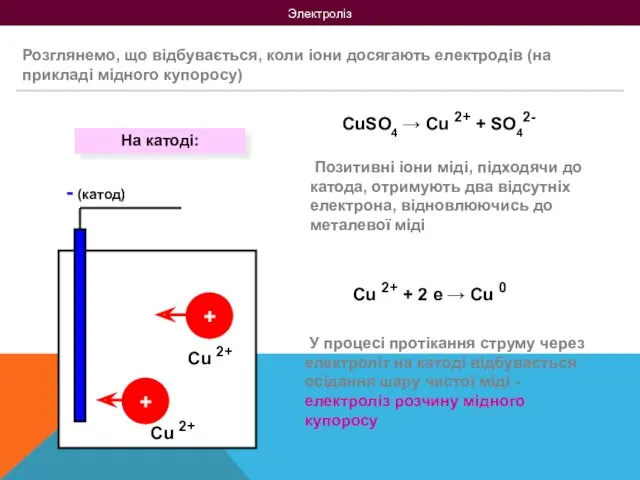
- 7. Электроліз Розглянемо, що відбувається, коли іони досягають електродів (на прикладі мідного купоросу) CuSO4 → Cu 2+
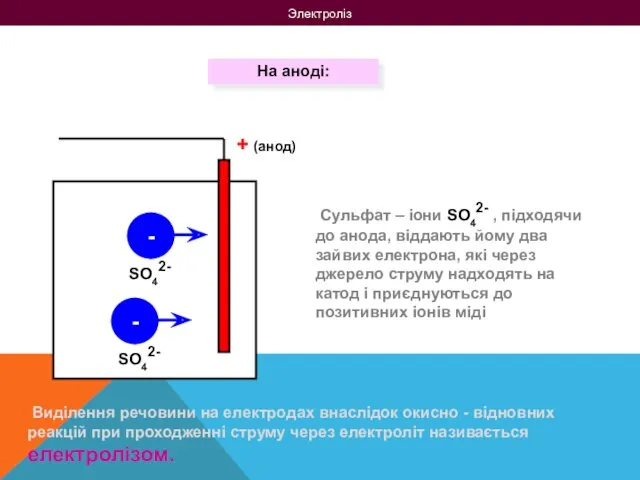
- 8. Электроліз На аноді: + (анод) - - Виділення речовини на електродах внаслідок окисно - відновних реакцій
- 9. Закони електролізу
- 10. Закони електролізу Досліджував електроліз і відкрив його закони англійський фізик Майкл Фарадей в 1834 році Майкл
- 11. Закони електролізу Другий закон електролізу При однаковій кількості електрики (електричному заряді, що пройшов через електроліт) маса
- 12. Застосування електролізу
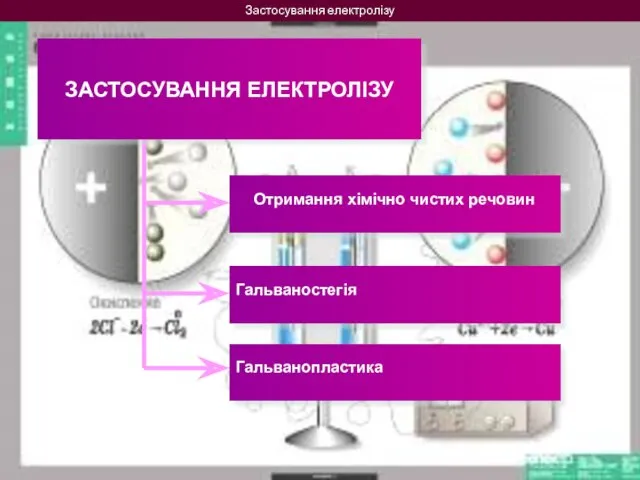
- 13. Застосування електролізу ЗАСТОСУВАННЯ ЕЛЕКТРОЛІЗУ Отримання хімічно чистих речовин Гальваностегія Гальванопластика
- 14. Застосування електролізу Засновником гальванотехніки та її найширшого застосування є Б. С. Якобі, який винайшов в 1836
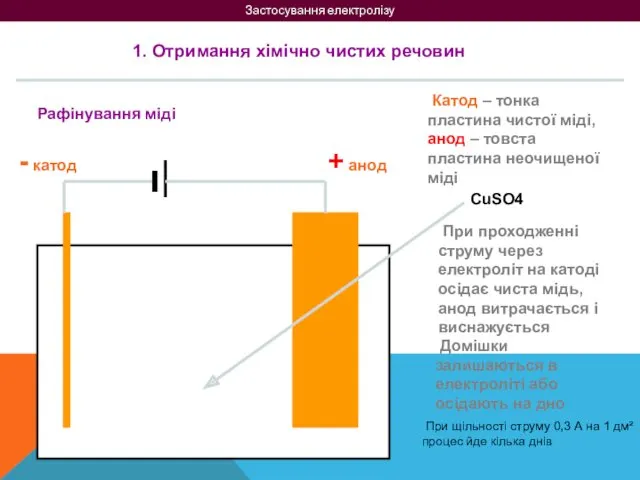
- 15. Застосування електролізу 1. Отримання хімічно чистих речовин Рафінування міді + анод - катод Катод – тонка
- 16. Застосування електролізу 1. Отримання хімічно чистих речовин Отримання алюмінію Алюміній отримують електролітичним способом з глинозему (згадайте
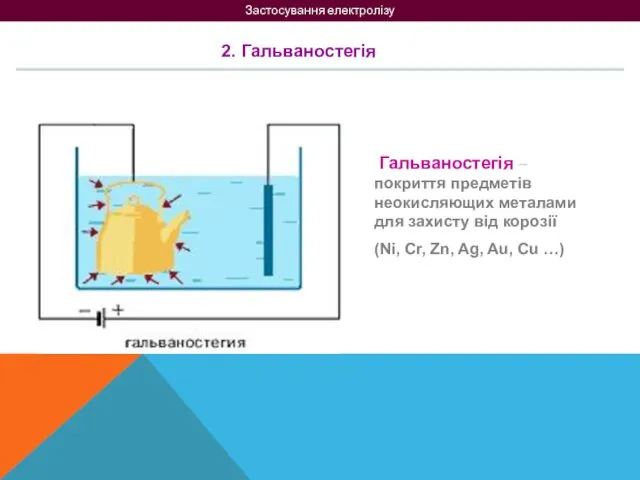
- 17. Застосування електролізу 2. Гальваностегія Гальваностегія – покриття предметів неокисляющих металами для захисту від корозії (Ni, Cr,
- 18. Застосування електролізу 3. Гальванопластика Копія барельєфа, отримана методом гальванопластики Гальванопластика – отримання відшаровується копій предмета, отриманих
- 20. Скачать презентацию









 Первое начало термодинамики. Работа. Внутренняя энергия. Теплота
Первое начало термодинамики. Работа. Внутренняя энергия. Теплота Формирование познавательного интереса на уроках физики ,с помощью современных образовательных технологий
Формирование познавательного интереса на уроках физики ,с помощью современных образовательных технологий Э.М. Спиридонов. Эволюция минералов серебра в зоне гипергенеза
Э.М. Спиридонов. Эволюция минералов серебра в зоне гипергенеза Атомно-силовой микроскоп
Атомно-силовой микроскоп Молекулярно-кинетическая теория газов. (Лекция 2)
Молекулярно-кинетическая теория газов. (Лекция 2) Брей-ринг. Игра для 7 класса
Брей-ринг. Игра для 7 класса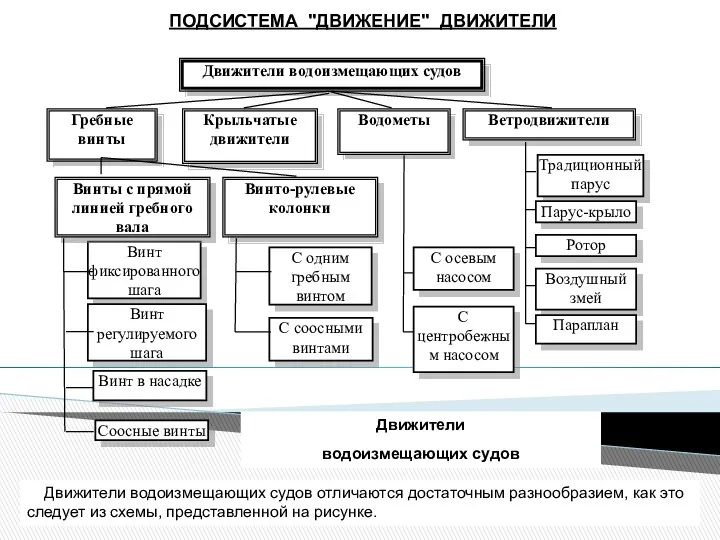 Подсистема Движение. Движители
Подсистема Движение. Движители Поршеньді компрессорларды жөндеу
Поршеньді компрессорларды жөндеу Детали машин. Основные положения
Детали машин. Основные положения Биологическое действие искусственных электромагнитных излучений
Биологическое действие искусственных электромагнитных излучений Решение задач. Импульс, энергия, законы сохранения
Решение задач. Импульс, энергия, законы сохранения корпускулярные свойства света
корпускулярные свойства света Квантовая оптика
Квантовая оптика 7 класс уроки 1-4 Введение
7 класс уроки 1-4 Введение Звуковые волны
Звуковые волны Прямолінійний рівноприскорений рух
Прямолінійний рівноприскорений рух Влияние звуковых волн на организм человека
Влияние звуковых волн на организм человека Теплоносители ядерных энергетических установок. Тема 4
Теплоносители ядерных энергетических установок. Тема 4 открытый урок-презентация на тему История Российской атомной энергетики
открытый урок-презентация на тему История Российской атомной энергетики Электрический заряд. Электризация тел.
Электрический заряд. Электризация тел. Импульс тела
Импульс тела Известные учёные физики
Известные учёные физики Поглощение лазерного излучения в металлах и полупроводниках
Поглощение лазерного излучения в металлах и полупроводниках Қыздыру үдерістері
Қыздыру үдерістері Испытания автомобильных двигателей
Испытания автомобильных двигателей Пара сил и момент силы относительно точки
Пара сил и момент силы относительно точки Світлові кванти
Світлові кванти Подшипники качения
Подшипники качения