Содержание
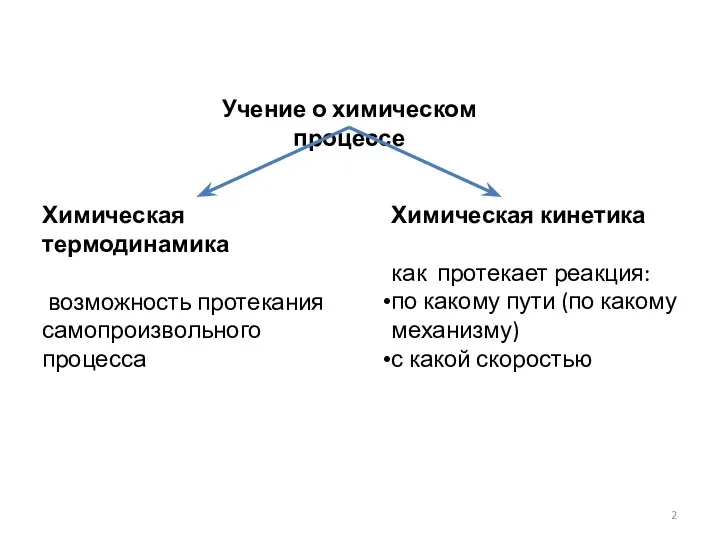
- 2. Учение о химическом процессе Химическая термодинамика возможность протекания самопроизвольного процесса Химическая кинетика как протекает реакция: по
- 3. Как происходит реакция? Реагируют только сталкивающиеся частицы (факт столкновения). Столкновение должно быть результативным («эффективным»), то есть
- 4. В столкновении может принять участие 1, 2 или 3 частицы (4 и больше одновременно – низкая
- 5. Скорость химической реакции υ - число элементарных актов хим. реакции n в единице объема V за
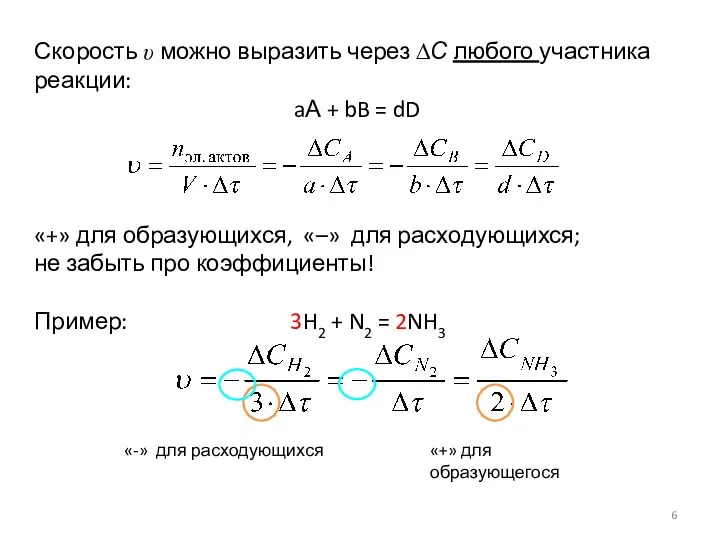
- 6. Скорость υ можно выразить через ∆С любого участника реакции: aА + bB = dD «+» для
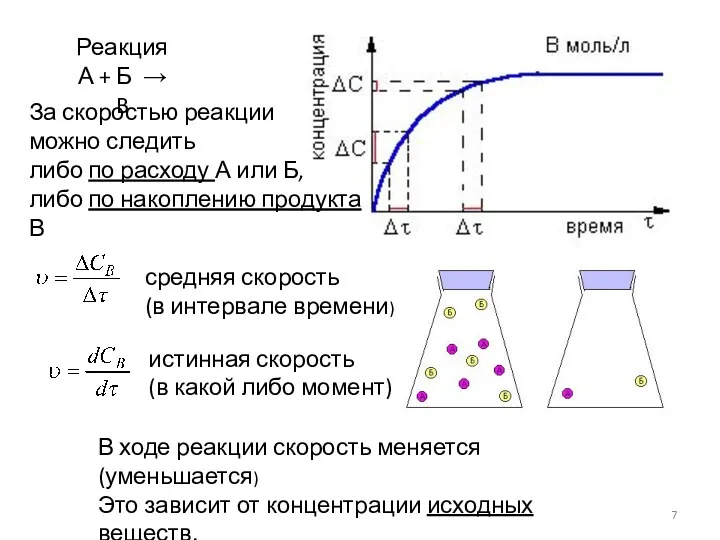
- 7. Реакция А + Б → B За скоростью реакции можно следить либо по расходу А или
- 8. Основной закон химической кинетики для некоторых сложных реакций (состоящих из разных элементарных актов). порядок не всегда
- 9. nA – частный порядок реакции по веществу А, nB – частный порядок по веществу В, (nA
- 10. Для реакции: K2Cr2O7 + 14 HI = 3 I2 + 2 CrI3 + 2 KI +
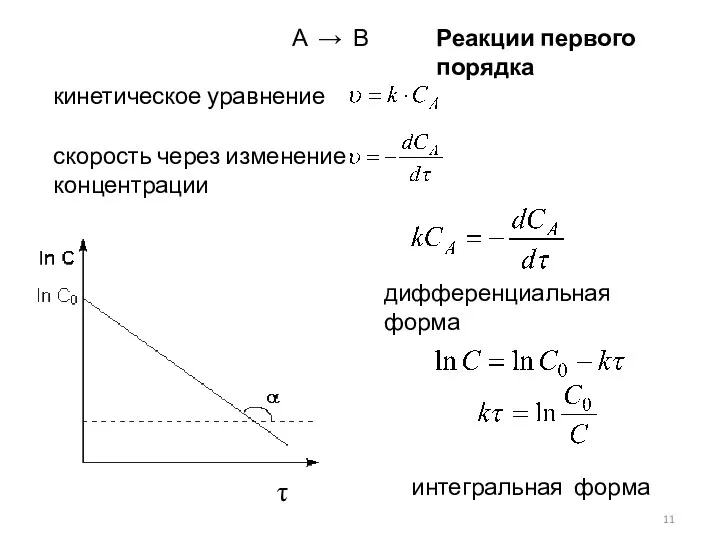
- 11. Реакции первого порядка А → В кинетическое уравнение скорость через изменение концентрации дифференциальная форма интегральная форма
- 12. Константа скорости (первый порядок) Концентрация в момент времени τ после начала реакции (первый порядок) Средняя продолжительность
- 13. Реакции второго порядка А + В → если концентрации исходных веществ одинаковы СА = СВ =
- 14. Константа скорости (второй порядок) Концентрация в момент времени τ после начала реакции (второй порядок) Время полупревращения
- 15. Методы определения порядка реакции только экспериментально! эксперимент: зависимость С от τ (несколько измерений) 1) метод подбора
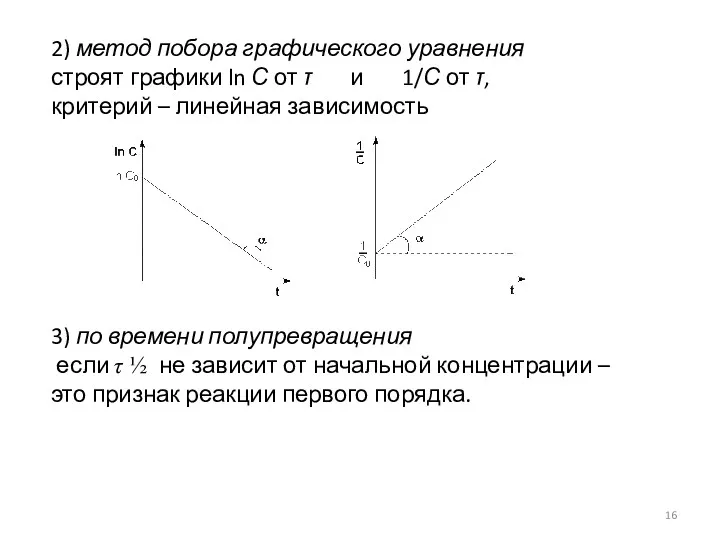
- 16. 2) метод побора графического уравнения строят графики ln С от τ и 1/С от τ, критерий
- 17. Влияние температуры на скорость реакции Правило Вант-Гоффа (эмпирическое): при повышении Т на каждые 10 градусов константа
- 18. Метод ускоренного старения лекарственных веществ (ЛВ) позволяет за 15 – 115 дней при 40 – 70°С
- 19. Теория и уравнение Аррениуса В реакцию вступают молекулы с энергией > Ea. Учитывая распределение молекул по
- 20. Теория активных соударений Развитие и уточнение теории Аррениуса. Рассматривает соударения с учетом массы и размеров частиц
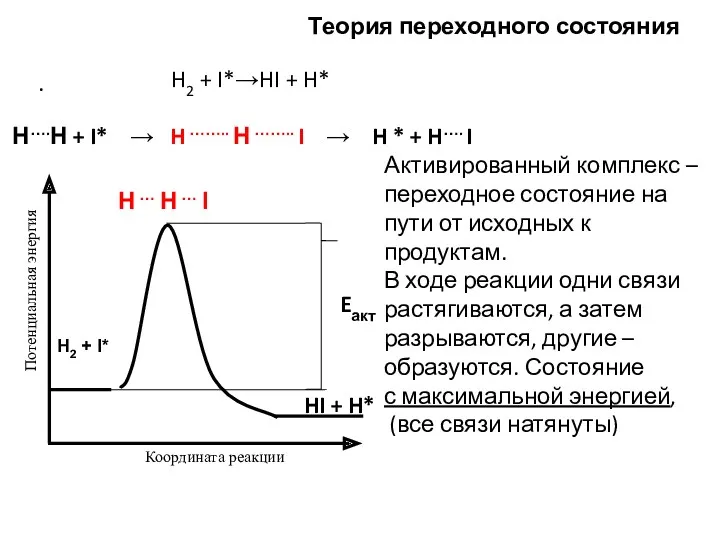
- 21. Активированный комплекс – переходное состояние на пути от исходных к продуктам. В ходе реакции одни связи
- 22. C τ Параллельные реакции Вещество А расходуется по двум направлениям K1 > k2 Сложные реакции –
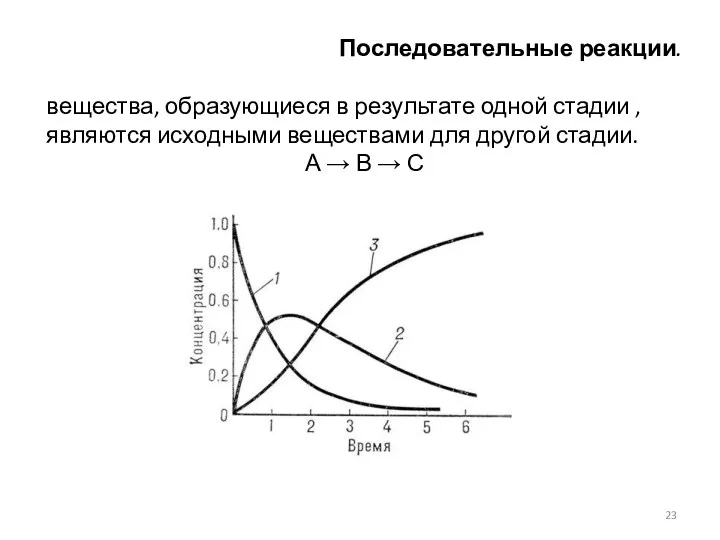
- 23. Последовательные реакции. вещества, образующиеся в результате одной стадии , являются исходными веществами для другой стадии. А
- 24. Сопряженные реакции химические реакции, которые протекают только совместно, причем одна из них неосуществима в отсутствие первой.
- 25. Обратимые реакции химические реакции, протекающие одновременно в двух противоположных направлениях (прямом и обратном) 3H2 + N2
- 26. Цепные реакции реакции, состоящие из ряда взаимосвязанных стадий, когда частицы, образующиеся в результате каждой стадии, генерируют
- 28. Скачать презентацию


















 Механические колебания и волны
Механические колебания и волны Расчет шасси самолета
Расчет шасси самолета Дисперсия света. Интерференция. Применение интерференции. Физика. 11 класс
Дисперсия света. Интерференция. Применение интерференции. Физика. 11 класс Презентация соблюдение техники безопасности в кабинете физики.
Презентация соблюдение техники безопасности в кабинете физики. Эффект Джоуля-Томпсона
Эффект Джоуля-Томпсона Электр кедергілерін анықтау тәсілдері
Электр кедергілерін анықтау тәсілдері Магнитное поле катушки с током. Электромагниты и их применение
Магнитное поле катушки с током. Электромагниты и их применение Механические колебания и их характеристики
Механические колебания и их характеристики Системы крепления концевого инструмента на станках с ЧПУ. Редимные средства
Системы крепления концевого инструмента на станках с ЧПУ. Редимные средства Ремонт автомобилей. Дефектация и сортировка деталей. (Тема 2.3)
Ремонт автомобилей. Дефектация и сортировка деталей. (Тема 2.3) Динамика материальной точки
Динамика материальной точки Электрические цепи постоянного тока. (Лекция 1)
Электрические цепи постоянного тока. (Лекция 1) Основные уравнения электростатики в вакууме. (Лекция 2)
Основные уравнения электростатики в вакууме. (Лекция 2) Физика и лирика
Физика и лирика Presentation about boilers
Presentation about boilers Структура
Структура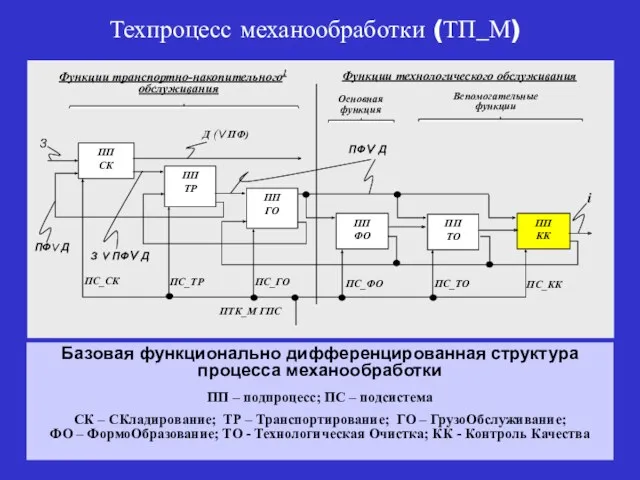 Техпроцесс механообработки
Техпроцесс механообработки Термоэлектрические и термомагнитные явления. Диффузионный ток
Термоэлектрические и термомагнитные явления. Диффузионный ток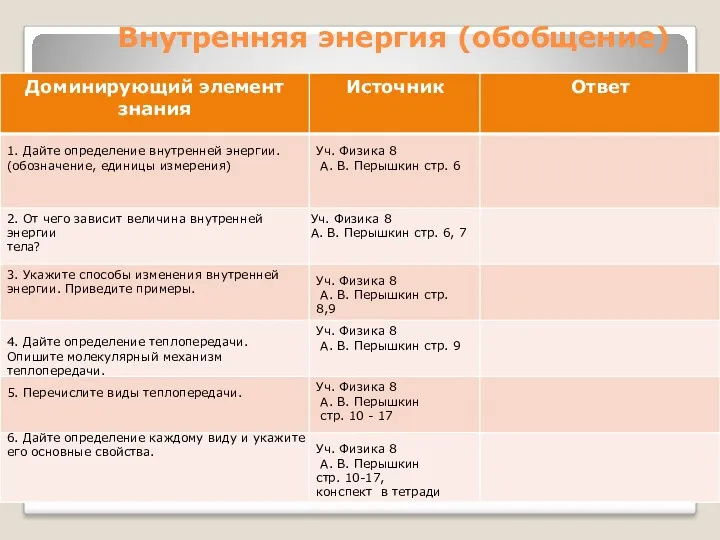 Количество теплоты. Единицы количества теплоты. Удельная теплоемкость. Расчет количества теплоты. 8 класс
Количество теплоты. Единицы количества теплоты. Удельная теплоемкость. Расчет количества теплоты. 8 класс Сила тока. Условия, необходимые для существования электрического тока. Закон Ома для участка цепи
Сила тока. Условия, необходимые для существования электрического тока. Закон Ома для участка цепи Электромагнитное поле
Электромагнитное поле Подшипники скольжения (ПС)
Подшипники скольжения (ПС) Какое движение называют механическим?
Какое движение называют механическим? Ремонт выхлопной системы Ваз-2170. (Часть 2)
Ремонт выхлопной системы Ваз-2170. (Часть 2) Трансмиссия, ее обслуживание и ремонт. Назначение, общее устройство трасмиссии танка, БМП. (Тема 8.1)
Трансмиссия, ее обслуживание и ремонт. Назначение, общее устройство трасмиссии танка, БМП. (Тема 8.1) Изгиб с кручением круглых стержней в конструкциях различных механизмов
Изгиб с кручением круглых стержней в конструкциях различных механизмов Подготовка к ЕГЭ по физике. 10,11 класс.
Подготовка к ЕГЭ по физике. 10,11 класс. Энергия связи ядра. Дефект масс. 9 класс
Энергия связи ядра. Дефект масс. 9 класс