Содержание
- 2. Демокрит (древнегреческий ученый)- введено понятие атома Душа тоже состоит из атомов
- 3. Начало ХХ века 1833 год Фарадеем был определен заряд электрона 1869 система элементов Менделеева 1885 –
- 4. Атомы имеют сложное строение Атомы электрически нейтральны Основная масса атома приходится на его положительный заряд
- 5. Модель атома Томсона
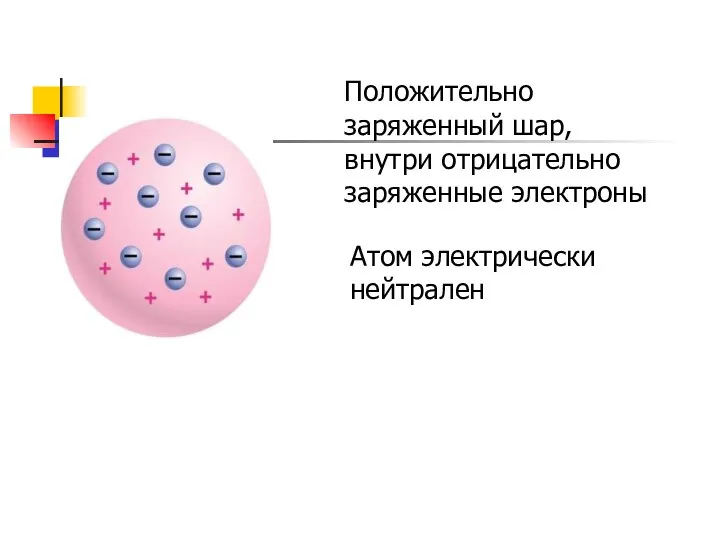
- 6. Положительно заряженный шар, внутри отрицательно заряженные электроны Атом электрически нейтрален
- 7. Атом Резерфорда - Бора
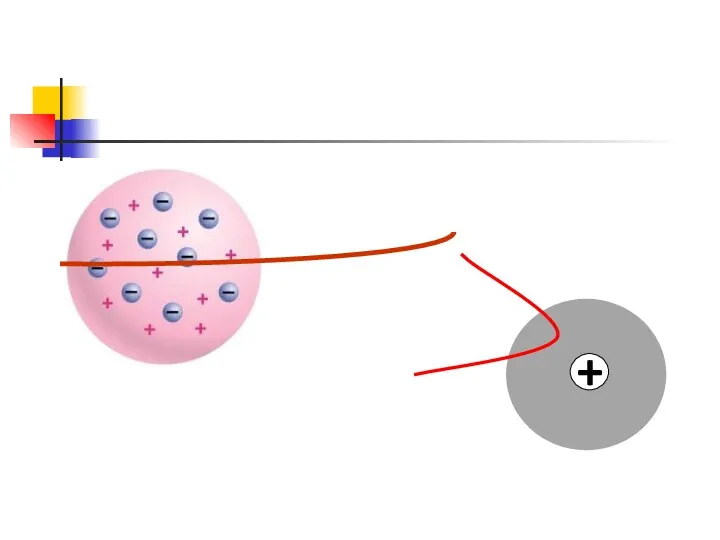
- 8. Опыты по рассеянию частиц на тонких металлических пластинках Рассеянные частицы попадали на экран, покрытый сульфидом цинка
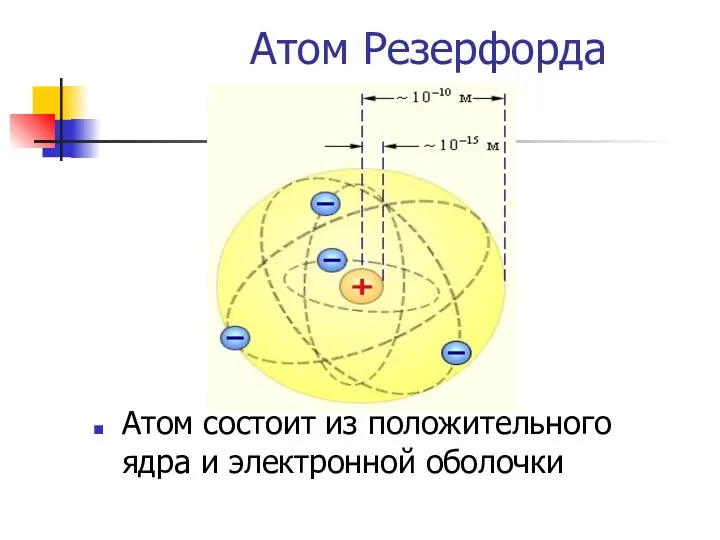
- 10. Атом Резерфорда Атом состоит из положительного ядра и электронной оболочки
- 12. Противоречие с классической электродинамикой Электроны двигаются по круговым орбитам Радиус орбиты может быть любой – спектр
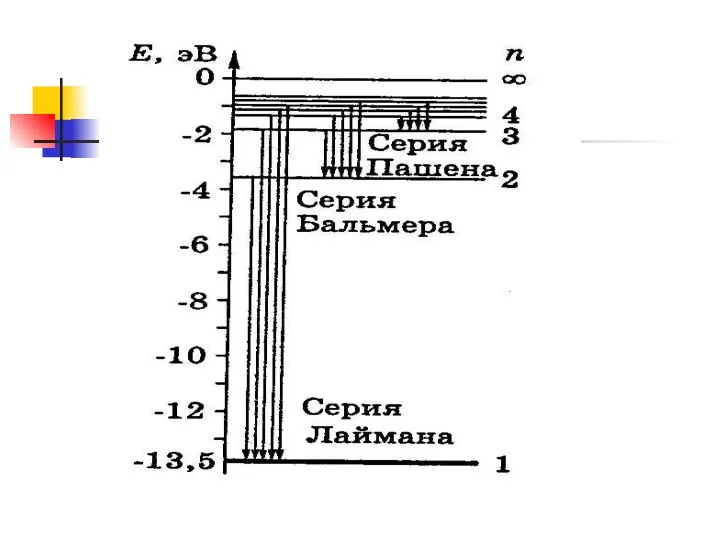
- 13. Спектральные закономерности Спектр отдельного атома – линейчатый Спектральные линии образуют серии Для атомарного водорода Формула Бальмера
- 14. частота, соответствующая каждой спектральной линии Постоянная Ридберга
- 15. Серия Лаймана (ультрафиолетовая часть спектра) Серия Пашена (инфракрасная часть спектра)
- 16. Серия Брекета Серия Пфунда
- 17. Постулаты Бора В атоме существуют стационарные состояния, в которых он не излучает энергии. Эти состояния характеризуются
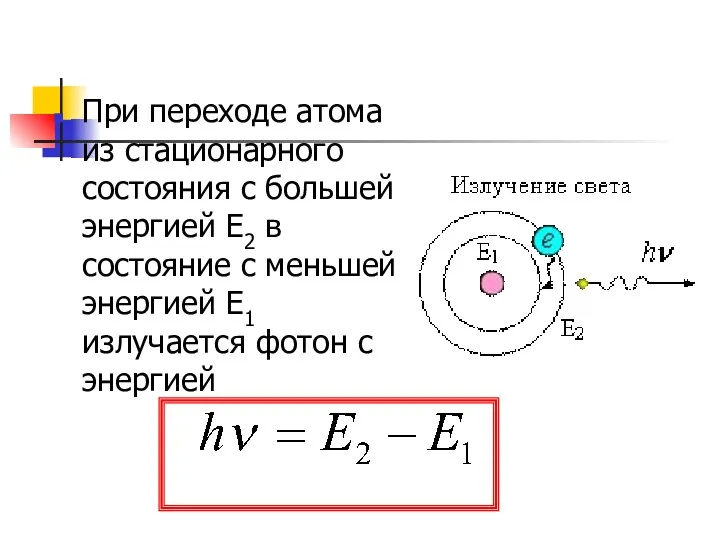
- 18. При переходе атома из стационарного состояния с большей энергией Е2 в состояние с меньшей энергией Е1
- 19. На длине орбиты должно укладываться целое число длин волн электрона Боровская модель атома водорода , ,
- 20. Электрон в атоме движется по орбитам , для которых момент импульса может принимать значения n -
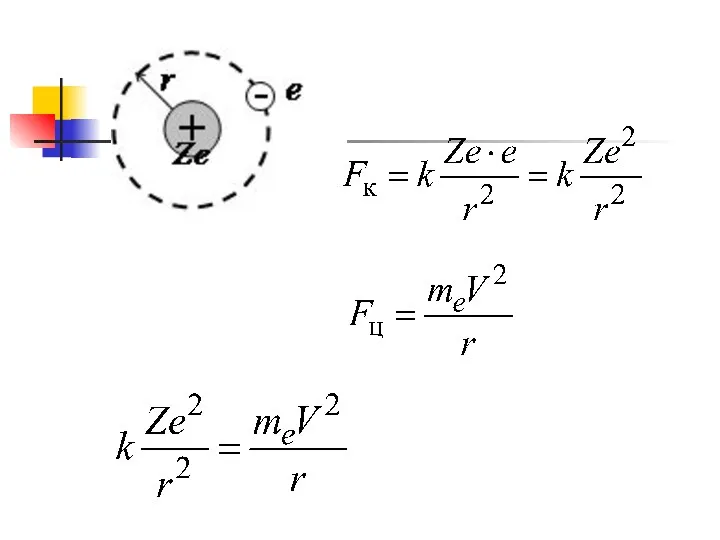
- 21. Рассмотрим водородно подобные системы (Н, ион Не, ион Li ) Заряд ядра (Z·e) e – заряд
- 23. Энергия электрона на стационарной орбите
- 25. n =1 – основное состояние энергия связи электрона – необходимо сообщить электрону, чтобы удалить его из
- 26. При переходе атома из одного состояния в другое излучается энергия
- 27. - постоянная Ридберга - частота излучения при переходе с орбиты с номером n на орбиту с
- 29. ЭЛЕМЕНТЫ КВАНТОВОЙ МЕХАНИКИ
- 30. Корпускулярно-волновой дуализм С каждым объектом связаны корпускулярные характеристики(E ,P) и волновые (λ,ω)
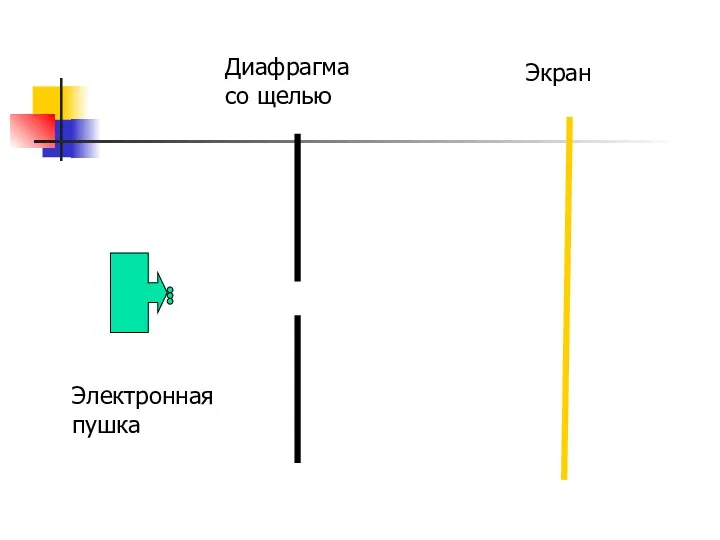
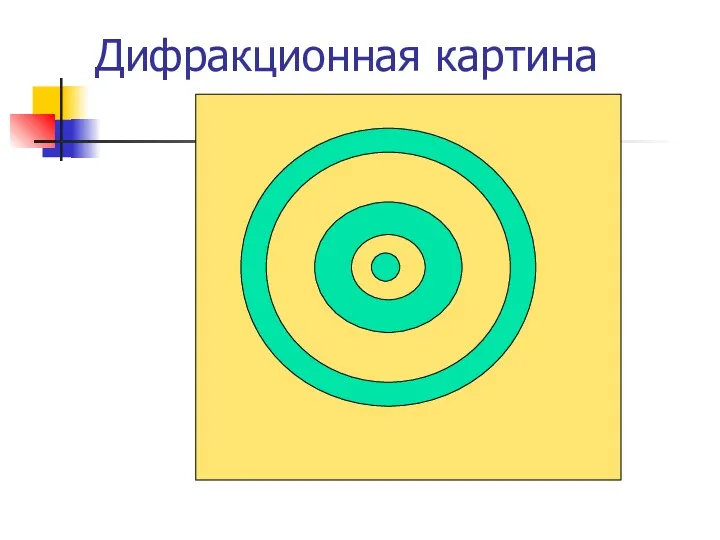
- 31. Опыт Фабриканта Электронная пушка стреляет по одному электрону, а на экране наблюдается дифракционная картина
- 32. Электронная пушка Диафрагма со щелью Экран
- 33. Дифракционная картина
- 35. Скачать презентацию















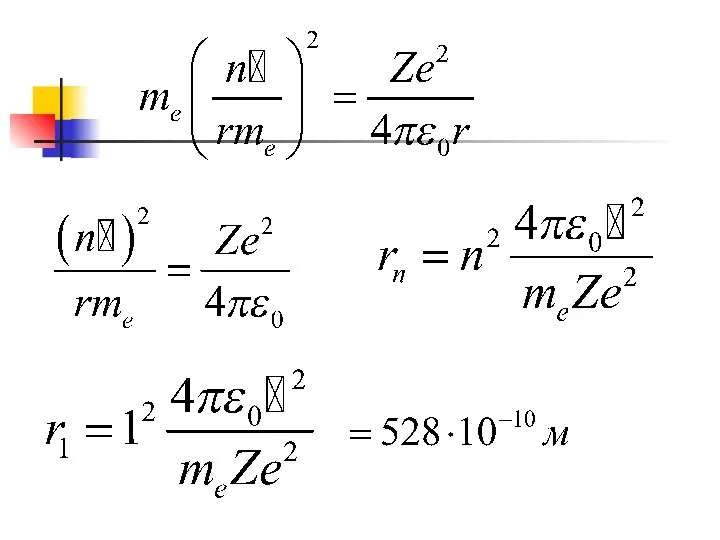








 Теплопроводность. Нестационарная теплопроводность. (Тема 4. Лекции 16,17)
Теплопроводность. Нестационарная теплопроводность. (Тема 4. Лекции 16,17) Теплові двигуни
Теплові двигуни Физико-технические основы электроэнергетики. Лекция 10
Физико-технические основы электроэнергетики. Лекция 10 Работа и энергия. Механическая работа. Мощность
Работа и энергия. Механическая работа. Мощность Линзы. Построение изображений, даваемых линзой.
Линзы. Построение изображений, даваемых линзой. Курс физики
Курс физики Первый искусственный спутник Земли
Первый искусственный спутник Земли Принцип неопределённости Гейзенберга 1927
Принцип неопределённости Гейзенберга 1927 Распространяющиеся в пространстве возмущения электромагнитного поля
Распространяющиеся в пространстве возмущения электромагнитного поля Презентация к уроку физики Электрический ток. Источники тока
Презентация к уроку физики Электрический ток. Источники тока Геоцентрическая система мира
Геоцентрическая система мира Прямой чистый изгиб. Поперечный плоский изгиб
Прямой чистый изгиб. Поперечный плоский изгиб Камера-обскура. Интересные факты
Камера-обскура. Интересные факты магнитные явления
магнитные явления Haemodynamics Haemorheology
Haemodynamics Haemorheology Электрическое освещение. Лекция 3
Электрическое освещение. Лекция 3 Деление ядер урана. Цепные ядерные реакции
Деление ядер урана. Цепные ядерные реакции Физические основы высоких технологий. (Колебания и волны)
Физические основы высоких технологий. (Колебания и волны) Электрический заряд. Дискретность электрического заряда
Электрический заряд. Дискретность электрического заряда Колесо с резиновыми спицами
Колесо с резиновыми спицами Силы в природе (7 класс)
Силы в природе (7 класс) Теория автоматического управления
Теория автоматического управления Физика Солнца
Физика Солнца Основные требования и допуски при финальной сборке. Виды и методики измерения
Основные требования и допуски при финальной сборке. Виды и методики измерения Физические явления
Физические явления Напряженно-деформированное состояние в точке
Напряженно-деформированное состояние в точке Средства механизации строительства
Средства механизации строительства Диэлектриктер. Диэлектриктердің қасиеттері
Диэлектриктер. Диэлектриктердің қасиеттері