Содержание
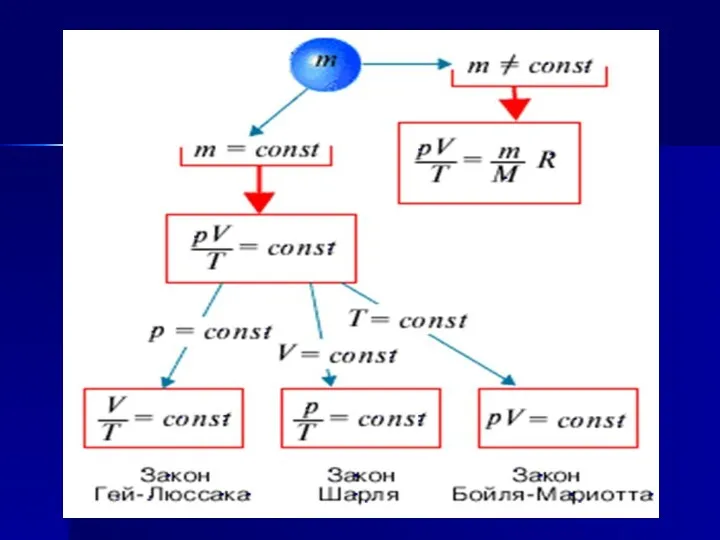
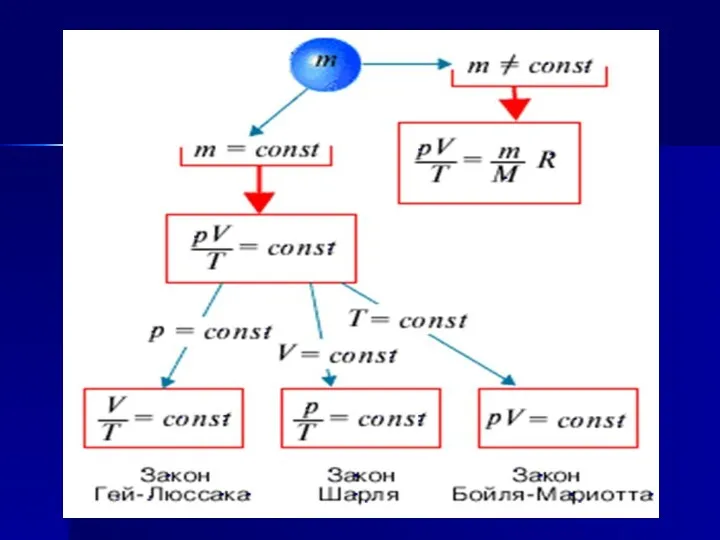
- 2. Газовые законы - Количественные зависимости между двумя параметрами газа одной и той же массы при неизменном
- 3. Единый план изучения газовых законов Определение и условия осуществления процесса. Уравнение и формулировка закона. Историческая справка.
- 4. Уравнение Менделеева-Клапейрона Уравнение состояния идеального газа
- 6. Это стоит запомнить! Процессы в газах, при которых один из параметров остается постоянным, называются изопроцессами
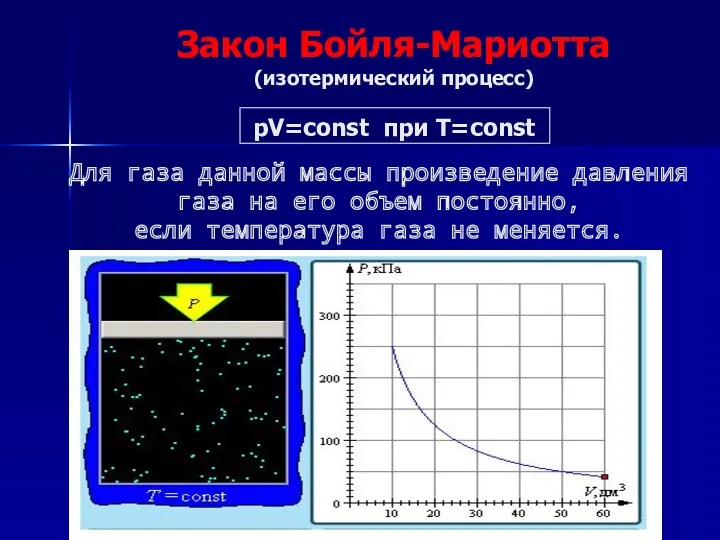
- 7. Закон Бойля-Мариотта (изотермический процесс) pV=const при T=const Для газа данной массы произведение давления газа на его
- 8. Закон Бойля-Мариотта При постоянной температуре давление данной массы газа обратно пропорционально его объёму. В таком виде
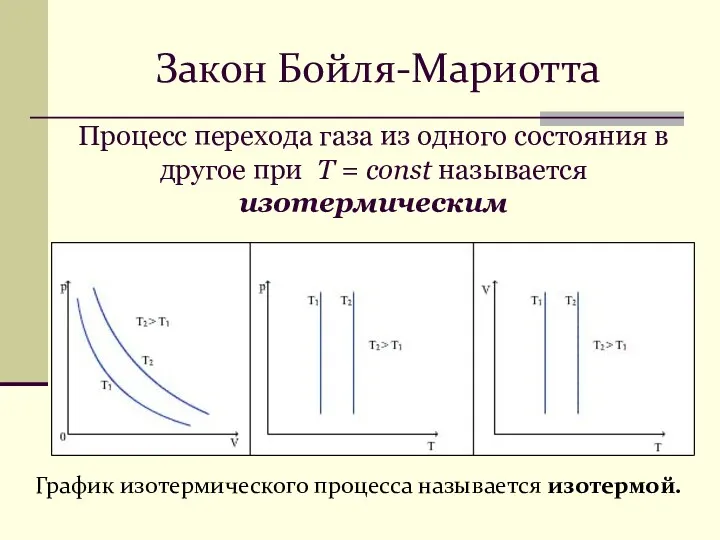
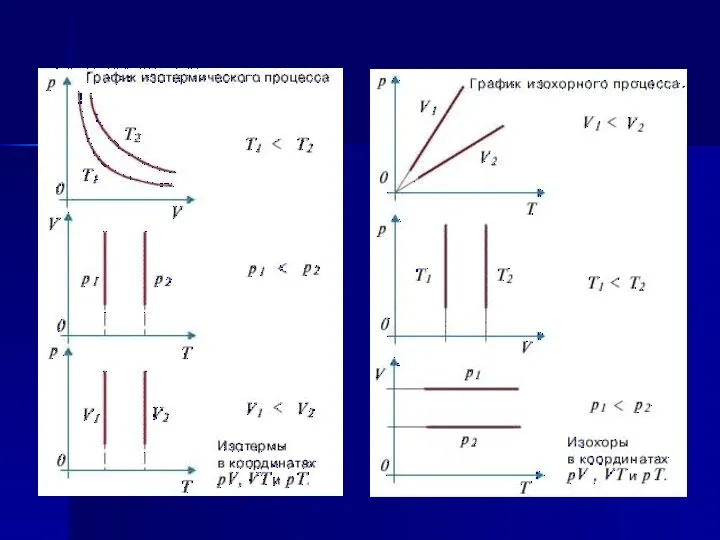
- 9. Процесс перехода газа из одного состояния в другое при Т = const называется изотермическим График изотермического
- 10. в 1662 г. Р. Бойлем; в 1676 г. Э. Мариоттом Роберт Бойль Закон Бойля-Мариотта Эдм Мариотт
- 11. История открытия История открытия его весьма поучительна. Франциск Лин (Franciscus Linus), профессор математики в Люттихе (1
- 12. Закон Бойля-Мариотта на практике Убедиться в справедливости закона Бойля-Мариотта можно с помощью прибора, изображенного на рисунке.
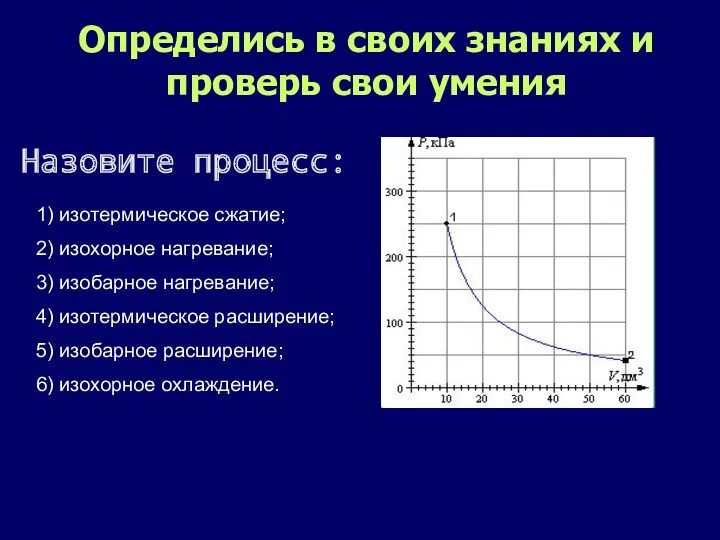
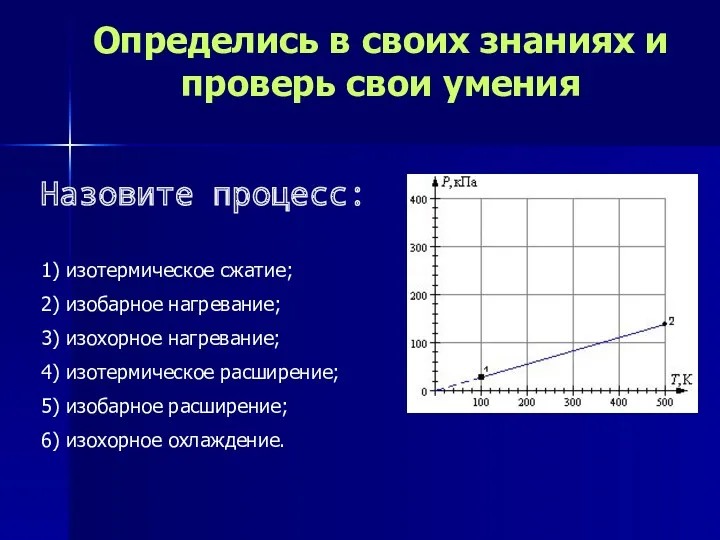
- 13. Определись в своих знаниях и проверь свои умения 1) изотермическое сжатие; 2) изохорное нагревание; 3) изобарное
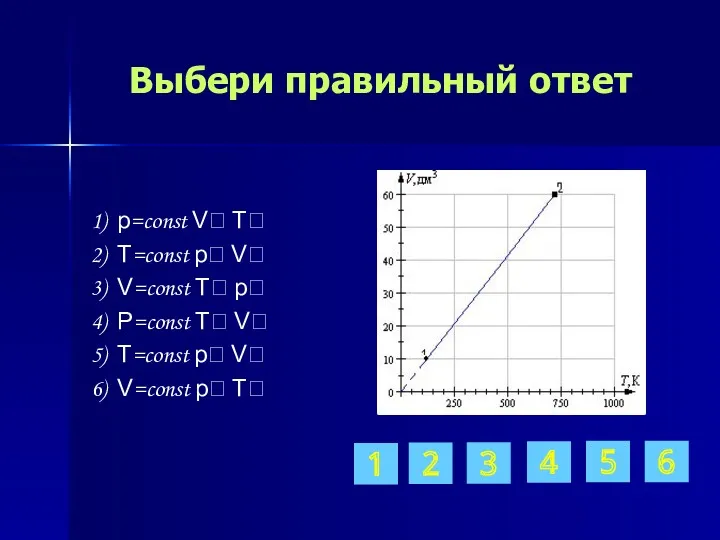
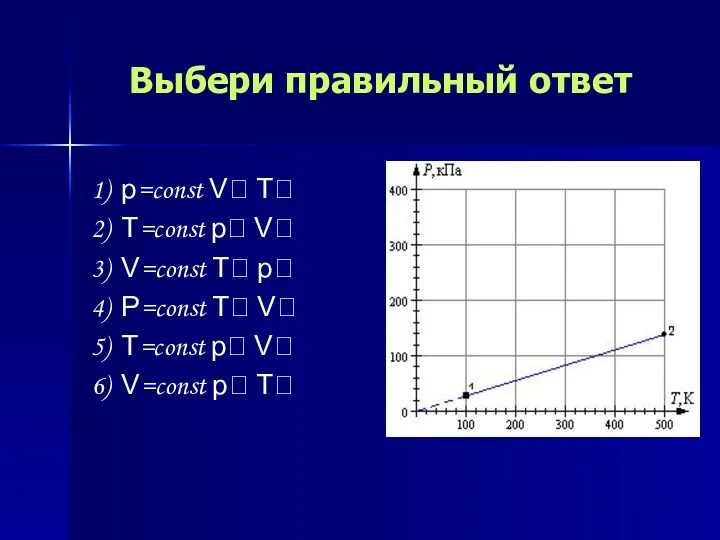
- 14. Выбери правильный ответ 1) p=const V T 2) T=const p V 3) V=const T p 4)
- 15. Реши задачу Воздух под поршнем насоса имеет давление 105 Па и объем 260 см3. При каком
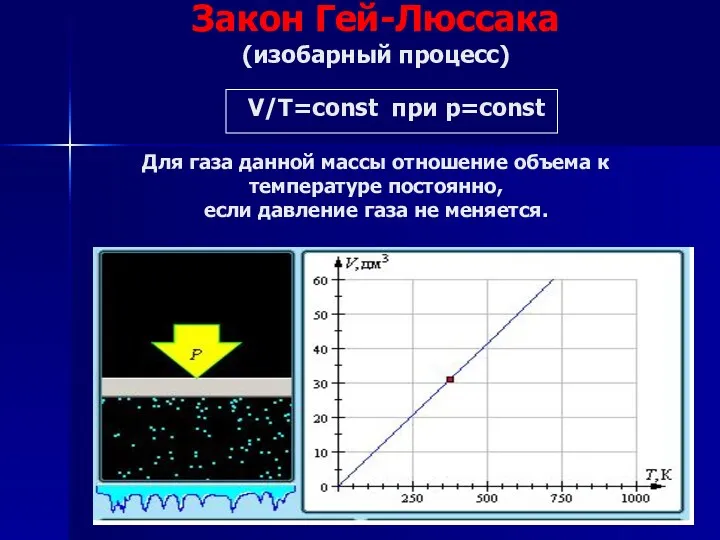
- 16. Закон Гей-Люссака (изобарный процесс) V/Т=const при р=const Для газа данной массы отношение объема к температуре постоянно,
- 17. Закон Гей - Люссака Жозеф Луи Гей-Люссак в 1802 г. Французский химик и физик, член АН
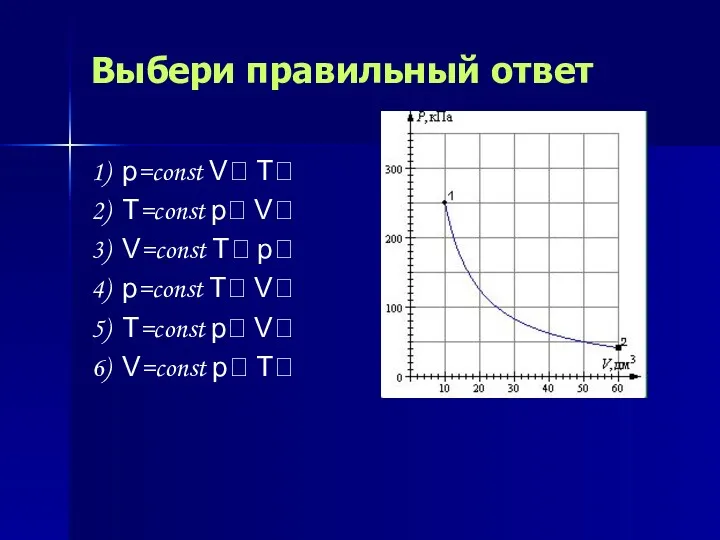
- 18. Закон Гей - Люссака Объем данной массы газа при постоянном давлении прямопропорционален температуре. V0- объем, занимаемый
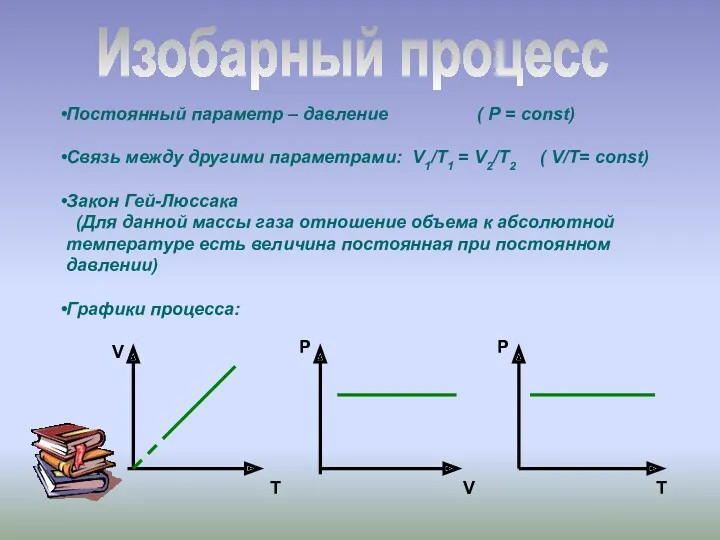
- 19. График изобарного процесса называется изобарой. Процесс перехода газа из одного состояния в другое при Р =
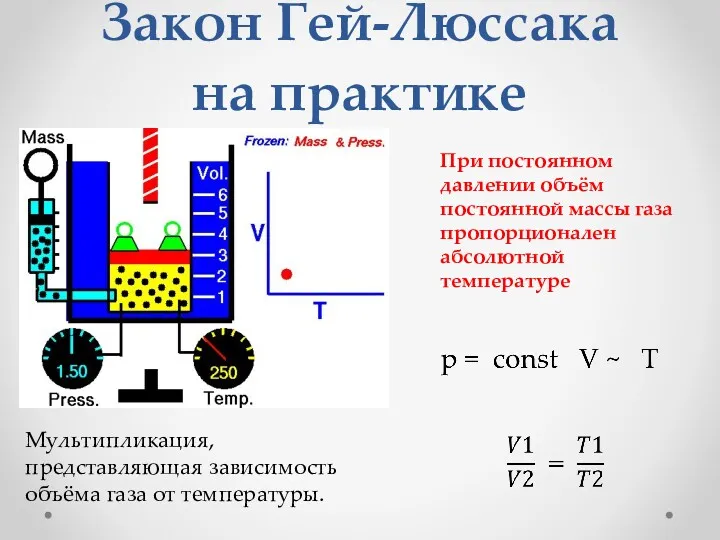
- 20. Закон Гей-Люссака на практике Мультипликация, представляющая зависимость объёма газа от температуры. При постоянном давлении объём постоянной
- 21. История открытия Гей-Люссак открыл закон чисто опытным путем. Он не стремился при выводе этого закона изучить
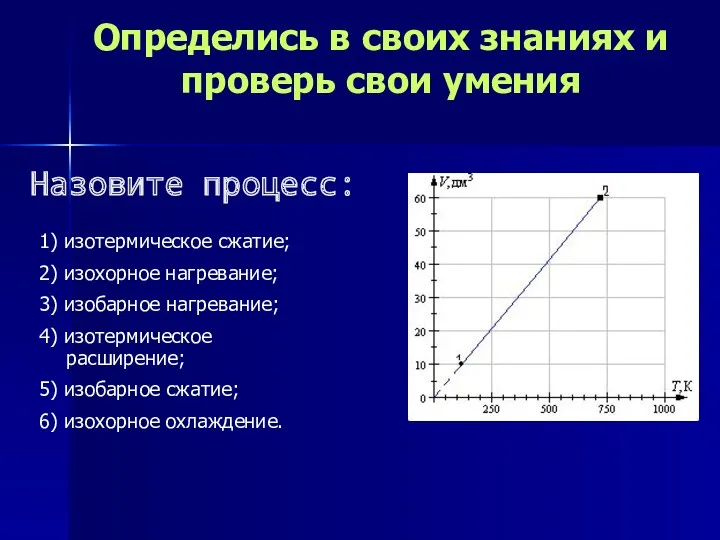
- 22. Определись в своих знаниях и проверь свои умения 1) изотермическое сжатие; 2) изохорное нагревание; 3) изобарное
- 23. Выбери правильный ответ 1) p=const V T 2) T=const p V 3) V=const T p 4)
- 24. Реши задачу Газ занимает объём 2м3 при температуре 2730С. Каков будет его объём при температуре 5460С
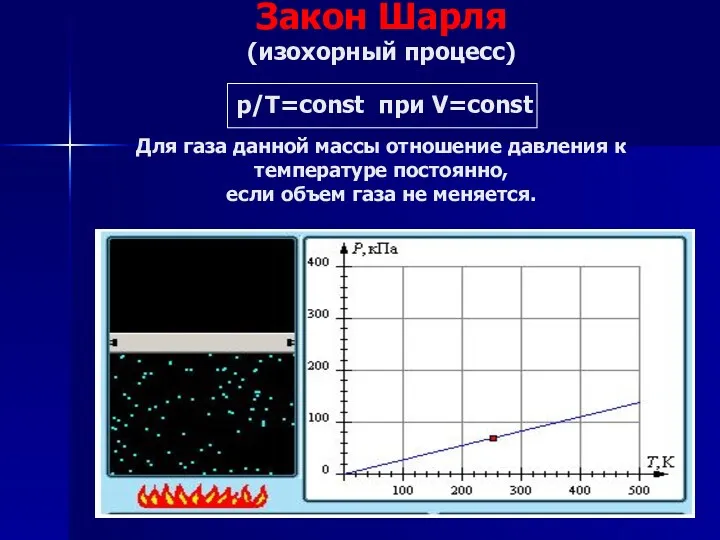
- 25. Закон Шарля (изохорный процесс) р/Т=const при V=const Для газа данной массы отношение давления к температуре постоянно,
- 26. Закон Шарля Р0- давление газа при температуре 0 °С; α – температурный коэффициент давления Давление данной
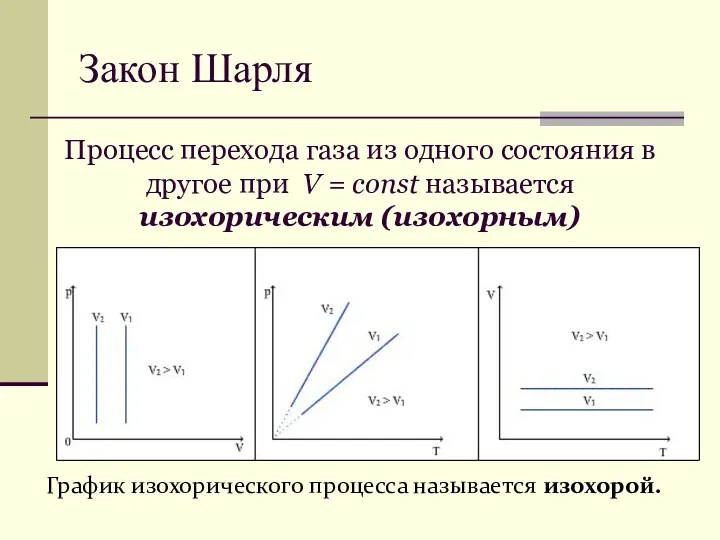
- 27. Закон Шарля График изохорического процесса называется изохорой. Процесс перехода газа из одного состояния в другое при
- 28. История открытия Когда стали известны опыты Б.Франклина с молнией, Шарль повторил их с изменениями - настолько
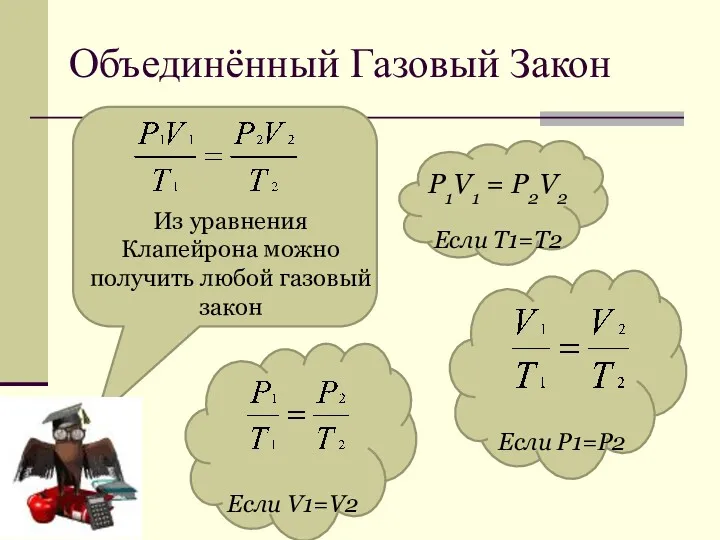
- 29. Объединённый Газовый Закон
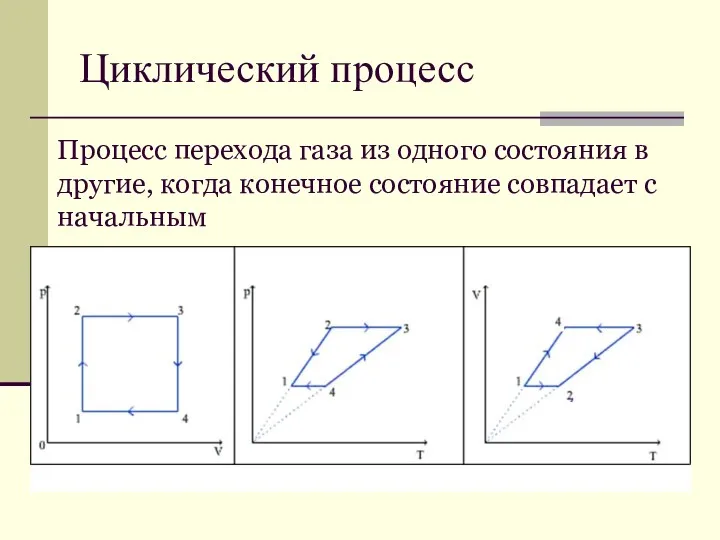
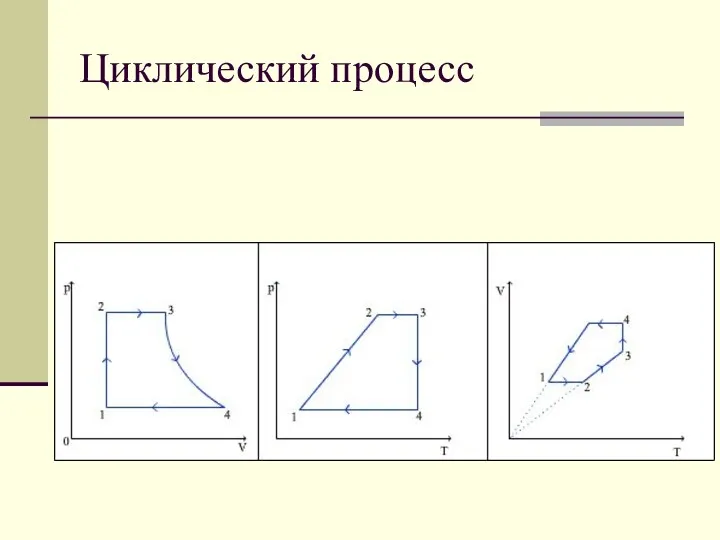
- 31. Циклический процесс Процесс перехода газа из одного состояния в другие, когда конечное состояние совпадает с начальным
- 32. Циклический процесс
- 33. Закон Дальтона: Давление смеси химически не взаимодействующих идеальных газов равно сумме парциальных давлений.
- 34. Закон Дальтона Закон Дальтона- это физический закон, определяющий давление и растворимость смеси газов. Сформулированы Джоном Дальтоном
- 35. История открытия Закон сложения парциальных давлений был сформулирован в 1801 году. При этом правильное теоретическое обоснование,
- 36. Закон Дальтона на практике Поместим в бутылку закупоренную пробирку с эфиром. Бутылку закроем пробкой со стеклянной
- 37. Определись в своих знаниях и проверь свои умения 1) изотермическое сжатие; 2) изобарное нагревание; 3) изохорное
- 38. Выбери правильный ответ 1) p=const V T 2) T=const p V 3) V=const T p 4)
- 39. Реши задачу Газ находится в баллоне при температуре 288 К и давлении 1,8 МПа. При какой
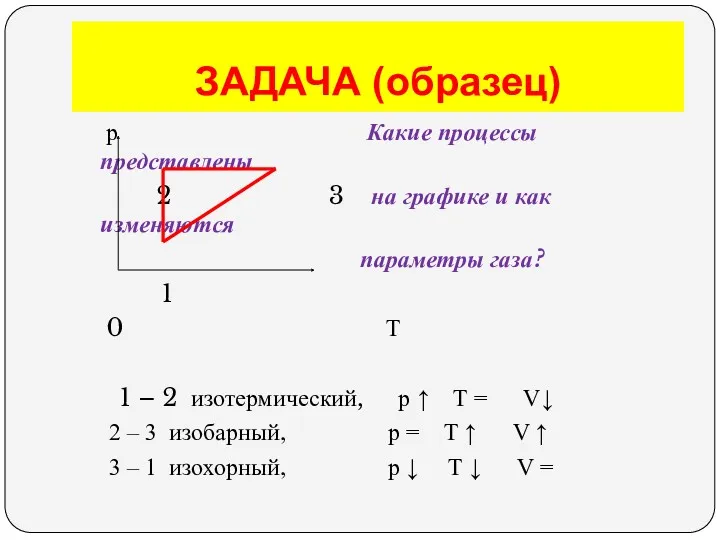
- 40. ЗАДАЧА (образец) р Какие процессы представлены 2 3 на графике и как изменяются параметры газа? 1
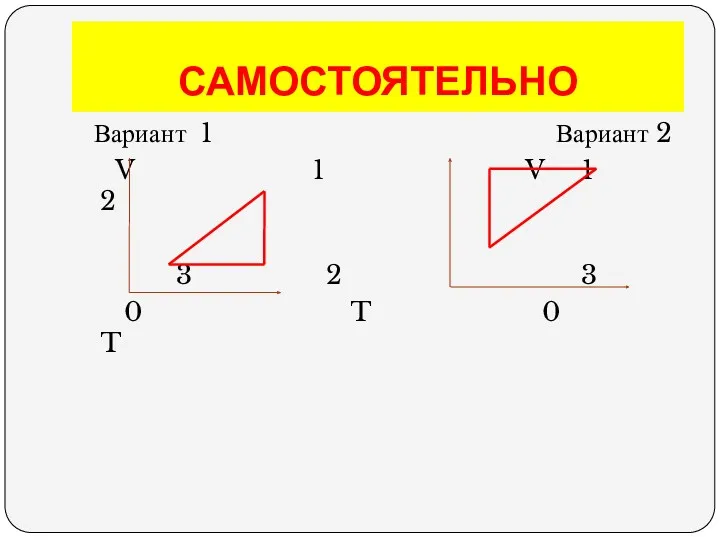
- 41. САМОСТОЯТЕЛЬНО Вариант 1 Вариант 2 V 1 V 1 2 3 2 3 0 T 0
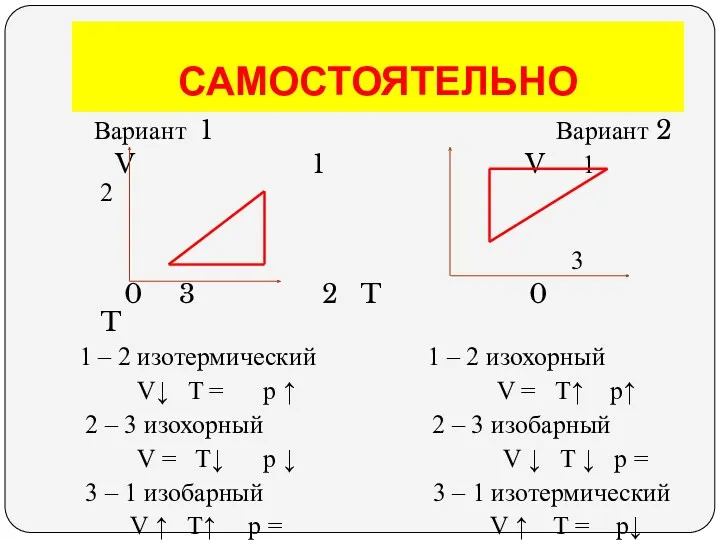
- 42. САМОСТОЯТЕЛЬНО Вариант 1 Вариант 2 V 1 V 1 2 3 0 3 2 T 0
- 45. Давайте повторим!
- 46. Изотермический процесс Постоянный параметр – температура (Т = const) Связь между другими параметрами: P1V1 = P2V2
- 47. Изобарный процесс Постоянный параметр – давление ( Р = const) Связь между другими параметрами: V1/Т1 =
- 48. Изохорный процесс Постоянный параметр – объем ( V = const) Связь между другими параметрами: P1/Т1 =
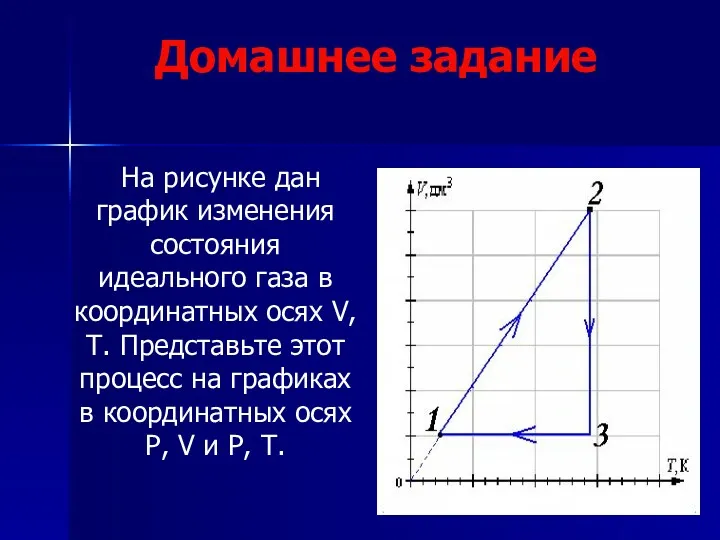
- 49. Домашнее задание На рисунке дан график изменения состояния идеального газа в координатных осях V, T. Представьте
- 51. Скачать презентацию

























 Сборка модели электролизера для получения водорода
Сборка модели электролизера для получения водорода Никола Тесла
Никола Тесла Интерференция при отражении от тонких пластинок
Интерференция при отражении от тонких пластинок Равноускоренное движение
Равноускоренное движение Электростатика. Закон сохранения электрического заряда. Закон Кулона
Электростатика. Закон сохранения электрического заряда. Закон Кулона Выталкивающая сила. Решение задач. 7 класс
Выталкивающая сила. Решение задач. 7 класс Кроссворд по физике по теме: Электричество
Кроссворд по физике по теме: Электричество Законы автоматического регулирования
Законы автоматического регулирования Молекулярная физика. Тепловые явления. Уравнение состояния идеального газа. Газовые законы
Молекулярная физика. Тепловые явления. Уравнение состояния идеального газа. Газовые законы Молекулярная спектроскопия при исследовании объектов СПТЭ
Молекулярная спектроскопия при исследовании объектов СПТЭ Общие сведения о зубчатых передачах
Общие сведения о зубчатых передачах Фазированные антенные решетки и их назначение. Влияние ФАР на широкополосный сигнал
Фазированные антенные решетки и их назначение. Влияние ФАР на широкополосный сигнал Контроль технического состояния воздушных судов в полете. Тема 6.2
Контроль технического состояния воздушных судов в полете. Тема 6.2 Превращение одного вида энергии в другой
Превращение одного вида энергии в другой Вечный двигатель
Вечный двигатель Залежність фізичних властивостей речовин від типів кристалічніх граток
Залежність фізичних властивостей речовин від типів кристалічніх граток Электростатика. Закон Кулона
Электростатика. Закон Кулона Эксплуатация планера самолета Миг - 29 (тема 2.5)
Эксплуатация планера самолета Миг - 29 (тема 2.5) “Перемещение”
“Перемещение” Що називається посадкою
Що називається посадкою Волновая оптика. Интерференция и дифракция
Волновая оптика. Интерференция и дифракция Золотое правило механики. 7 класс
Золотое правило механики. 7 класс Виштовхувальна сила. Закон Архімеда
Виштовхувальна сила. Закон Архімеда Тематический тест Названия и символы химических элементов ПСХЭ Д.И. Менделеева. 1-20
Тематический тест Названия и символы химических элементов ПСХЭ Д.И. Менделеева. 1-20 Законы физики в музыке
Законы физики в музыке Материя. Современная наука о строении материи
Материя. Современная наука о строении материи Alternating current. (Lecture 3)
Alternating current. (Lecture 3) Изучение прецессии гироскопа
Изучение прецессии гироскопа