Содержание
- 2. 1. Основные понятия и определения молекулярной физики и термодинамики Совокупность большого числа частиц(атомов, молекул), составляющих макроскопическую
- 3. Равновесной, называется такая система, параметры состояния которой одинаковы во всех точках системы и не изменяются со
- 4. Процесс – переход из одного равновесного состояния в другое. Релаксация – возвращение системы в равновесное состояние.
- 5. Идеальный газ – это газ для которого: 1) радиус взаимодействия двух молекул много меньше среднего расстояния
- 6. Давление. Основное уравнение молекулярно-кинетической теории Рассмотрим подробнее, что представляет собой один из основных параметров состояния –
- 7. Определим давление, как силу, действующую в единицу времени на единицу площади: Молекулы имеют разные скорости, направленные
- 8. Под скоростью необходимо понимать среднеквадратичную скорость Вектор скорости, направленный произвольно в пространстве, можно разделить на три
- 9. Следовательно, на другие стенки будет точно такое же давление. Тогда можно записать в общем случае: где
- 10. Единицы измерения давления. По определению, поэтому размерность давления 1 Н/м2 = 1Па; 1 атм.= 9,8 Н/см2
- 11. Законы идеальных газов В XVII – XIX веках были сформулированы опытные законы идеальных газов Изопроцессы идеального
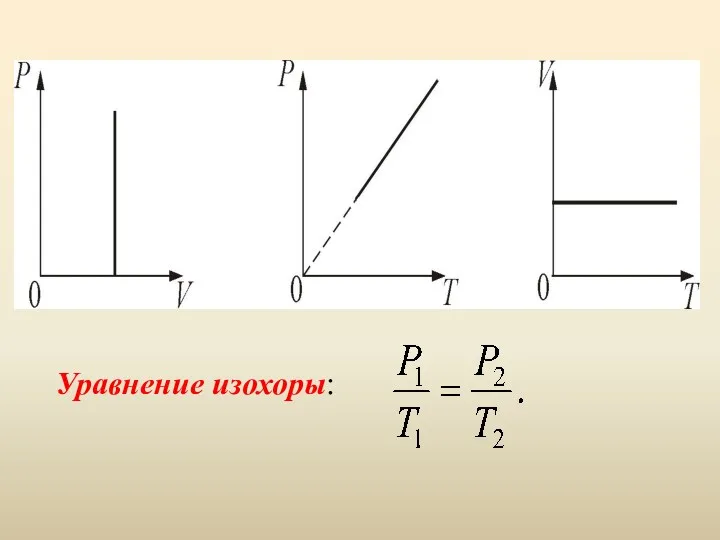
- 12. 1.Изохорический процесс. V = const. Изохорическим процессом называется процесс, протекающий при постоянном объёме V. Поведение газа
- 13. Уравнение изохоры:
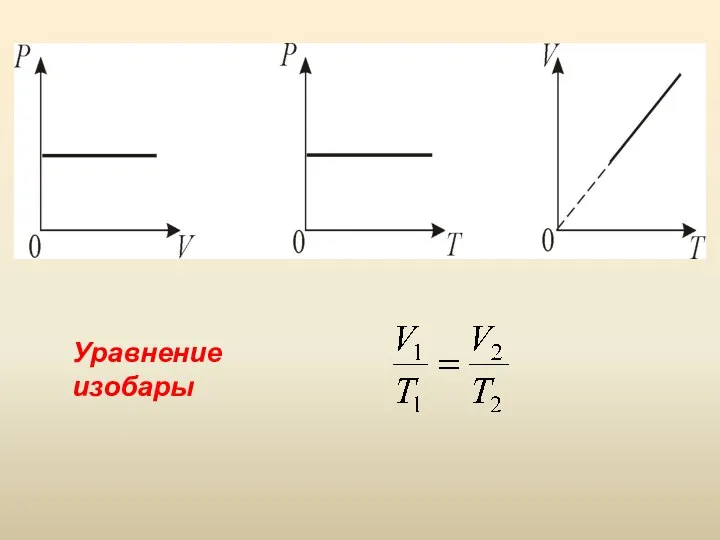
- 14. 2. Изобарический процесс. Р = const. Изобарическим процессом называется процесс, протекающий при постоянном давлении Р. Поведение
- 15. Уравнение изобары
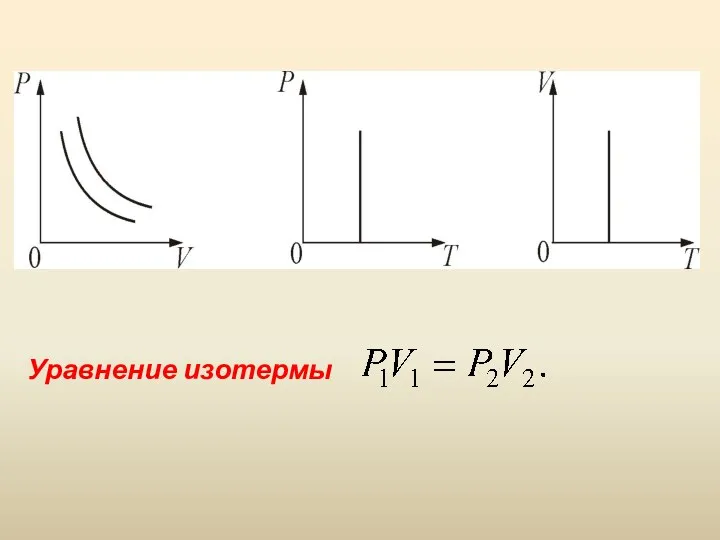
- 16. 3. Изотермический процесс. T = const. Изотермическим процессом называется процесс, протекающий при постоянной температуре Т. Поведение
- 17. Уравнение изотермы
- 18. 4. Адиабатический процесс (изоэнтропийный). Процесс, происходящий без теплообмена с окружающей средой. 5. Политропический процесс. Процесс, при
- 19. Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона) Идеальным газом называют газ, молекулы которого пренебрежимо малы, по сравнению
- 20. Менделеев объединил известные нам законы Бойля-Мариотта, Гей-Люссака и Шарля с законом Авогадро. Уравнение, связывающее все эти
- 21. Ещё в XIX веке Дж. Максвелл утверждал, что молекулы, беспорядочно сталкиваясь друг с другом, как-то «распределяются»
- 22. Молекулы движутся хаотически. Среди них есть и очень быстрые, и очень медленные. Благодаря беспорядочному движению и
- 23. Распределение молекул идеального газа по скоростям впервые было получено знаменитым английским ученым Дж. Максвеллом в 1860
- 24. Скорость – векторная величина. Для проекции скорости на ось х , имеем
- 25. закон Максвелла – распределение молекул по абсолютным значениям скоростей: где – доля всех частиц единичного объёма,
- 26. Здесь – функция распределения молекул по скоростям, - интервал значений скоростей., Физический смысл f(υ) в том,
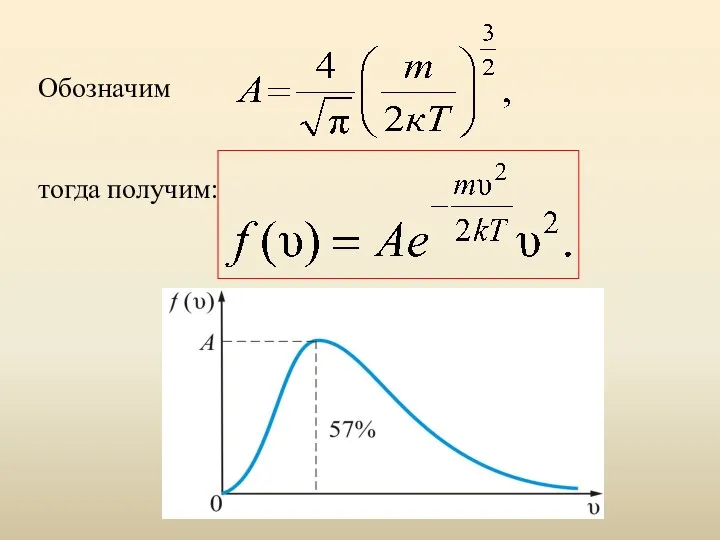
- 27. При получаем плотность вероятности, или функцию распределения молекул по скоростям: Эта функция обозначает долю молекул единичного
- 28. Обозначим тогда получим:
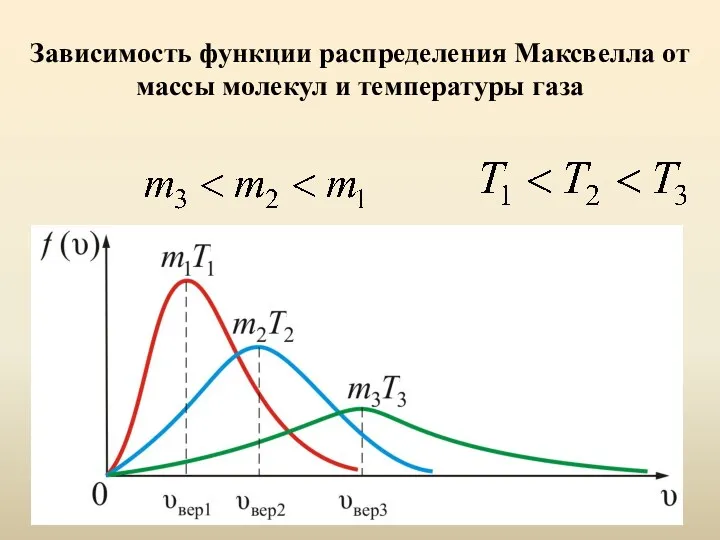
- 29. Выводы: - Вид распределения молекул газа по скоростям, для каждого газа зависит от массы m и
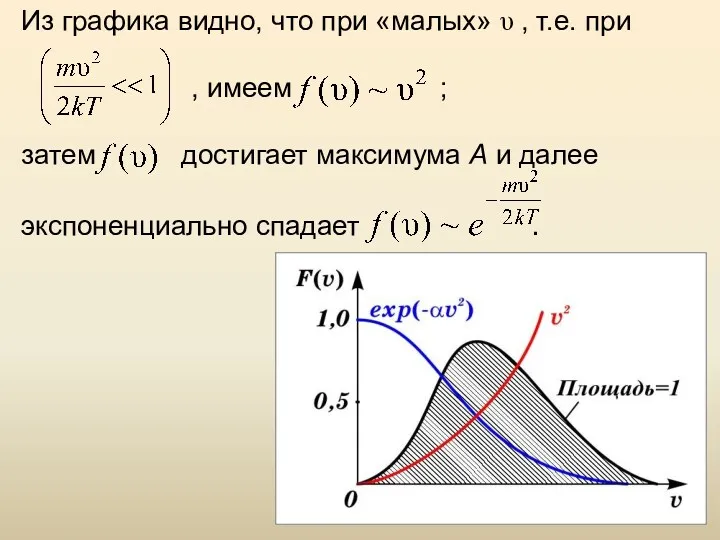
- 30. Из графика видно, что при «малых» υ , т.е. при , имеем ; затем достигает максимума
- 31. Величина скорости, на которую приходится максимум зависимости называют наиболее вероятной скоростью. Величину этой скорости найдем из
- 32. Зависимость функции распределения Максвелла от массы молекул и температуры газа
- 33. Площадь под кривой величина постоянная, равная единице ( ), поэтому важно знать как будет изменяться положение
- 34. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ Внутренняя энергия. Работа и теплота 2.Теплоёмкость идеального газа. Уравнение Майера 3. Теплоёмкости одноатомных
- 35. 1. Внутренняя энергия. Работа и теплота Наряду с механической энергией любое тело (или система) обладает внутренней
- 36. В термодинамических процессах изменяется только кинетическая энергия движущихся молекул (тепловой энергии недостаточно, чтобы изменить строение атома,
- 37. Внутренняя энергия U одного моля идеального газа равна: Таким образом, внутренняя энергия зависит только от температуры.
- 38. Понятно, что в общем случае термодинамическая система может обладать как внутренней, так и механической энергией и
- 39. Количество теплоты, сообщаемой телу, идёт на увеличение внутренней энергии и на совершение телом работы: – это
- 40. 2. Теплоёмкость идеального газа Теплоёмкость тела характеризуется количеством теплоты, необходимой для нагревания этого тела на один
- 41. Удельная теплоёмкость Суд – количество теплоты, необходимое для нагревания единицы массы вещества на 1 градус [Cуд]
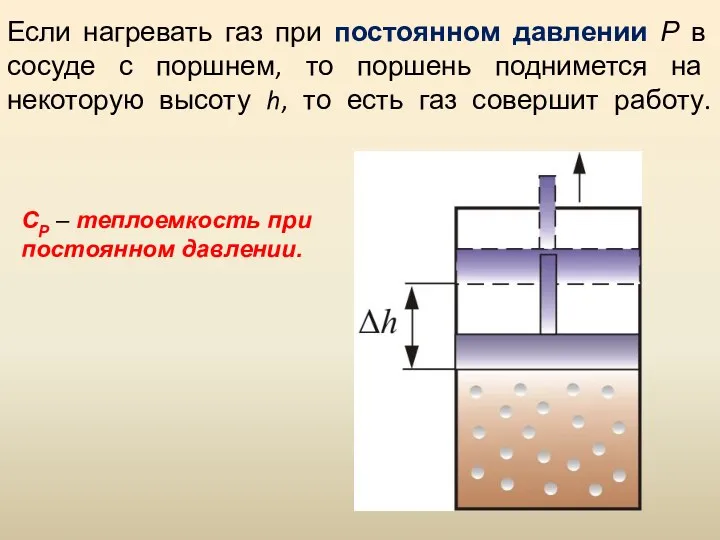
- 42. Теплоёмкость термодинамической системы зависит от того, как изменяется состояние системы при нагревании. Если газ нагревать при
- 43. Если нагревать газ при постоянном давлении Р в сосуде с поршнем, то поршень поднимется на некоторую
- 44. Следовательно, проводимое тепло затрачивается и на нагревание и на совершение работы. Отсюда ясно, что Итак, проводимое
- 45. Это уравнение Майера для одного моля газа. Из него следует, что физический смысл универсальной газовой постоянной
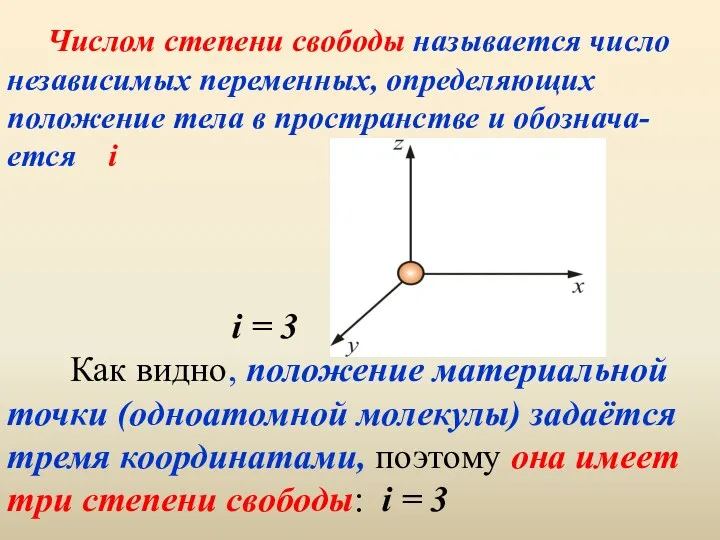
- 46. Числом степени свободы называется число независимых переменных, определяющих положение тела в пространстве и обознача-ется i i
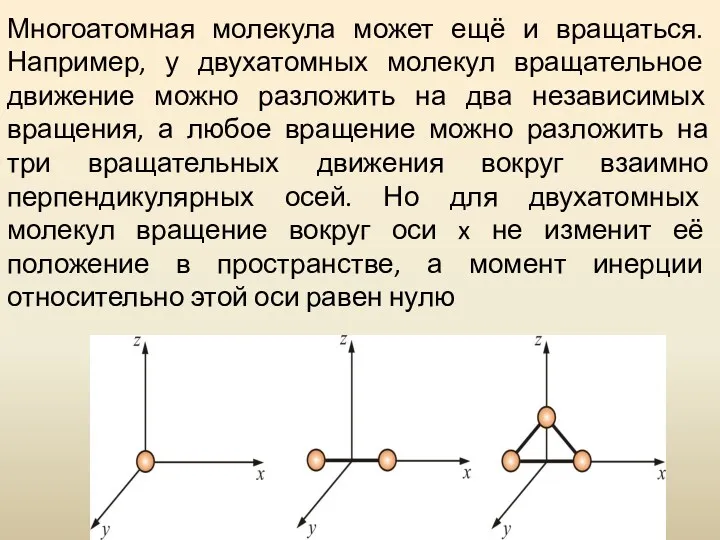
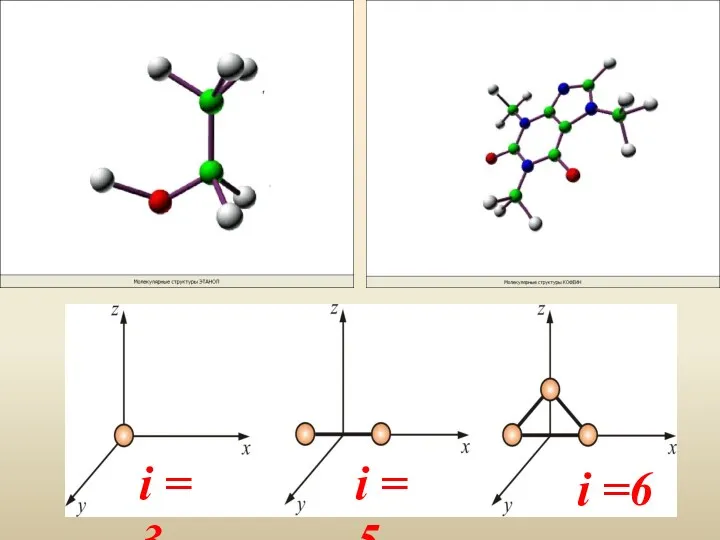
- 47. Многоатомная молекула может ещё и вращаться. Например, у двухатомных молекул вращательное движение можно разложить на два
- 48. i =6 i = 5 i = 3
- 49. 4. Закон о равномерном распределении энергии по степеням свободы Больцман доказал, что, средняя энергия, приходящаяся на
- 50. Для молярной теплоемкости Для удельной теплоемкости
- 51. Если за цикл совершается положительная работа (цикл протекает по часовой стрелке), то он называется прямым Если
- 52. В результате кругового процесса система возвращается в исходное состояние Термический коэффициент полезного действия для кругового процесса
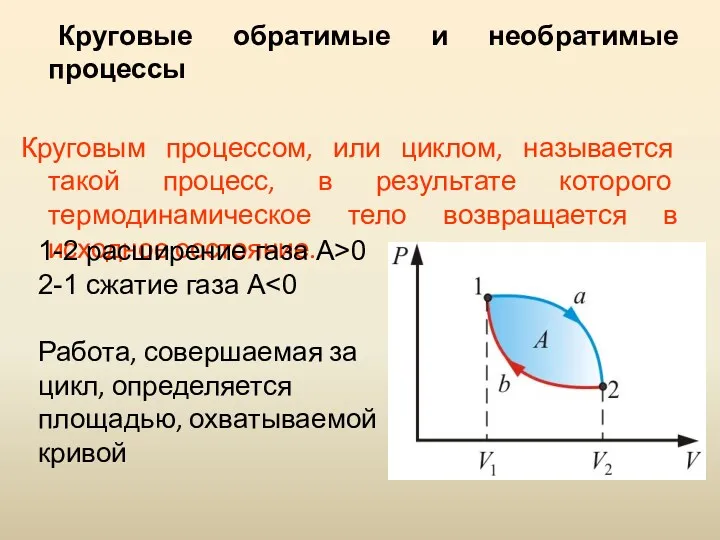
- 53. Круговые обратимые и необратимые процессы Круговым процессом, или циклом, называется такой процесс, в результате которого термодинамическое
- 54. Все термодинамические процессы делят на две группы: обратимые и необратимые. Процесс называют обратимым, если он протекает
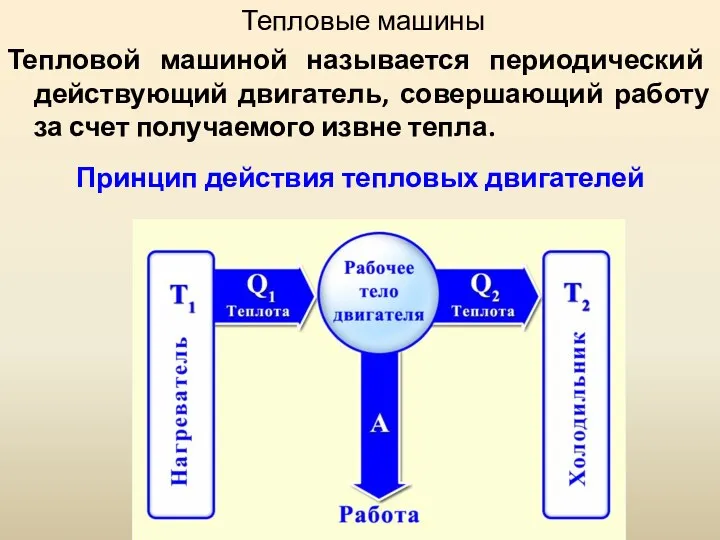
- 55. Тепловые машины Тепловой машиной называется периодический действующий двигатель, совершающий работу за счет получаемого извне тепла. Принцип
- 56. КПД тепловых двигателей
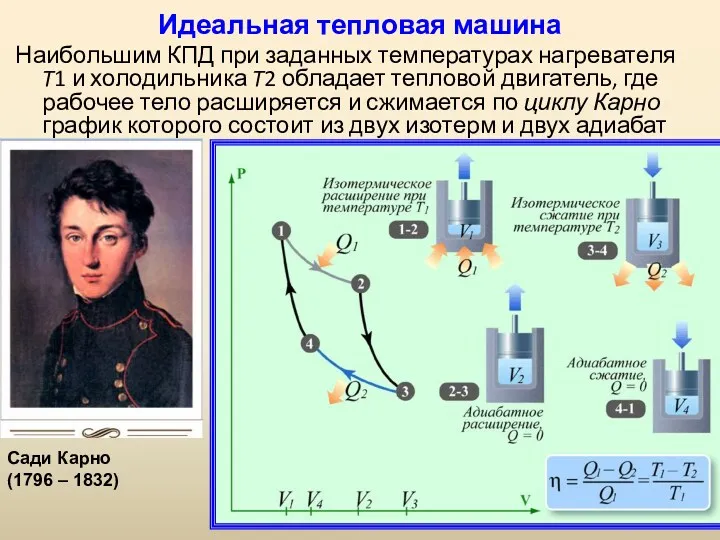
- 57. Идеальная тепловая машина Наибольшим КПД при заданных температурах нагревателя T1 и холодильника T2 обладает тепловой двигатель,
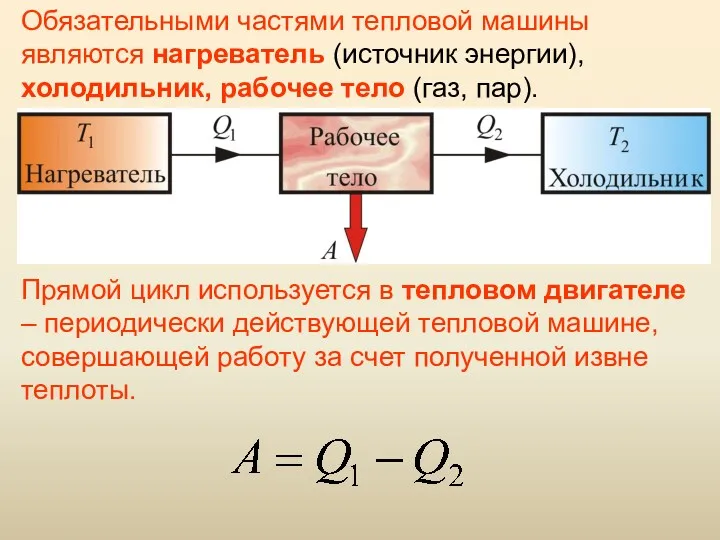
- 58. Обязательными частями тепловой машины являются нагреватель (источник энергии), холодильник, рабочее тело (газ, пар). Прямой цикл используется
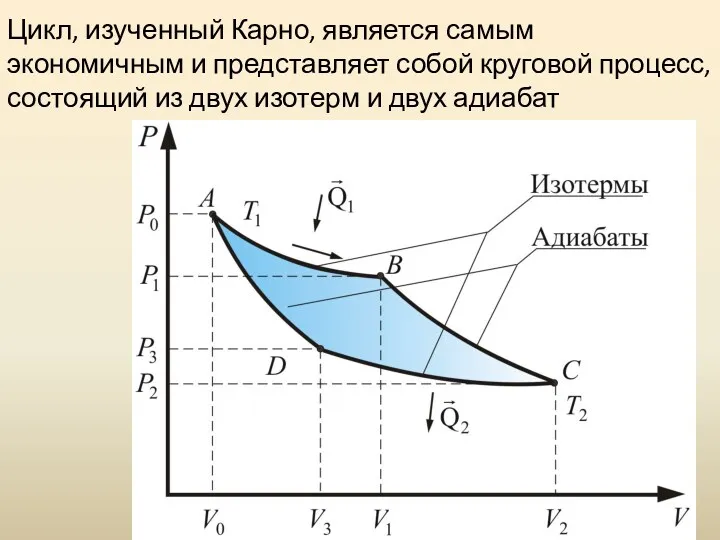
- 59. Цикл, изученный Карно, является самым экономичным и представляет собой круговой процесс, состоящий из двух изотерм и
- 60. полезная работа КПД η равен:
- 61. Второе начало термодинамики 1. Невозможен процесс, единственным результатом которого является превращение всей теплоты, полученной от нагревателя
- 62. Третье начало термодинамики Недостатки первого и второго начал термодинамики в том, что они не позволяют определить
- 63. Согласно Нернсту, изменение энтропии ΔS стремится к нулю при любых обратимых изотермических процессах, совершаемых между двумя
- 65. Скачать презентацию















































 Кинематика сложного движения
Кинематика сложного движения Лабораторная работа Измерение работы и мощности в электрической лампочке(8класс)
Лабораторная работа Измерение работы и мощности в электрической лампочке(8класс) Линейные цепи. Определение и свойства линейных цепей. Лекция 2
Линейные цепи. Определение и свойства линейных цепей. Лекция 2 Основы молекулярной и статистической физики
Основы молекулярной и статистической физики Вероятностные методы строительной механики и теория надёжности строительных конструкций (ВМСМ и ТНСК)
Вероятностные методы строительной механики и теория надёжности строительных конструкций (ВМСМ и ТНСК) Квантовая оптика. Истоки квантовой теории
Квантовая оптика. Истоки квантовой теории Урок физики по теме Закон сохранения энергии 9 -10 класс
Урок физики по теме Закон сохранения энергии 9 -10 класс Универсальные учебные действия на уроках физики
Универсальные учебные действия на уроках физики Молекулярно-кинетическая теория газов. (Лекция 2)
Молекулярно-кинетическая теория газов. (Лекция 2) Оптичні прилади та їх застосування
Оптичні прилади та їх застосування Законы динамики. Уравнения движения. Лекция 1
Законы динамики. Уравнения движения. Лекция 1 Движение заряженных частиц в магнитном поле
Движение заряженных частиц в магнитном поле презентация физика 8 классРабота и мощность
презентация физика 8 классРабота и мощность Lasers. Tutorial 2
Lasers. Tutorial 2 Урок по теме: Искусственные спутники Земли, 10 класс
Урок по теме: Искусственные спутники Земли, 10 класс Дифракция света на акустических волнах. Качественный анализ
Дифракция света на акустических волнах. Качественный анализ Атомные электростанции
Атомные электростанции Кинетическая модель гетерогенного каталитического процесса. (Тема 5.4.2)
Кинетическая модель гетерогенного каталитического процесса. (Тема 5.4.2) Презентация Внутренняя энергия
Презентация Внутренняя энергия Внутреннее строение звезд
Внутреннее строение звезд Метод проектов на уроках физики
Метод проектов на уроках физики Система пескоподачи локомотива
Система пескоподачи локомотива сила упругости
сила упругости Виртуальный музей радиосвязи
Виртуальный музей радиосвязи Презентация Дорога человечества в космос
Презентация Дорога человечества в космос Плавание судов
Плавание судов Устройство двигателей
Устройство двигателей давление света
давление света