Содержание
- 2. Тема урока. Микропараметры вещества 1. Молекулярная физика 1.1. Основы МКТ План урока 2. Размеры молекул. 3.
- 3. Молекулярная физика - раздел науки физики, в которой изучаются физические свойства вещества и явления, происходящие в
- 4. Молекула – наименьшие электрически нейтральные частицы вещества, обладающие основными его химическими свойствами. Они состоят из атомов.
- 5. СОЗДАТЕЛИ АТОМНОЙ ТЕОРИИ Джон Дмитрий Дальтон Менделеев Амедео Эрнест Авогадро Резерфорд
- 6. Микропараметры вещества характеризуют каждую частицу вещества в отдельности, в отличие от макропараметров, характеризующих вещество в целом.
- 7. • Все тела состоят из малых частиц, между которыми есть промежутки. • Частицы тел постоянно и
- 8. Все вещества – жидкие, твердые и газообразные – образованы из мельчайших частиц – молекул, атомов, ионов.
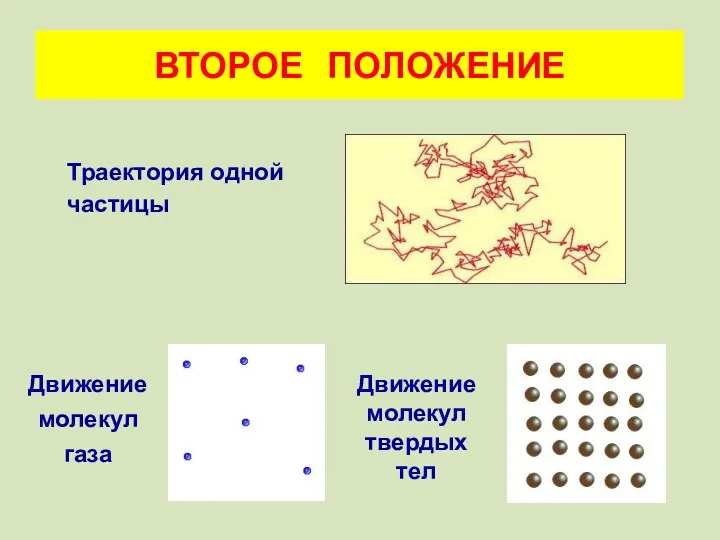
- 9. ВТОРОЕ ПОЛОЖЕНИЕ Траектория одной частицы Движение молекул газа Движение молекул твердых тел
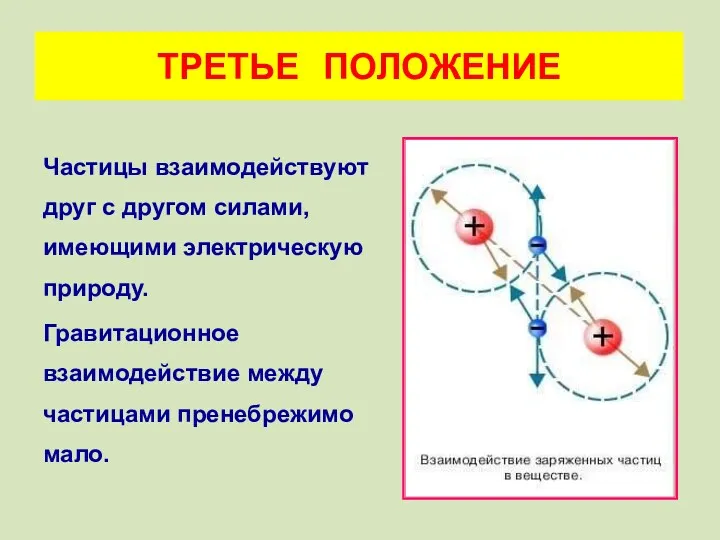
- 10. Частицы взаимодействуют друг с другом силами, имеющими электрическую природу. Гравитационное взаимодействие между частицами пренебрежимо мало. ТРЕТЬЕ
- 11. I положение 1. Дробление вещества 2. Испарение жидкостей 3. Расширение тел при нагревании ОПЫТНЫЕ ПОДТВЕРЖДЕНИЯ
- 12. II положение 1. Диффузия – перемешивание молекул разных веществ 2.Броуновское движение – движение взвешенных в жидкости
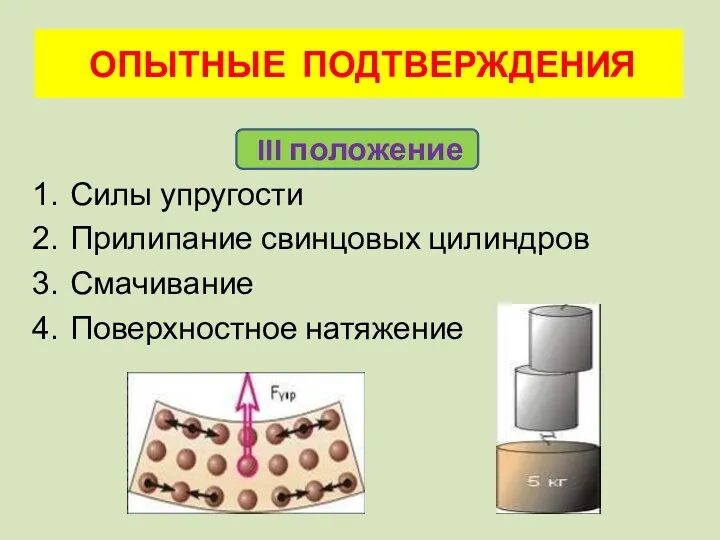
- 13. III положение Силы упругости Прилипание свинцовых цилиндров Смачивание Поверхностное натяжение ОПЫТНЫЕ ПОДТВЕРЖДЕНИЯ
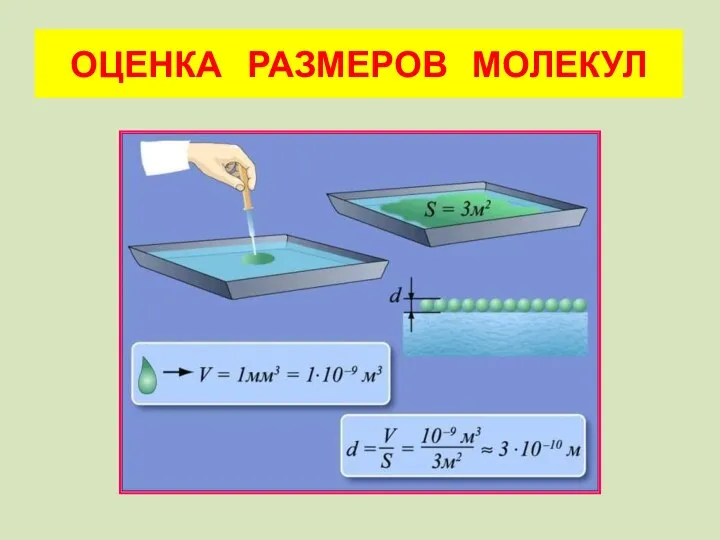
- 14. ОЦЕНКА РАЗМЕРОВ МОЛЕКУЛ
- 15. а) Какими свойствами должна обладать выбранная жидкость? б) Какая геометрическая формула может быть использована? в) Как
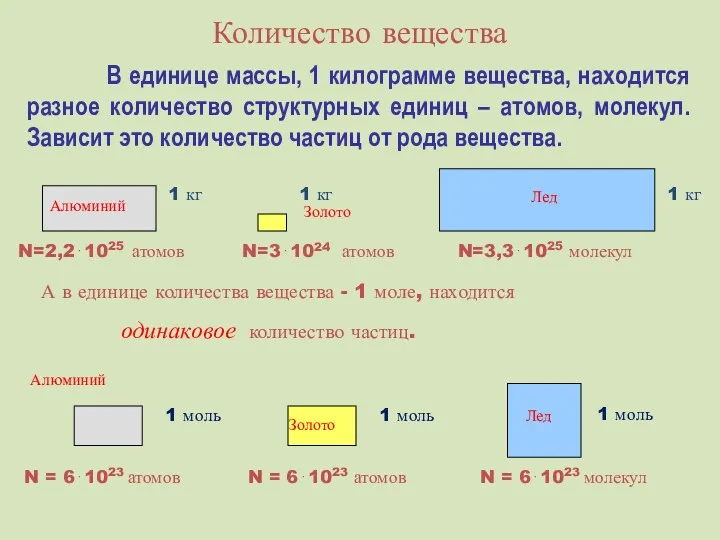
- 16. Количество вещества В единице массы, 1 килограмме вещества, находится разное количество структурных единиц – атомов, молекул.
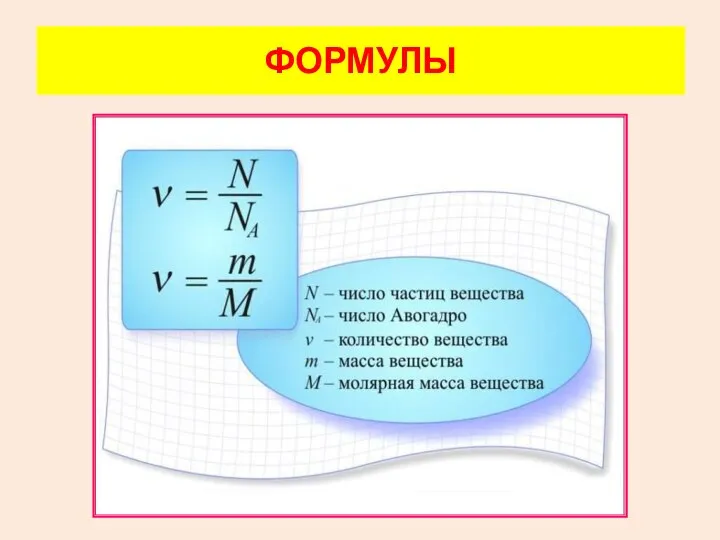
- 17. В молекулярно-кинетической теории количество вещества принято считать пропорциональным числу частиц. Единица количества вещества называется молем (моль).
- 18. ФОРМУЛЫ
- 19. В одном моле любого вещества содержится одно и то же число частиц (молекул). Это число называется
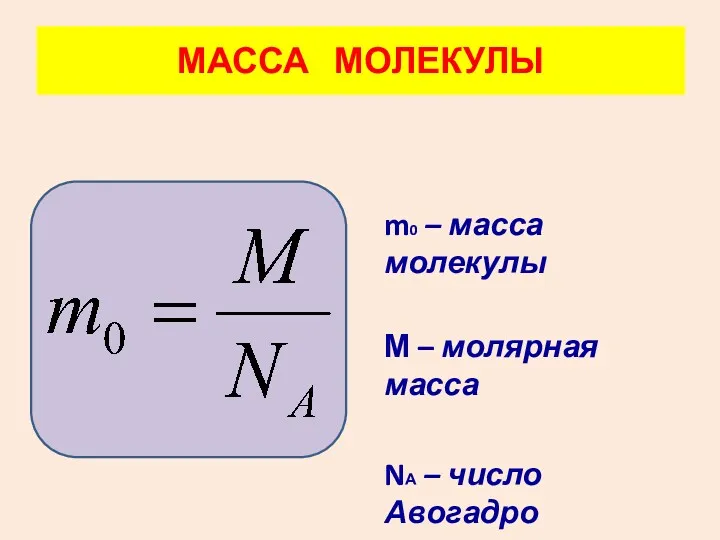
- 20. m0 – масса молекулы М – молярная масса NА – число Авогадро МАССА МОЛЕКУЛЫ
- 21. МОЛЯРНАЯ МАССА
- 23. Скачать презентацию













 Сложное движение точки. Сложное движение твердого тела
Сложное движение точки. Сложное движение твердого тела Презентация Построение изображений в линзах
Презентация Построение изображений в линзах Sm-Nd метод
Sm-Nd метод Метрология. Устройства измерения механической вибрации
Метрология. Устройства измерения механической вибрации Автоматизация. Основные понятия и определения
Автоматизация. Основные понятия и определения Инструментальные методы исследования органических веществ. Лекция 11
Инструментальные методы исследования органических веществ. Лекция 11 Қисық сызықты қозғалыс. Шеңбер бойымен бірқалыпты қозғалыс. Сызықтық және бұрыштық жылдамдық
Қисық сызықты қозғалыс. Шеңбер бойымен бірқалыпты қозғалыс. Сызықтық және бұрыштық жылдамдық Исследование прочностных характеристик сердечников крестовин стрелочных переводов после упрочняющей обработки
Исследование прочностных характеристик сердечников крестовин стрелочных переводов после упрочняющей обработки Электромагнитная индукция. (Лекция 10)
Электромагнитная индукция. (Лекция 10) Роботизированная коробка передач
Роботизированная коробка передач Діелектрики в електричному полі. Поляризація діелектриків. Діелектрична проникність речовини
Діелектрики в електричному полі. Поляризація діелектриків. Діелектрична проникність речовини Соединения с подшипниками качения. Лекция №8
Соединения с подшипниками качения. Лекция №8 Техника безопасности при работе с электрическим током. Проблемы энергосбережения
Техника безопасности при работе с электрическим током. Проблемы энергосбережения Термодинамика. Законы термодинамики
Термодинамика. Законы термодинамики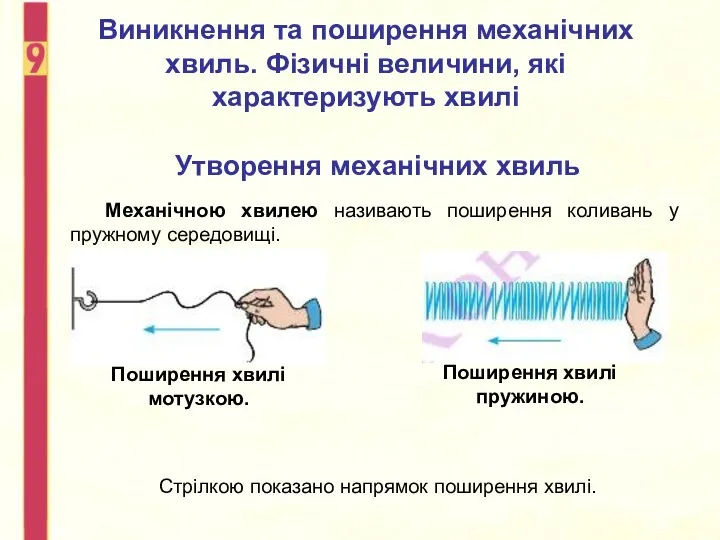 Виникнення та поширення механічних хвиль. Фізичні величини, які характеризують хвилі
Виникнення та поширення механічних хвиль. Фізичні величини, які характеризують хвилі Организация технического обслуживания и ремонт автомобиля Iveco Stralis AT440S40 T/P
Организация технического обслуживания и ремонт автомобиля Iveco Stralis AT440S40 T/P Подготовка учащихся к практической части ОГЭ по физике
Подготовка учащихся к практической части ОГЭ по физике Физические основы электроники
Физические основы электроники презентация к уроку физики Законы сохранения в механике
презентация к уроку физики Законы сохранения в механике Свободное падение тел. (9 класс)
Свободное падение тел. (9 класс) Явище електромагнітної індукції. Досліди Фарадея. Правило Ленца
Явище електромагнітної індукції. Досліди Фарадея. Правило Ленца Закон сохранения и превращения энергии в тепловых процессах
Закон сохранения и превращения энергии в тепловых процессах Сушка. Три этапа в сушке материала. (Лекция 5)
Сушка. Три этапа в сушке материала. (Лекция 5) Исследовательская деятельность на уроках физики
Исследовательская деятельность на уроках физики Презентация к уроку физики в 7 классе по теме: Связь между силой тяжести и массой тела.
Презентация к уроку физики в 7 классе по теме: Связь между силой тяжести и массой тела. Обобщающий урок-сказка по теме Первоначальные сведения о строении вещества
Обобщающий урок-сказка по теме Первоначальные сведения о строении вещества Колебания и волны. Лекция 14
Колебания и волны. Лекция 14 Системы автоматизации производства и ремонта вагонов
Системы автоматизации производства и ремонта вагонов