Содержание
- 2. ТЕПЛОПЕРЕДАЧА Теплопередача (теплообмен) - процесс изменения внутренней энергии без совершения работы. Количественная характеристика - количество теплоты
- 3. 3. Излучение - вид теплопередачи, при котором энергия передается с помощью электромагнитных волн (преимущественно инфракрасного диапазона).
- 4. Изменение температуры: (Шкала Цельсия) Q = cm(t02-t01) Q = cmΔt РАСЧЁТ КОЛИЧЕСТВА ТЕПЛОТЫ Изменение температуры. (Шкала
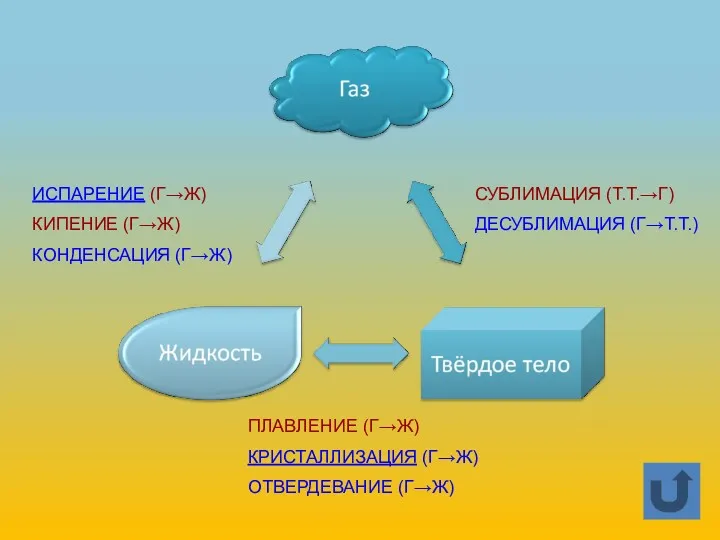
- 5. ИСПАРЕНИЕ (Г→Ж) КИПЕНИЕ (Г→Ж) КОНДЕНСАЦИЯ (Г→Ж) СУБЛИМАЦИЯ (Т.Т.→Г) ДЕСУБЛИМАЦИЯ (Г→Т.Т.) ПЛАВЛЕНИЕ (Г→Ж) КРИСТАЛЛИЗАЦИЯ (Г→Ж) ОТВЕРДЕВАНИЕ (Г→Ж)
- 6. Плавление и отвердевание вещества. Q=λm. - удельная теплота плавления Удельная теплота плавления показывает на сколько изменяется
- 7. Q = ±Lm = ±rm ПАРООБРАЗОВАНИЕ И КОНДЕНСАЦИЯ Парообразование и конденсация вещества. Q = Lm =
- 8. ГРАФИК ОСНОВНЫХ ТЕПЛОВЫХ ПРОЦЕССОВ I – нагревание твердого тела; II – плавление твердого тела; III –
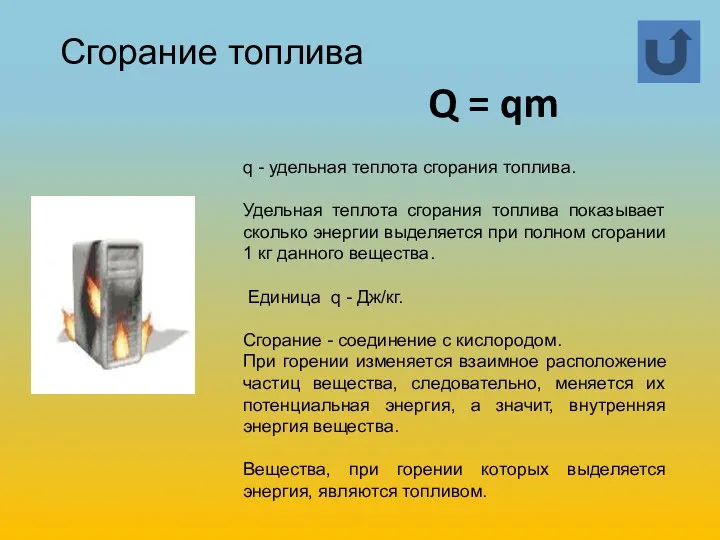
- 9. q - удельная теплота сгорания топлива. Удельная теплота сгорания топлива показывает сколько энергии выделяется при полном
- 11. Скачать презентацию






 teoriya_avtomaticheskogo_upravleniya_Polulah_parth4
teoriya_avtomaticheskogo_upravleniya_Polulah_parth4 Электромагнитные волны. Электромагнитное поле как особый вид материи
Электромагнитные волны. Электромагнитное поле как особый вид материи Место курса Методы исследования минералов в системе естественных наук
Место курса Методы исследования минералов в системе естественных наук Phase Locked Loop Design
Phase Locked Loop Design Физическая технология топлива. Требования, предъявляемые к дизельным топливам
Физическая технология топлива. Требования, предъявляемые к дизельным топливам Электромагнетизм. Понятия поля и заряда
Электромагнетизм. Понятия поля и заряда Internal сombustion engine. Ignition systems
Internal сombustion engine. Ignition systems Кинематика вращательного движения. (Лекция 2)
Кинематика вращательного движения. (Лекция 2) Теплопроводность. Хорошая и плохая теплопроводность
Теплопроводность. Хорошая и плохая теплопроводность Презентация по физике для 10 класса МКТ газов
Презентация по физике для 10 класса МКТ газов Направляющие прямолинейного движения с трением качения
Направляющие прямолинейного движения с трением качения Course of lectures Contemporary Physics: Part1
Course of lectures Contemporary Physics: Part1 Игра Звёздный час по физике
Игра Звёздный час по физике Механіка. Неінерціальні системи відліку
Механіка. Неінерціальні системи відліку Плавание судов
Плавание судов Работа силы Ампера. Магнитный поток. Явление электромагнитной индукции. Закон электромагнитной индукции. Правило Ленца
Работа силы Ампера. Магнитный поток. Явление электромагнитной индукции. Закон электромагнитной индукции. Правило Ленца Физика и познание мира
Физика и познание мира Гидравлические машины. 7 класс
Гидравлические машины. 7 класс 5 класс 14.06
5 класс 14.06 Волновые свойства света
Волновые свойства света Простые механизмы и “Золотое правило” механики
Простые механизмы и “Золотое правило” механики Радиоприёмные устройства. Часть 1. Основные параметры и классификация
Радиоприёмные устройства. Часть 1. Основные параметры и классификация Теоретическая механика
Теоретическая механика Параметры схем замещения силовых трансформаторов и автотрансформаторов
Параметры схем замещения силовых трансформаторов и автотрансформаторов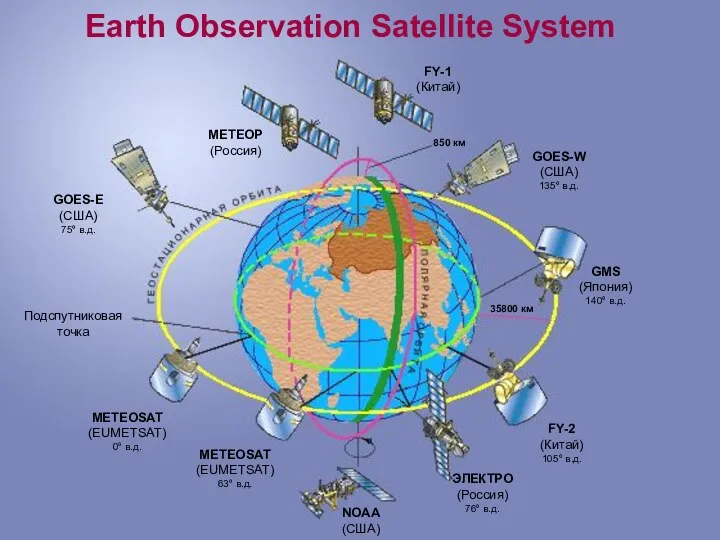 Earth observation satellite system
Earth observation satellite system Атомная бомба
Атомная бомба Единство многообразия. Сравнение характеристик микромира и мегамира
Единство многообразия. Сравнение характеристик микромира и мегамира Металлографические исследования поверхности материалов
Металлографические исследования поверхности материалов