Содержание
- 2. §§ Внутренняя энергия газа 02 В модели идеального газа силами взаимодействия молекул пренебрегают Внутренняя энергия газа
- 3. §§ Работа и теплота 03 Вычислим работу газа при расширении p – давление газа F =
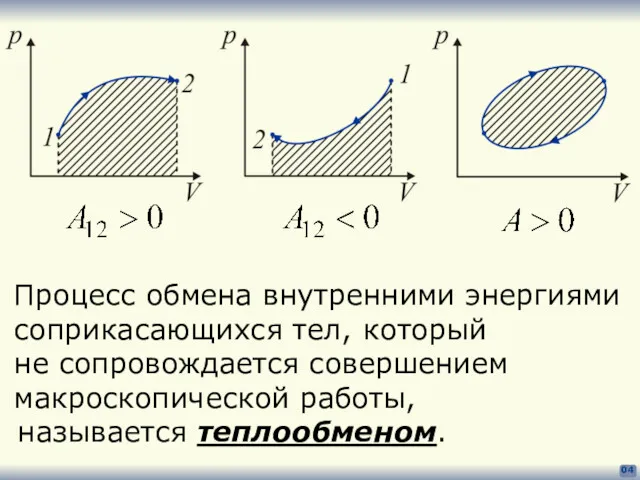
- 4. 04 Процесс обмена внутренними энергиями соприкасающихся тел, который не сопровождается совершением макроскопической работы, называется теплообменом.
- 5. §§ Первое начало 05 Термодинамическая система называется изолированной, если отсутствует всякий обмен энергией между ней и
- 6. 06 Пусть системой α совершена работа A, тогда Рассмотрим контакт систем в адиабатической оболочке. неподвижная теплопроводящая
- 7. идет на приращение ее внутренней энергии ΔU = U2 – U1 07 Получаем математическую формулировку I-го
- 8. §§ Теплоемкость 08 Теплоемкость вещества – физическая величина, равная количеству теплоты, необходимому для нагревания вещества на
- 9. 09 Удельная теплоемкость: Молярная теплоемкость: Из первого начала найдем молярную теплоемкость газа
- 10. 10 1) V = const 2) p = const рассмотрим уравнение М–К:
- 11. 11 Для идеального газа справедливо уравнение Майера Для твердых тел и жидкостей Cp ≈ CV
- 12. §§ Изотермический процесс 12 Это бесконечно медленный процесс, т.к. в системе должно установиться термодинамическое равновесие Закон
- 13. 13 1-е начало термодинамики т.е. вся переданная рабочему телу теплота идет на совершение телом работы Работа
- 14. чтобы не происходил обмен энергией с окружающей средой или он был бы несущественным §§ Адиабатический процесс
- 15. 15 1-е начало термодинамики т.е. работа совершается за счет убыли энергии системы Работа газа при адиабатическом
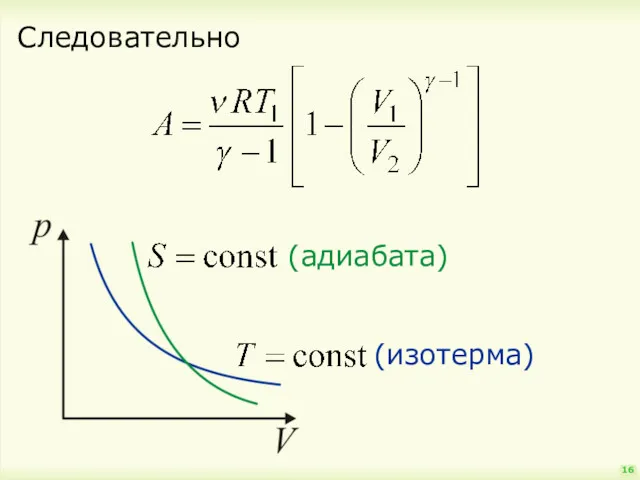
- 16. Следовательно 16
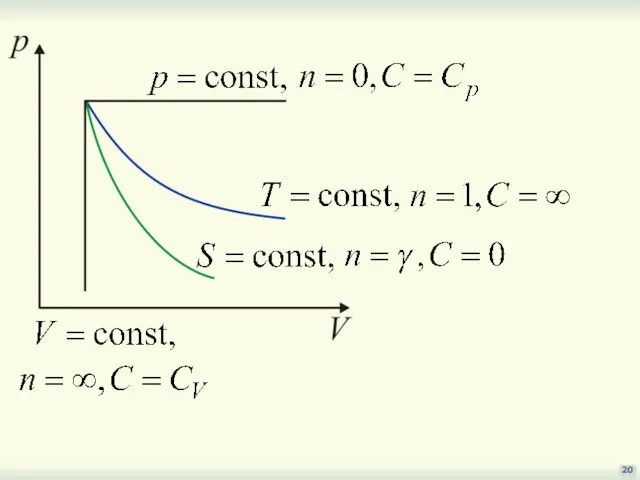
- 17. §§ Политропические процессы 17 Процесс, в котором теплоемкость остается постоянной величиной, называется политропическим (политропным). Рассмотренные процессы
- 18. 18 сделаем замену R = Cp–CV и выразим dT
- 19. 19 Интегрируя, получаем или – уравнение политропы
- 20. 20
- 22. Скачать презентацию
















 Требования к машинам и деталям
Требования к машинам и деталям Сведения о составной части изделия. Маркировка автомобильного подвижного состава
Сведения о составной части изделия. Маркировка автомобильного подвижного состава Физические явления
Физические явления МЕТОДИЧЕСКАЯ РАЗРАБОТКА ПО ОРГАНИЗАЦИИ ВНЕАУДИТОРНОЙ САМОСТОЯТЕЛЬНОЙ РАБОТЫ ОБУЧАЮЩИХСЯ ПО ДИСЦИПЛИНЕ ФИЗИКА
МЕТОДИЧЕСКАЯ РАЗРАБОТКА ПО ОРГАНИЗАЦИИ ВНЕАУДИТОРНОЙ САМОСТОЯТЕЛЬНОЙ РАБОТЫ ОБУЧАЮЩИХСЯ ПО ДИСЦИПЛИНЕ ФИЗИКА Transformer
Transformer Эстетическое воспитание на уроках физики.
Эстетическое воспитание на уроках физики. Профессия автомеханик
Профессия автомеханик Структурные уровни организации материи. Микро-, макро-, мегамиры
Структурные уровни организации материи. Микро-, макро-, мегамиры Презентация к уроку на тему: Великий ученый древнего мира – Архимед и его закон
Презентация к уроку на тему: Великий ученый древнего мира – Архимед и его закон Плазма. Что такое плазма?
Плазма. Что такое плазма? Свободные затухающие и вынужденные колебания
Свободные затухающие и вынужденные колебания Сила Лоренца. Теоретическая часть
Сила Лоренца. Теоретическая часть Элементы машиноведения
Элементы машиноведения Основы теории индукционного нагрева
Основы теории индукционного нагрева Оптическое явление атмосферы гало
Оптическое явление атмосферы гало Роль М.В. Ломоносова и Дж. Дальтона в создании атомно-молекулярного учения
Роль М.В. Ломоносова и Дж. Дальтона в создании атомно-молекулярного учения Подшипники скольжения
Подшипники скольжения Подшипники качения
Подшипники качения Законы автоматического регулирования
Законы автоматического регулирования Повышение стойкости червячных фрез за счет нанесения фоп-покрытия нового поколения
Повышение стойкости червячных фрез за счет нанесения фоп-покрытия нового поколения Типы оптических спектров. Поглощение и испускание света атомами. Происхождение линейчатых спектров
Типы оптических спектров. Поглощение и испускание света атомами. Происхождение линейчатых спектров Семей ядролық полигоны
Семей ядролық полигоны Определение диаметра вала в опасном сечении из условия прочности на изгиб с кручением
Определение диаметра вала в опасном сечении из условия прочности на изгиб с кручением Количество теплоты. Единицы количества теплоты. Удельная теплоемкость. Расчет количества теплоты. 8 класс
Количество теплоты. Единицы количества теплоты. Удельная теплоемкость. Расчет количества теплоты. 8 класс Выталкивающая сила. Закон Архимеда
Выталкивающая сила. Закон Архимеда Молекулярна фізика. Термодинаміка
Молекулярна фізика. Термодинаміка Преломление света. Закон преломления света. 9 класс
Преломление света. Закон преломления света. 9 класс Давление света
Давление света