Содержание
- 2. Особенности термодинамики ионных систем Полные потенциалы – потенциалы, которые включают все виды работы, совершаемой при перемещении
- 3. Активность электролита, средние и ионные активности Следовательно, т.е. или Стандартное состояние:
- 4. Активность, химический и электрохимический потенциалы Активность: Химический потенциал: Электрохимический потенциал: Приближения для расчета ионных активностей:
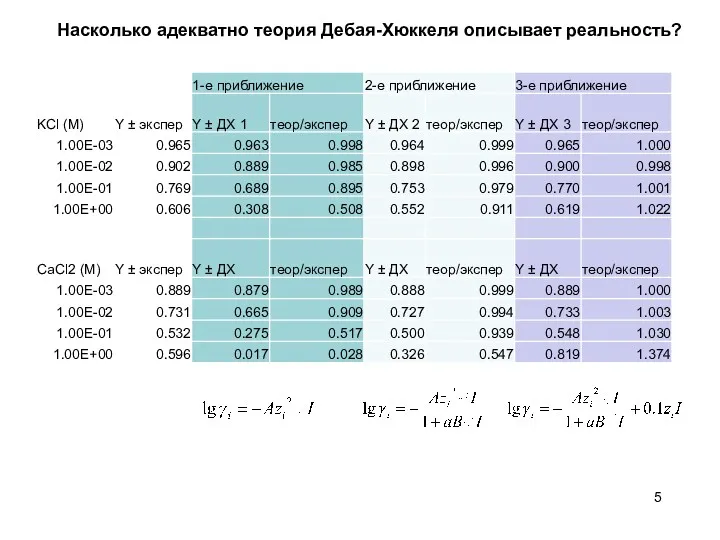
- 5. Насколько адекватно теория Дебая-Хюккеля описывает реальность?
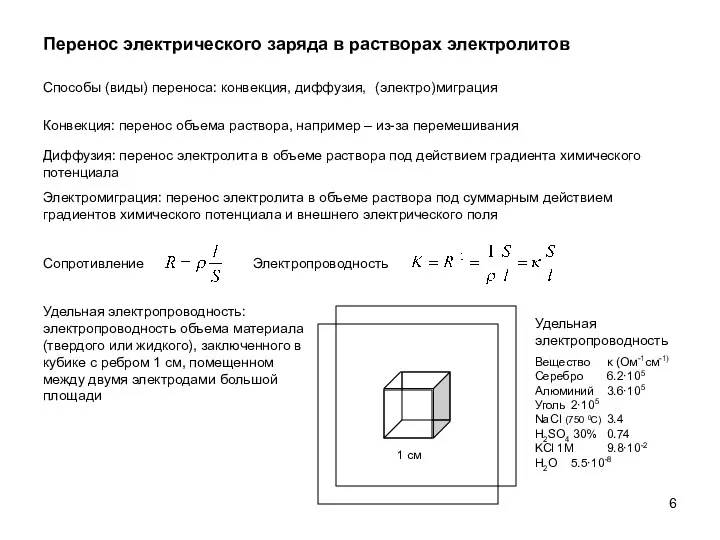
- 6. Перенос электрического заряда в растворах электролитов Способы (виды) переноса: конвекция, диффузия, (электро)миграция Удельная электропроводность Вещество κ
- 7. Основное понятие, применяемое при описании процессов переноса вещества, теплоты, электрического заряда, и т.д. – плотность потока.
- 8. Речь идет о движении только вдоль оси x, символ вектора в дальнейшем не применяем + +
- 9. Подвижность иона Пусть система однородна (нет градиентов) даже по оси x. Тогда никакого направленного переноса не
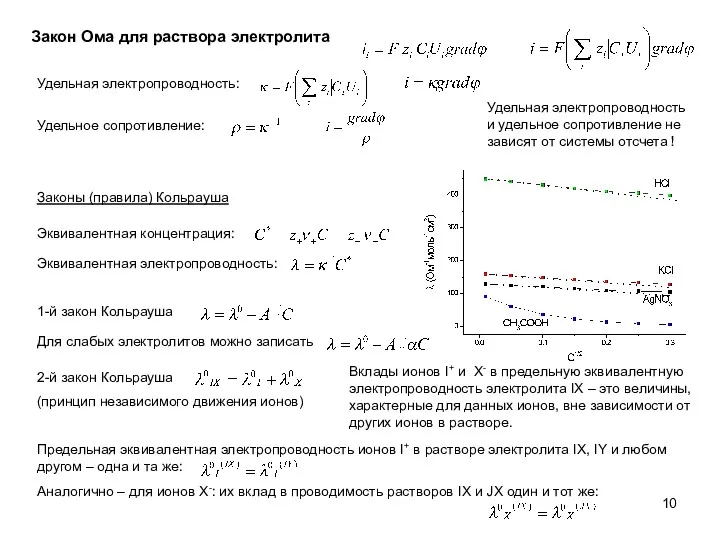
- 10. Закон Ома для раствора электролита Удельная электропроводность и удельное сопротивление не зависят от системы отсчета !
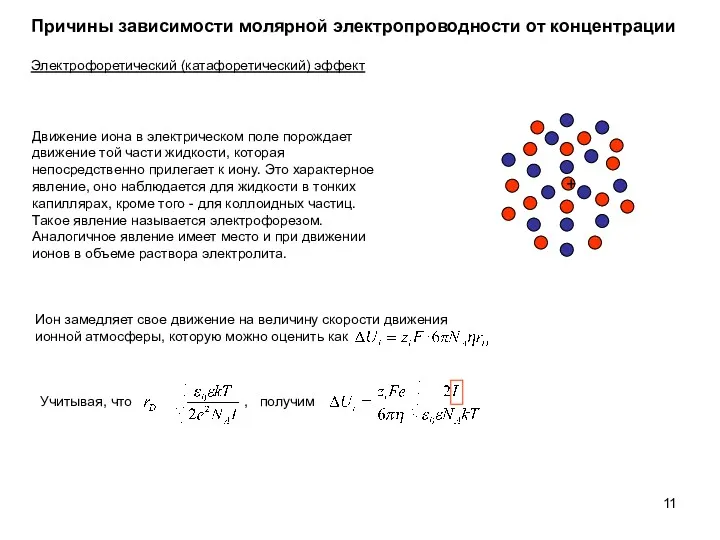
- 11. Причины зависимости молярной электропроводности от концентрации Электрофоретический (катафоретический) эффект Движение иона в электрическом поле порождает движение
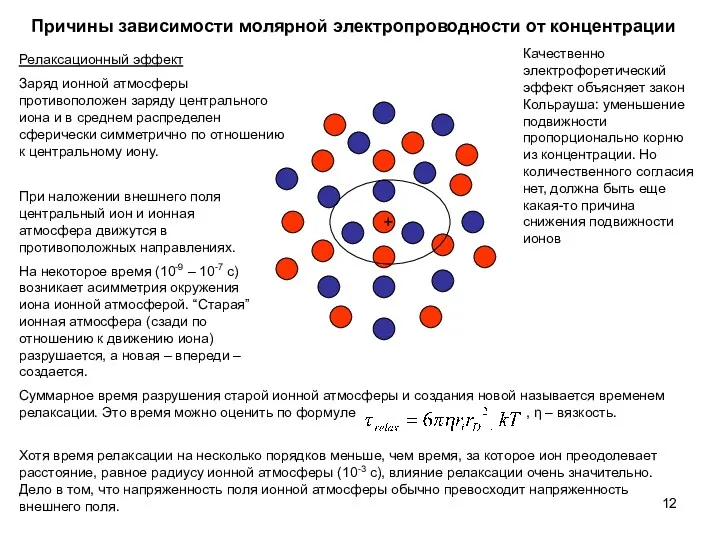
- 12. + Причины зависимости молярной электропроводности от концентрации Релаксационный эффект При наложении внешнего поля центральный ион и
- 13. Теория электропроводности Онзагера Теория Онзагера учитывает межионные электростатические взаимодействия примерно также, как они учтены в теории
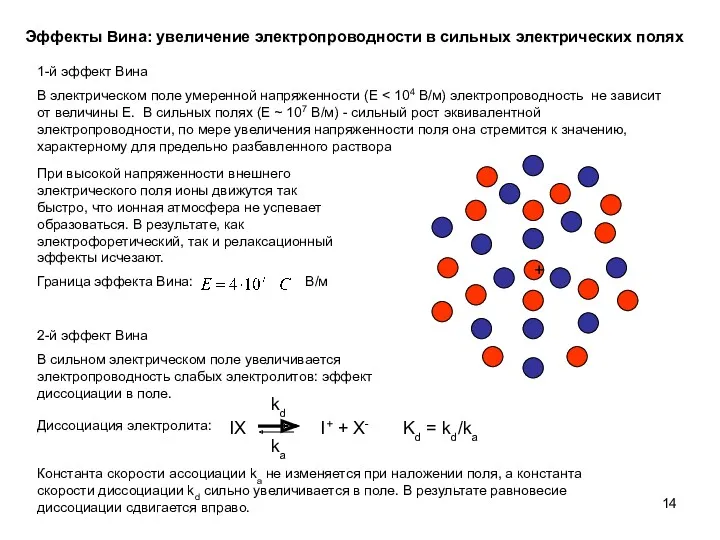
- 14. Эффекты Вина: увеличение электропроводности в сильных электрических полях 1-й эффект Вина В электрическом поле умеренной напряженности
- 15. Эффект Дебая-Фалькенгагена: увеличение электропроводности в переменном электрическом поле + Исходя из идеи ионной атмосферы, Дебай и
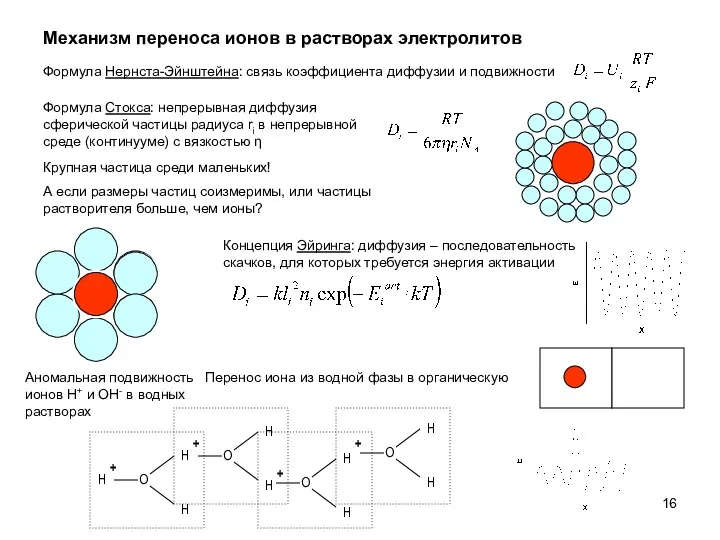
- 16. Механизм переноса ионов в растворах электролитов Аномальная подвижность ионов H+ и OH- в водных растворах Крупная
- 17. Кислотность водных и неводных растворов Шкала pH для водных растворов Ag│AgCl, буфер, KCl (m) │H2, Pt
- 18. Функции кислотности Аррениус: кислота (HA) – вещество, которое в водном растворе отщепляет ион водорода основание (BOH)
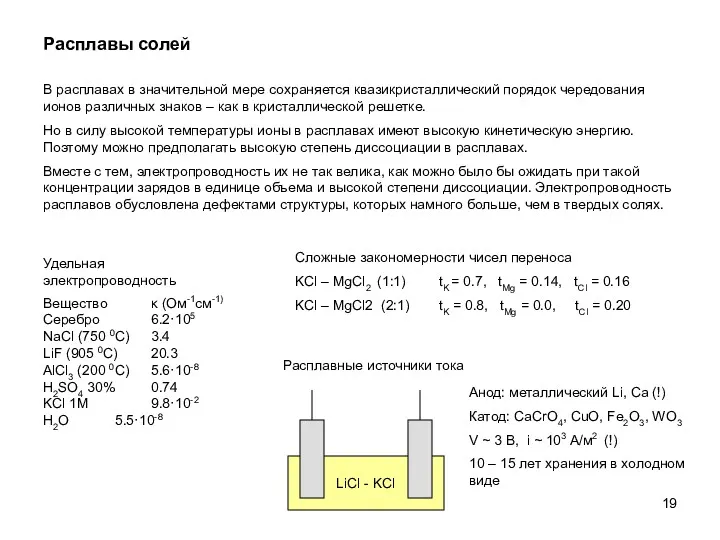
- 19. Расплавы солей В расплавах в значительной мере сохраняется квазикристаллический порядок чередования ионов различных знаков – как
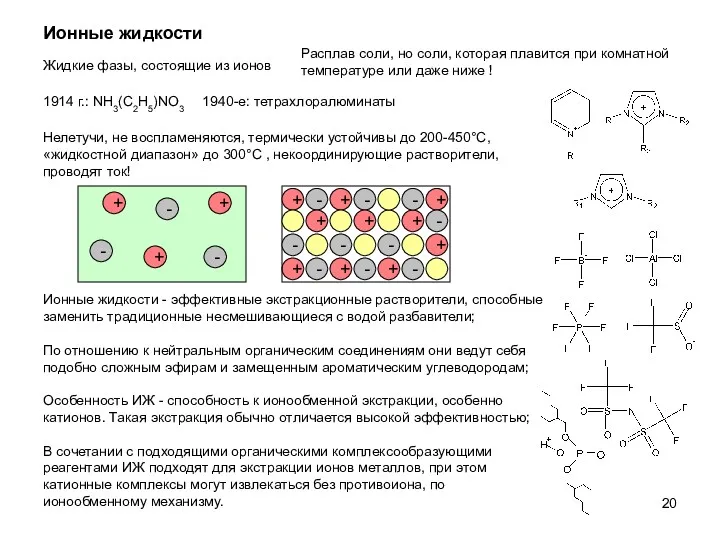
- 20. Ионные жидкости Ионные жидкости - эффективные экстракционные растворители, способные заменить традиционные несмешивающиеся с водой разбавители; По
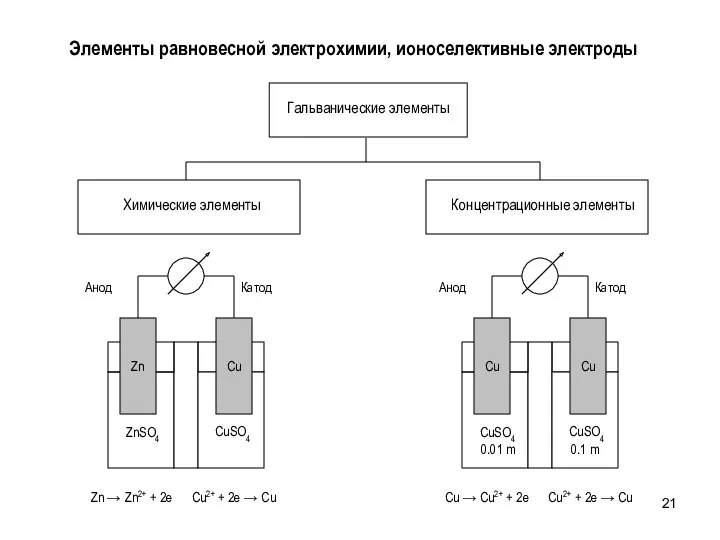
- 21. Элементы равновесной электрохимии, ионоселективные электроды
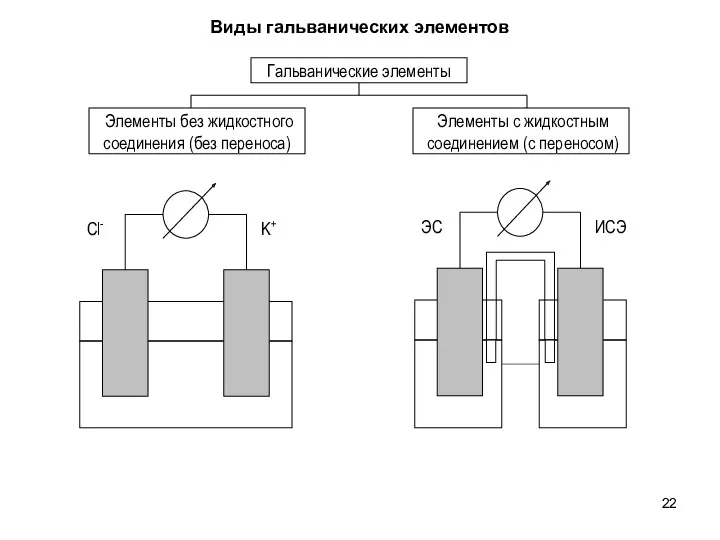
- 22. Виды гальванических элементов
- 23. Элементы без жидкостного соединения (без переноса) Чистый KCl: aK=CKγK=CKCl γK aCl=CClγCl =CKCl γCl a± KCl=(aK aCl)1/2
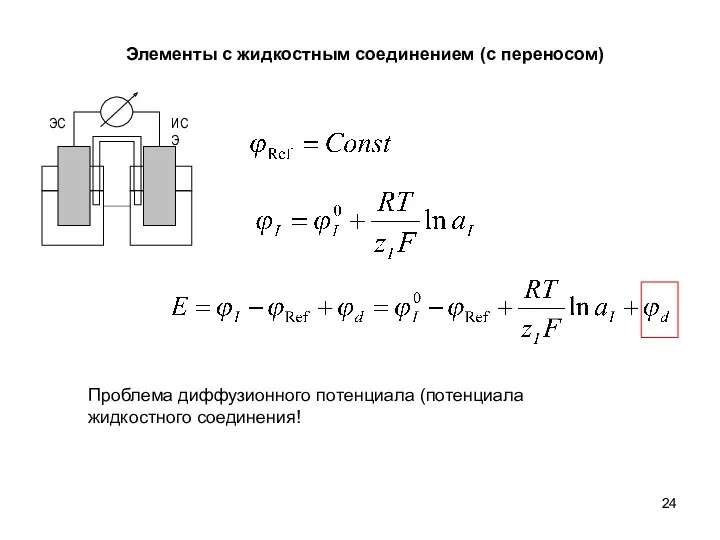
- 24. Элементы с жидкостным соединением (с переносом) Проблема диффузионного потенциала (потенциала жидкостного соединения!
- 25. Э.д.с. элемента с жидкостным соединением Э.д.с. элемента с жидкостным соединением может быть выражена через термодинамически-определенные параметры
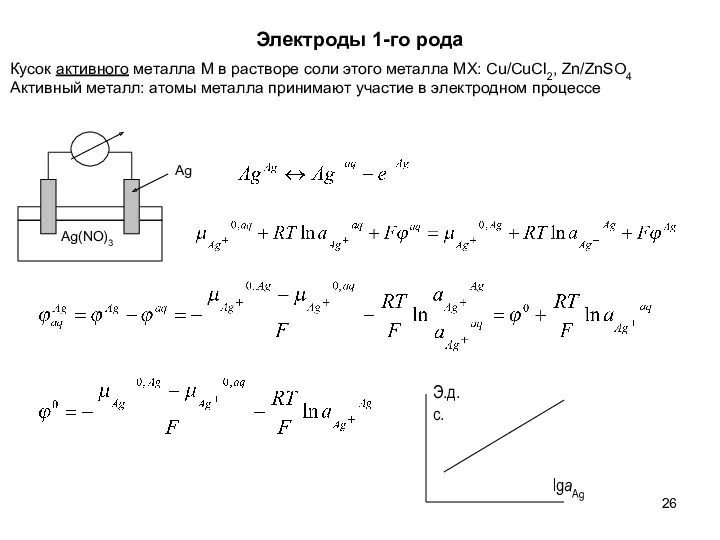
- 26. Электроды 1-го рода Кусок активного металла M в растворе соли этого металла MX: Cu/CuCl2, Zn/ZnSO4 Активный
- 27. Электроды 2-го рода Активный металл в насыщенном растворе своей малорастворимой соли, содержащем также растворимую соль того
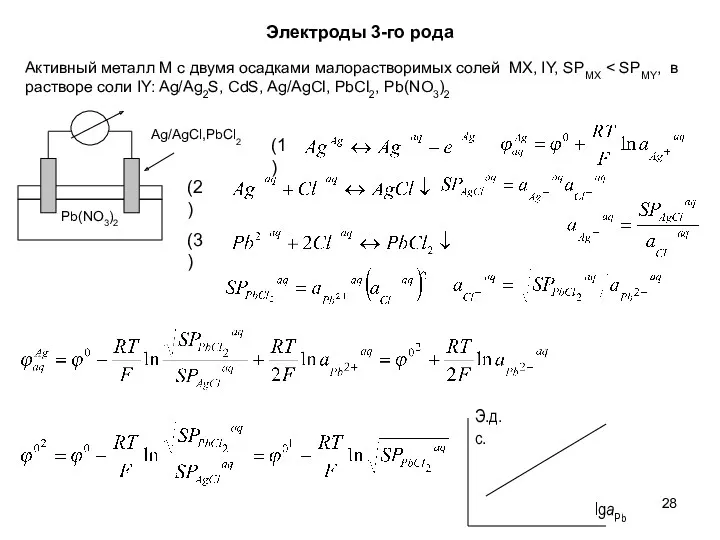
- 28. Электроды 3-го рода Активный металл M с двумя осадками малорастворимых cолей MX, IY, SPMX (1) (2)
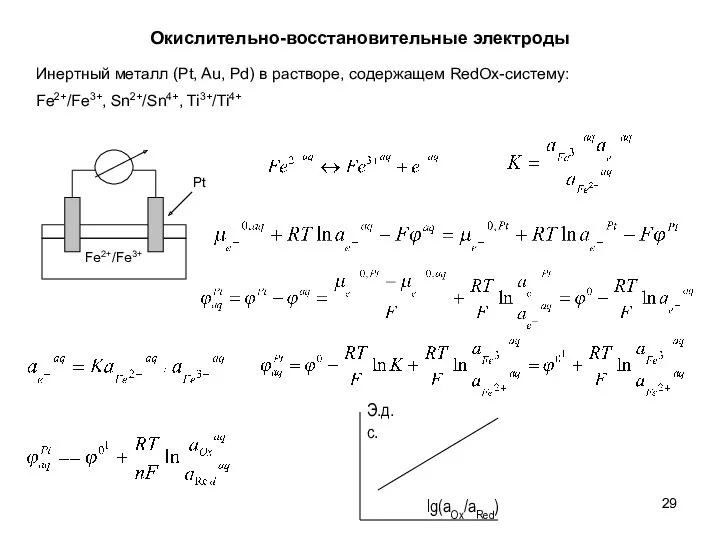
- 29. Окислительно-восстановительные электроды Инертный металл (Pt, Au, Pd) в растворе, содержащем RedOx-систему: Fe2+/Fe3+, Sn2+/Sn4+, Ti3+/Ti4+
- 30. Электроды 1-го, 2-го, 3-го рода и окислительно-восстановительные
- 31. Газовые электроды: инертный металл, кроме веществ, находящихся в растворе, в электродной реакции участвуют газы Водородный газовый
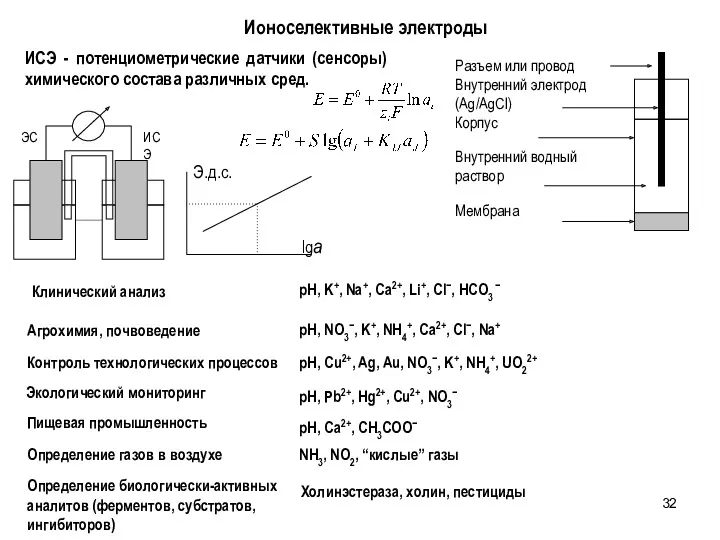
- 32. ИСЭ - потенциометрические датчики (сенсоры) химического состава различных сред. Ионоселективные электроды
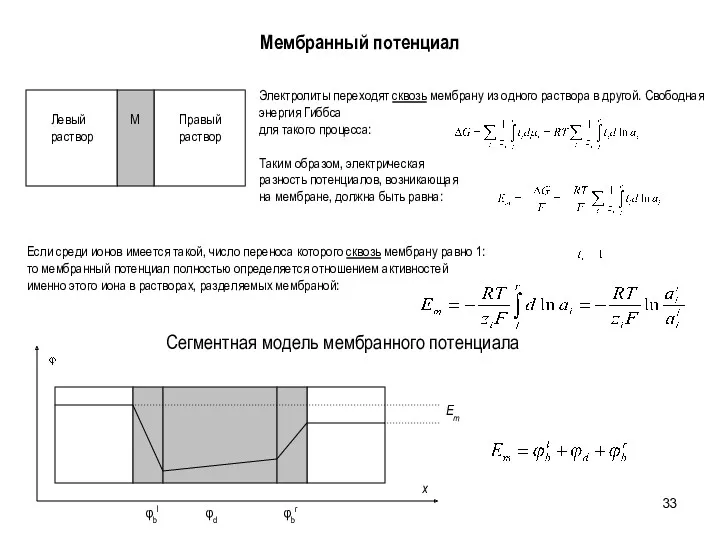
- 33. Мембранный потенциал Электролиты переходят сквозь мембрану из одного раствора в другой. Свободная энергия Гиббса для такого
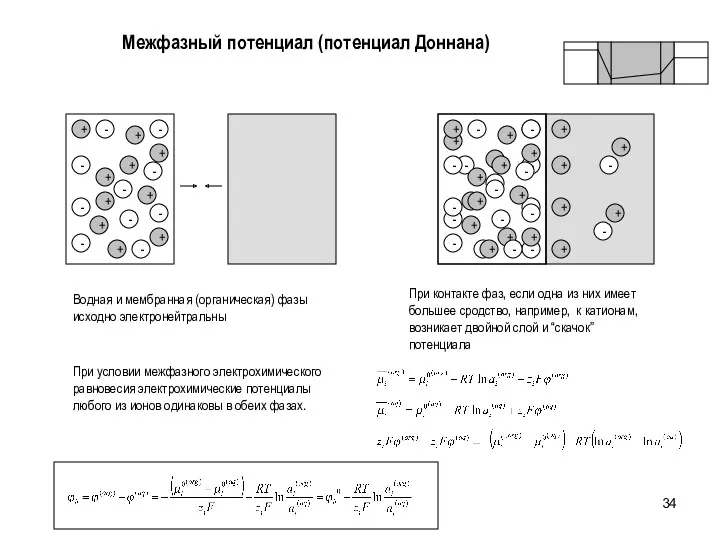
- 34. Межфазный потенциал (потенциал Доннана) + + + + + + - - - - - -
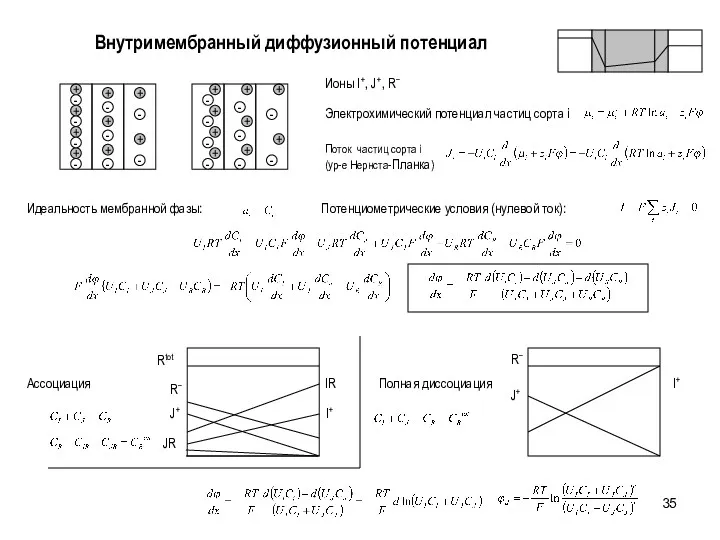
- 35. Внутримембранный диффузионный потенциал Потенциометрические условия (нулевой ток): Идеальность мембранной фазы: Ионы I+, J+, R− Полная диссоциация
- 36. Полный мембранный потенциал Потенциалопределяющий ион задает межфазный потенциал, остальные под него подстраиваются
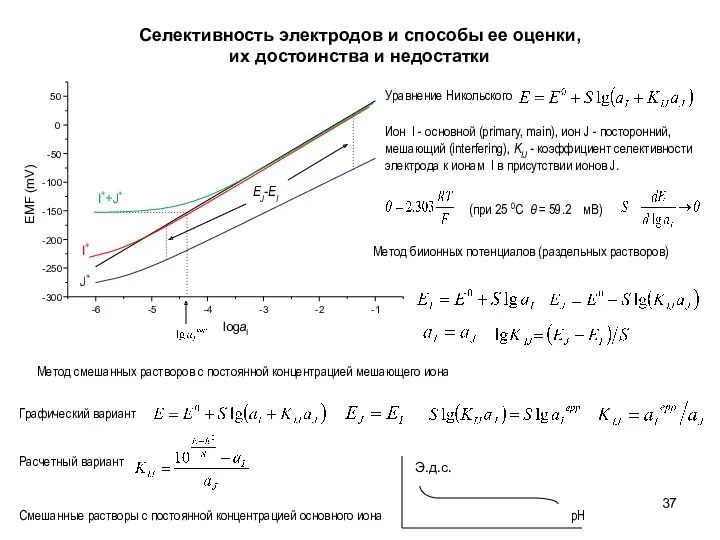
- 37. Селективность электродов и способы ее оценки, их достоинства и недостатки Ион I - основной (primary, main),
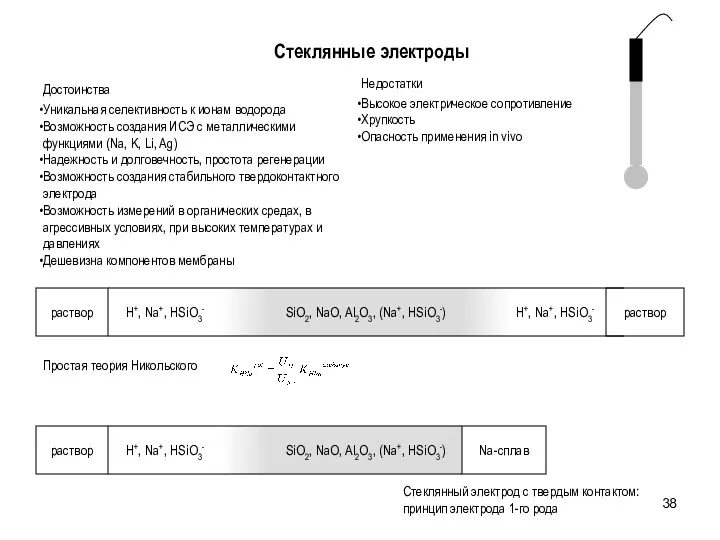
- 38. Стеклянные электроды Достоинства Уникальная селективность к ионам водорода Возможность создания ИСЭ с металлическими функциями (Na, K,
- 39. Электроды с поли- и монокристаллическими мембранами Достоинства Возможность создания ИСЭ с анионными и катионными функциями Надежность
- 40. ИСЭ с жидкими и полимерными мембранами (на основе ионофоров) Достоинства Возможность создания самых разнообразных ИСЭ, в
- 41. Селективность ИСЭ с мембранами на основе ионообменников, ряд Гофмейстера Иллюстративный «вывод» формулы для коэффициента селективности ионообменных
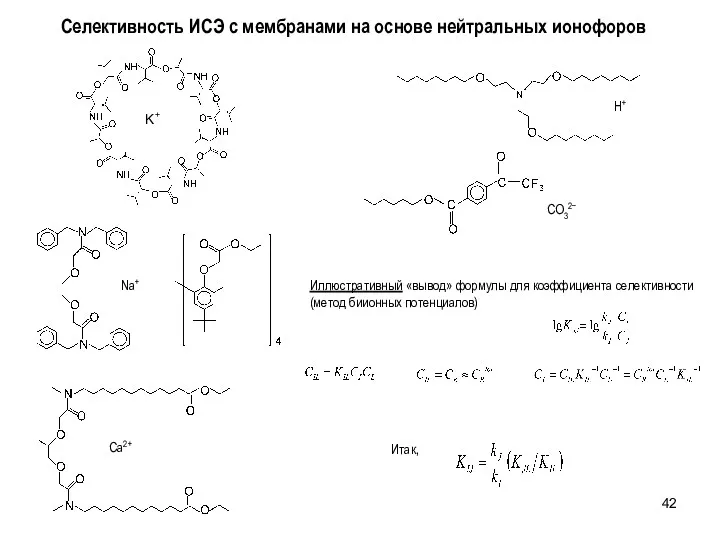
- 42. Селективность ИСЭ с мембранами на основе нейтральных ионофоров
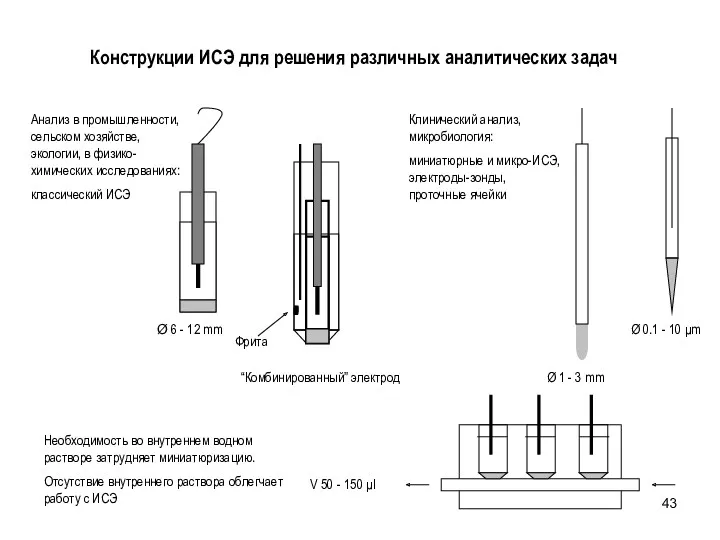
- 43. Конструкции ИСЭ для решения различных аналитических задач Необходимость во внутреннем водном растворе затрудняет миниатюризацию. Отсутствие внутреннего
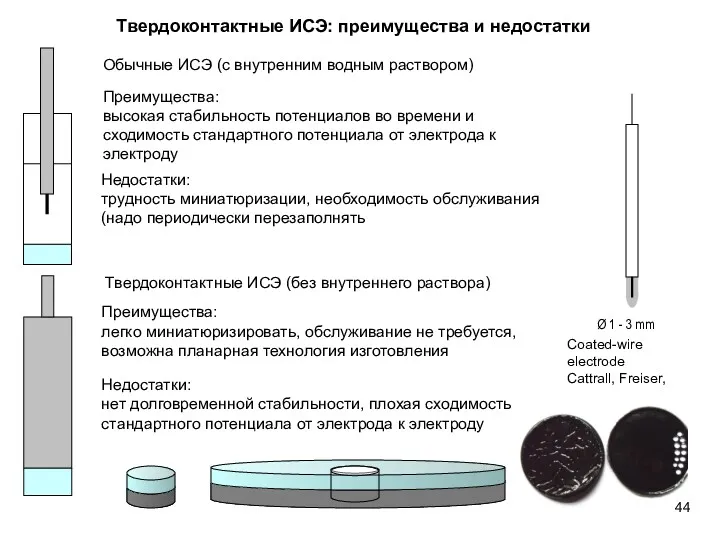
- 44. Твердоконтактные ИСЭ: преимущества и недостатки Преимущества: высокая стабильность потенциалов во времени и сходимость стандартного потенциала от
- 46. Скачать презентацию



















 Теория механизмов и машин. Кинематический анализ механизмов
Теория механизмов и машин. Кинематический анализ механизмов Презентация к Научно-исследовательской работе Физика и ВОВ
Презентация к Научно-исследовательской работе Физика и ВОВ Комплектование и балансировка деталей при ремонте АТ
Комплектование и балансировка деталей при ремонте АТ Идеальный газ. Давление газа. Средняя кинетическая энергия поступательного движения молекул. Концентрация молекул
Идеальный газ. Давление газа. Средняя кинетическая энергия поступательного движения молекул. Концентрация молекул Источники звука
Источники звука Глава 2. Сегнетоэлектрики
Глава 2. Сегнетоэлектрики Электромагнитные колебания
Электромагнитные колебания Приборы и методы радиометрических измерений
Приборы и методы радиометрических измерений Радиоактивность как свидетельство сложного строения атомов
Радиоактивность как свидетельство сложного строения атомов Исследовательская работа Посудомоечная машина
Исследовательская работа Посудомоечная машина Количество теплоты, необходимое для плавления тела и выделяющееся при нагревании
Количество теплоты, необходимое для плавления тела и выделяющееся при нагревании Самостоятельные и несамостоятельные газовые разряды
Самостоятельные и несамостоятельные газовые разряды Атомные уровни строения материи. (Лекция 5)
Атомные уровни строения материи. (Лекция 5) Дисперсия. Дифракция. Интерференция
Дисперсия. Дифракция. Интерференция Никола Тесла
Никола Тесла Электрические цепи постоянного тока
Электрические цепи постоянного тока Такты работы ДВС, сгорание+расширение (часть 2). Тема 4
Такты работы ДВС, сгорание+расширение (часть 2). Тема 4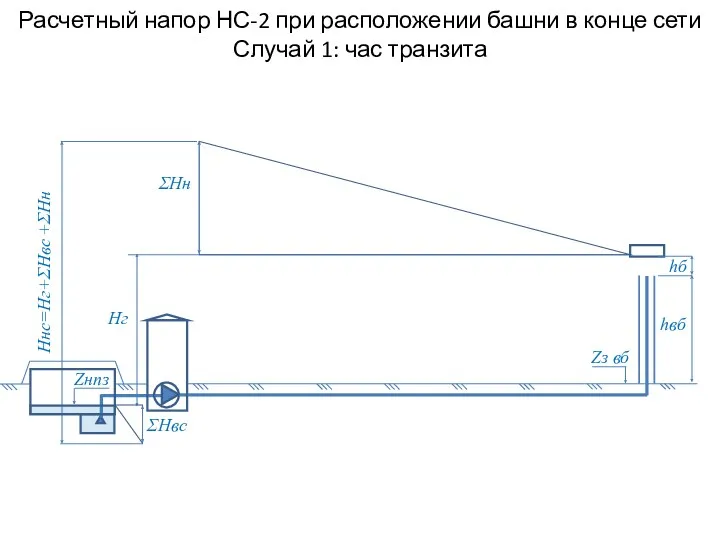 Расчетный напор НС-2 при расположении башни в конце сети. Случай 1: час транзита
Расчетный напор НС-2 при расположении башни в конце сети. Случай 1: час транзита Основы управления денежными средствами компании
Основы управления денежными средствами компании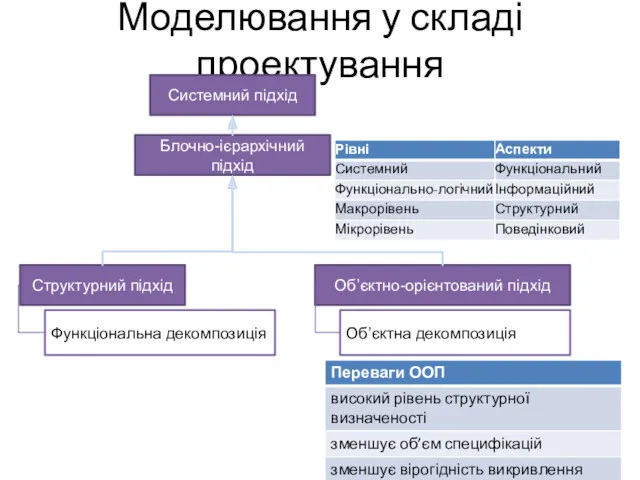 Моделювання у складі проектування
Моделювання у складі проектування Выбор напряжения внешнего и внутризаводского электроснабжения ПП
Выбор напряжения внешнего и внутризаводского электроснабжения ПП Ритмодинамика природы. Эксперимент Майкельсона и возврат эфира в науку
Ритмодинамика природы. Эксперимент Майкельсона и возврат эфира в науку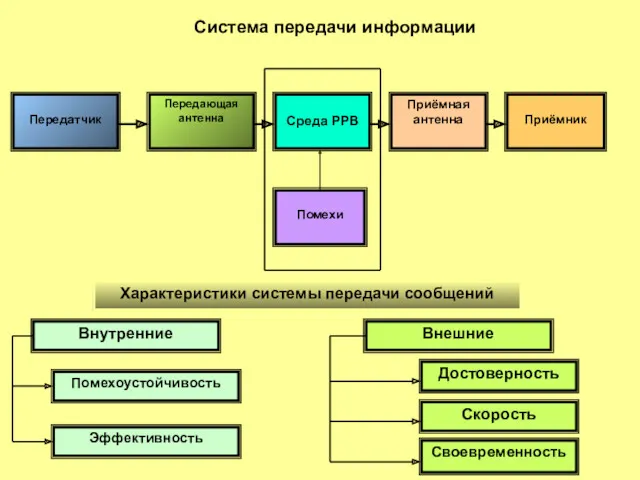 Система передачи информации
Система передачи информации Потери в электрических сетях
Потери в электрических сетях Автоматизация в современном производсве
Автоматизация в современном производсве Расчет электрического сопротивления бесконечного каркаса
Расчет электрического сопротивления бесконечного каркаса Absorption heat pumps and refrigerating machines
Absorption heat pumps and refrigerating machines Техническая термодинамика. Циклы энергетических установок. (Лекция 7)
Техническая термодинамика. Циклы энергетических установок. (Лекция 7)