Содержание
- 2. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ, ПРОТЕКАЮЩИЕ НА ЭЛЕКТРОДАХ ПРИ ПРОПУСКАНИИ ПОСТОЯННОГО ЭЛЕКТРИЧЕСКОГО ТОКА ЧЕРЕЗ РАСТВОРЫ ИЛИ РАСПЛАВЫ ЭЛЕКТРОЛИТОВ, НАЗЫВАЮТ
- 3. Катодные процессы в водных растворах электролитов :катионы или молекулы воды принимают электронов и восстанавливаются. Li,K,Ca, Mn,Zn,Fe,Ni,
- 4. Cu2+ + 2e– = Cu0 2H2O + 2e– = H2 + 2OH– Катионы металлов, расположеных в
- 5. 2. Катионы металлов начала ряда напряжений Li+, Na+, K+, Rb+, ..., до Al3+ включительно при электролизе
- 6. 3. Катионы металлов Mn2+, Zn2+, Cr3+, Fe2+, ..., до H) при электролизе на катоде восстанавливаются одновременно
- 7. На аноде происходит окисление анионов или молекул воды ( частицы отдают электронов - окисляются) Анионы по
- 8. НА АНОДЕ ОКИСЛЯЮТСЯ АНИОНЫ БЕСКИСЛОРОДНЫХ КИСЛОТ, OH– ИЛИ МОЛЕКУЛЫ ВОДЫ 2Cl– – 2e– = Cl2 2H2O
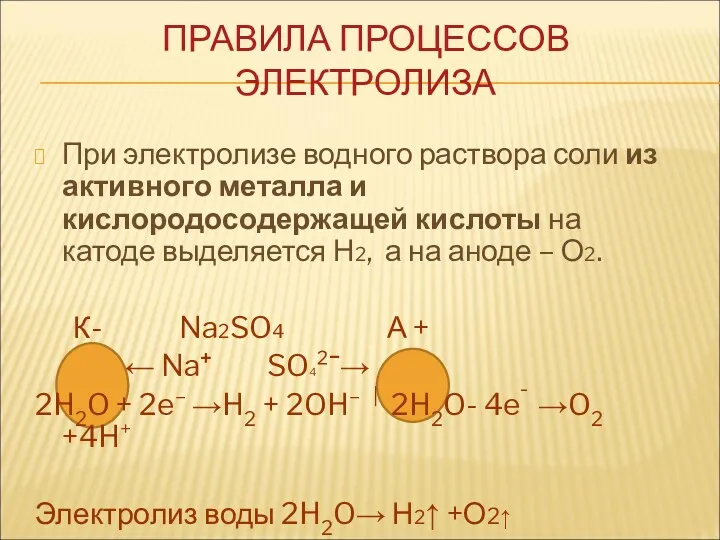
- 9. При электролизе водного раствора соли из активного металла и кислородосодержащей кислоты на катоде выделяется Н2, а
- 10. При электролизе раствора соли из активного металла и бескислородной кислоты на катоде образуется - Н2, на
- 11. При электролизе водного раствора соли из малоактивного металла и кислородосодержащей кислоты на катоде выделяется металл, а
- 12. При электролизе катиона аммония NH4+ восстанавливается вода. При электролизе солей органических кислот на катоде восстанавливается вода,
- 13. Электролиз раствора щелочи – это электролиз воды. Электролиз раствора кислородосодержащей кислоты – это тоже электролиз воды.
- 14. ЭЛЕКТРОЛИЗ РАСТВОРА NACL
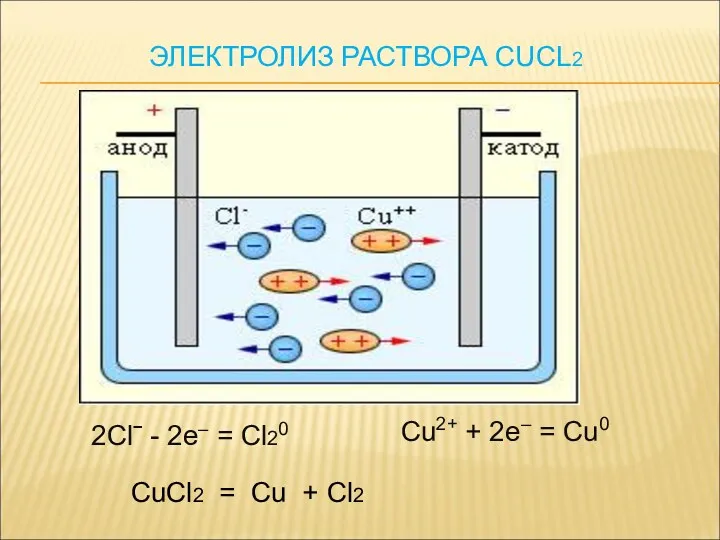
- 15. 2Clˉ - 2e– = Cl20 Cu2+ + 2e– = Cu0 CuCl2 = Cu + Cl2 ЭЛЕКТРОЛИЗ
- 16. ПРИМЕНЕНИЕ
- 17. ЗАДАНИЕ 1 Установите соответствие между формулой соли и продуктом, образующимся на катоде при электролизе её водного
- 18. ПОЯСНЕНИЕ. При электролизе солей активных металлов (от лития до алюминия включительно) вместо металлов на катоде выделяется
- 19. ЗАДАНИЕ 2 Установите соответствие между формулой соли и продуктом, образующимся на инертном аноде при электролизе её
- 20. ПОЯСНЕНИЕ При электролизе водных растворов солей, щелочей и кислот на инертном аноде: - разряжается вода и
- 21. ЗАДАНИЕ 3 Установите соответствие между формулой вещества и продуктами, образующимися на катоде при электролизе его водного
- 22. ПОЯСНЕНИЕ При электролизе водных растворов солей на катоде выделяется: - водород, если это соль металла, стоящего
- 23. ЗАДАНИЕ 4 Установите соответствие между формулой вещества и полуреакцией, протекающей на инертном аноде при электролизе его
- 25. Скачать презентацию




















 Композиционные материалы
Композиционные материалы Минералы горных пород
Минералы горных пород VIВ тобының элементтері. Хром. Хром және оның қосылыстарының қасиеттер
VIВ тобының элементтері. Хром. Хром және оның қосылыстарының қасиеттер Пластмассы, синтетические каучуки
Пластмассы, синтетические каучуки Строение атома. Периодический закон и периодическая система элементов
Строение атома. Периодический закон и периодическая система элементов Гидроксикислоты (оксикислоты)
Гидроксикислоты (оксикислоты) Хімічний зв'язок і будова речовини
Хімічний зв'язок і будова речовини Карбоновые кислоты
Карбоновые кислоты Синтетичні високомолекулярні речовини. Полімери. Реакції полімеризації і поліконденсації
Синтетичні високомолекулярні речовини. Полімери. Реакції полімеризації і поліконденсації Побочная подгруппа VIII группы периодической системы
Побочная подгруппа VIII группы периодической системы Почему протекают химические реакции
Почему протекают химические реакции Мини-тақталарда немесе дәптерде қатты, сұйық және газтектес заттардың құрылысын сал
Мини-тақталарда немесе дәптерде қатты, сұйық және газтектес заттардың құрылысын сал Кристаллические решетки
Кристаллические решетки Бета-окисление жирных кислот
Бета-окисление жирных кислот Воздух и его состав. Урок-презентация. 8 класс
Воздух и его состав. Урок-презентация. 8 класс Топлива и их свойства
Топлива и их свойства Основные классы неорганических соединений
Основные классы неорганических соединений Олимпиадные задачи муниципального этапа по химии
Олимпиадные задачи муниципального этапа по химии Сероводород. Сульфиды
Сероводород. Сульфиды Метаболизм кетоновых тел. Метаболизм холестерина
Метаболизм кетоновых тел. Метаболизм холестерина Аналитическая химия и химический анализ. (Лекция 1)
Аналитическая химия и химический анализ. (Лекция 1) 20230316_otkrytyy_urok_v_8_kl_geneticheskaya_svyaz.docx
20230316_otkrytyy_urok_v_8_kl_geneticheskaya_svyaz.docx Углеводы. Урок по химии для 9 класса
Углеводы. Урок по химии для 9 класса Қатты оттын және оның түрлері
Қатты оттын және оның түрлері Получение азотной кислоты
Получение азотной кислоты Химический состав нефтей. Циклические соединения
Химический состав нефтей. Циклические соединения Пластмаси та їх роль у сучасному виробництві
Пластмаси та їх роль у сучасному виробництві Побочная подгруппа. 8 группы
Побочная подгруппа. 8 группы