Содержание
- 2. Элементы главной подгруппы IV группы: углерод С, кремний Si, германий Ge, олово Sn, свинец Pb недавно
- 3. Элементы С Si Ge Sn Pb Строение внешней электронной оболочки: 2S22P2 3S23P2 4S24P2 5S25P2 6S26P2 Энергия
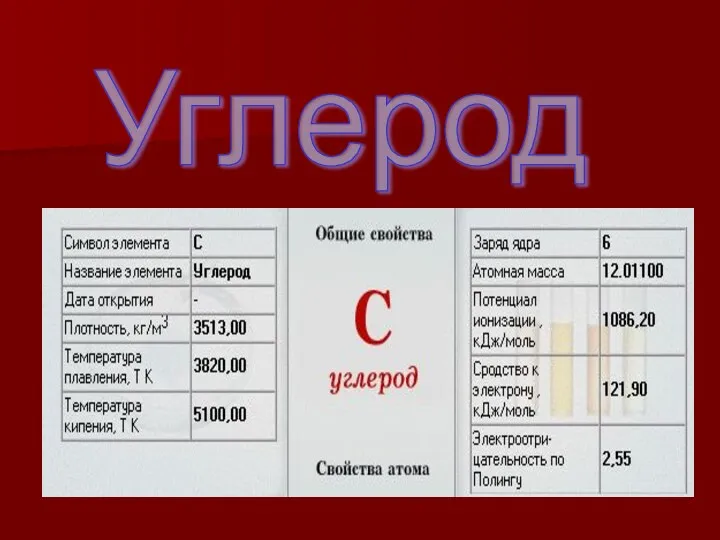
- 4. Углерод
- 5. Аллотропные модификации углерода алмаз графит карбин
- 6. Кристаллическая решетка - атомная. У атома углерода - sp3-гибридизация. Алмаз имеет высокую твердость, плотность 3,5г/см2, плохо
- 7. Видоизменения графита - кокс, сажа, древесный уголь. Углерод в графите находится в состоянии sp2–гибридизации. Графит -
- 8. Химические свойства углерода С+O2=СO2 (оксид) 2С+N2=С2N2 (циан) С+2S=СS2(сероуглерод) С+2H2=СH4 (метан) С+Si=SiC (карборунд) 3C + 4Al =
- 9. Адсорбция - свойство угля и других твёрдых веществ удерживать на своей поверхности пары, газы и растворённые
- 10. Нахождение в природе Свободный углерод находится в природе в виде алмаза и графита. Основная масса углерода
- 11. Природные карбонаты кальция и магния мел мрамор известняк доломит
- 12. битум Горючие ископаемые торф нефть природный газ антрацит каменный уголь
- 13. ШУНГИТ Шунгит (содержит углерод и оксид кремния)
- 14. Кремний
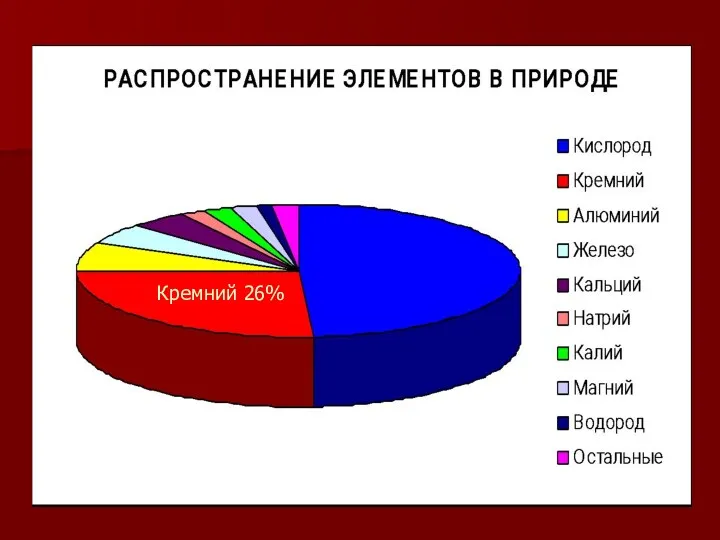
- 15. Кремний 26%
- 16. Нахождение в природе Кремний в природе содержится в минералах в виде оксида SiO2 (кремнезем). Общее число
- 17. Горный хрусталь Опал Разновидности кремнезёма
- 18. Халцедон Яшма – загрязненный кремнезем
- 19. Разновидности кремнезёма цитрин агат Окраска цитринов обусловлена присутствием примесей трехвалентного железа
- 20. Особенности окраски обусловлены присутствием минерала гематита Разновидности кремнезёма Сердолик Сардоникс (оникс)
- 21. Хризопраз (содержит никель) Разновидности кремнезёма Цвет аметиста обусловлен примесью органического красящего вещества.
- 22. Алюмосиликаты Полевой шпат Слюда К2O∙Al2O3∙6SiO2
- 23. Хризолит Ортосиликат железа-магния (Mg,Fe)2SiO4
- 24. Из кремнезема восстанавлением магнием или углеродом : SiO2+2Mg = Si+2MgO SiO2+С = Si+СО2 При разложении силана:
- 25. Химические свойства Si В реакциях с неметаллами кремний окисляется: Si + O2 = SiO2 Si +
- 26. Стекло – аморфный сплав. Имеет только ближний порядок, не имеет четких температур плавления и кипения. Сырьем
- 27. Применение
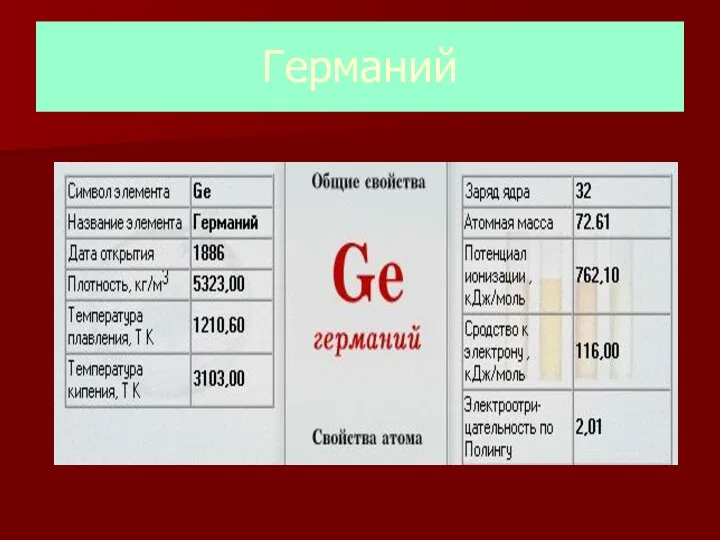
- 28. Германий
- 29. Собственные минералы германия встречаются исключительно редко. Германий встречается с рудами цинка, олова, свинца, присутствует почти во
- 30. Вначале получают четыреххлористый германий GeCl4 , который растворяют в воде : GeCl4 + H2O = GeO2
- 31. Химические свойства При нормальных условиях устойчив к действию воздуха и воды, щелочей и кислот. При нагревании
- 32. Применение находят сплавы германия и стёкла на основе диоксида германия. Применение Полупроводниковая техника Дозиметрические приборы Инфракрасная
- 33. Олово и свинец
- 34. В природе олово и свинец обычно встречаются в виде: SnO2 – кассетерит, PbS – свинцовый блеск.
- 35. Химические свойства 1. При нагревании реагируют с кислородом, серой, хлором, не реагируют с водородом, углеродом, азотом.
- 36. Применение олова Безопасное, нетоксичное, коррозионностойкое покрытие. В белой жести (лужёное железо) для изготовления тары пищевых продуктов.
- 38. Скачать презентацию
































 Карбоновые кислоты. 10 класс
Карбоновые кислоты. 10 класс Взаимодействие кислоты с основанием (реакция нейтрализации)
Взаимодействие кислоты с основанием (реакция нейтрализации)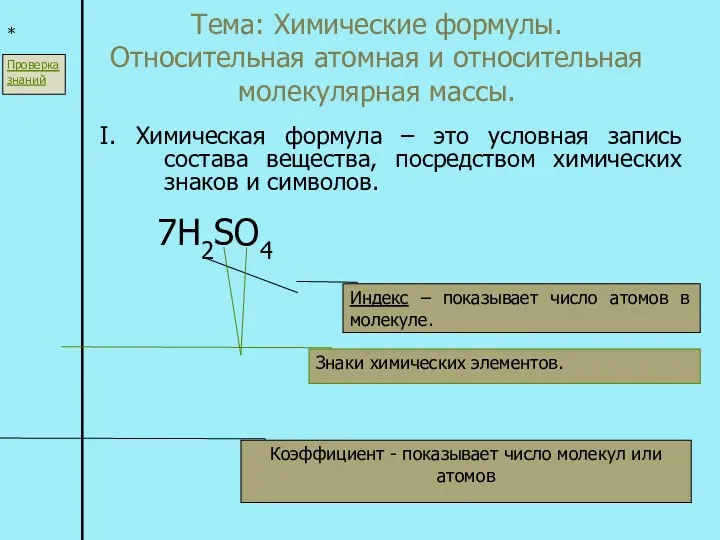 Химические формулы. Относительная атомная и относительная молекулярная массы
Химические формулы. Относительная атомная и относительная молекулярная массы Автомобильные пластичные смазки
Автомобильные пластичные смазки Кристаллы. Кристаллические вещества
Кристаллы. Кристаллические вещества Периодическая система химических элементов Д.И. Менделеева. Строение атома
Периодическая система химических элементов Д.И. Менделеева. Строение атома Витаминдер. Витаминдердің классификациясы. Алиментарлы және екіншілік авитаминоздар. Гипервитаминоздар
Витаминдер. Витаминдердің классификациясы. Алиментарлы және екіншілік авитаминоздар. Гипервитаминоздар Приготовление растворов с определенной массовой долей растворенного вещества. Практическая работа
Приготовление растворов с определенной массовой долей растворенного вещества. Практическая работа Полимеры органические и неорганические
Полимеры органические и неорганические Лабораторна робота. Властивості амінів
Лабораторна робота. Властивості амінів Электролиз
Электролиз Роль химии в современной цивилизации
Роль химии в современной цивилизации Углеводородное сырье: способы переработки
Углеводородное сырье: способы переработки Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы
Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы Осмий. Нахождение в природе
Осмий. Нахождение в природе Альдегиды и кетоны
Альдегиды и кетоны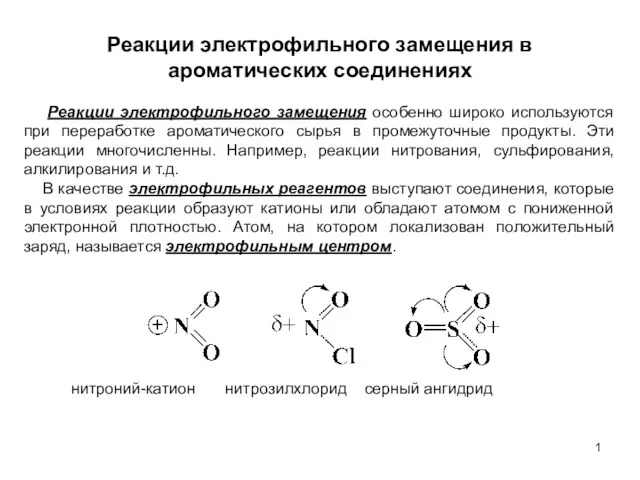 Реакции электрофильного замещения в ароматических соединениях. (Лекция 6)
Реакции электрофильного замещения в ароматических соединениях. (Лекция 6) Триглицериды. Липиды. Средства ухода за кожей. Лекция 3. Индустрия красоты
Триглицериды. Липиды. Средства ухода за кожей. Лекция 3. Индустрия красоты Ауыл шаруашылығындағы минералды. Тыңайтқыш-азық-түліктегі нитраттар
Ауыл шаруашылығындағы минералды. Тыңайтқыш-азық-түліктегі нитраттар Тепловий ефект хімічних реакцій. Екзотермічні ї ендотермічні реакції термохімічні рівняння
Тепловий ефект хімічних реакцій. Екзотермічні ї ендотермічні реакції термохімічні рівняння Осадочные и метаморфические горные породы
Осадочные и метаморфические горные породы Объемная доля компонента газовой смеси
Объемная доля компонента газовой смеси Органічна хімія
Органічна хімія Первичная переработка нефти
Первичная переработка нефти Nuclear Energy, Controlled Fission and Fusion 2016
Nuclear Energy, Controlled Fission and Fusion 2016 Гидроксикислоты (оксикислоты)
Гидроксикислоты (оксикислоты) Лекция 3. Протолитические равновесия и процессы
Лекция 3. Протолитические равновесия и процессы Карбоновые кислоты и их функциональные производные. Хроматографические методы исследования
Карбоновые кислоты и их функциональные производные. Хроматографические методы исследования