Содержание
- 2. Оксиди одержують переважно окисненням простих або складних речовин киснем а також розкладом нестійких основ, кисневмісних кислот
- 3. Солетвірні оксиди поділяються на основні, кислотні та амфотерні. оксиди металів в нижчих ступенях окиснення (+1,+2, рідше
- 4. 3. Кислоти Кислотами називають водневмісні сполуки, які здатні заміща- ти водень на метал з утворенням солі.
- 5. Безкисневі кислоти переважно одержують взаємодією водню з неметалом і наступним розчиненням продукту взаємодії у воді: H2
- 6. 4. Основи Основами називають гідрати основних оксидів. Основи складаються з металу і гідроксильних груп –ОН, число
- 7. Розчинні основи (луги) можна одержувати взаємодією лужного або лужноземельного металів або їх оксидів з водою: 2
- 9. Скачать презентацию






 Химические формулы
Химические формулы От алхимии к химии
От алхимии к химии Фенол и его свойства. (10 класс)
Фенол и его свойства. (10 класс) Introduction to Biochemistry
Introduction to Biochemistry Көмірсулар Қайталау сабағы
Көмірсулар Қайталау сабағы Свойства и биологическая роль карбонильных соединений
Свойства и биологическая роль карбонильных соединений 20231011_8_klass_binarnye_soedineniya
20231011_8_klass_binarnye_soedineniya Маңызды мұнай өнімдері
Маңызды мұнай өнімдері Предмет органической химии. 9 класс
Предмет органической химии. 9 класс Алкены – непредельные углеводороды. Получение, химические свойства и применение
Алкены – непредельные углеводороды. Получение, химические свойства и применение Методика изучения и описание вулканогенных обломочных пород
Методика изучения и описание вулканогенных обломочных пород Коллигативные свойства растворов неэлектролитов
Коллигативные свойства растворов неэлектролитов Высокомолекулярные соединения. Общие понятия
Высокомолекулярные соединения. Общие понятия Жуғыш заттардың адам өміріндегі маңызы. Химиялық өнімдердің адам өміріндері маңызы
Жуғыш заттардың адам өміріндегі маңызы. Химиялық өнімдердің адам өміріндері маңызы Дефекты в твердых телах
Дефекты в твердых телах Степень окисления. Определение степени окисления в соединениях
Степень окисления. Определение степени окисления в соединениях Амфотерность
Амфотерность Жиры (триглицериды)
Жиры (триглицериды) Состав, строение и свойства стекла и хрусталя
Состав, строение и свойства стекла и хрусталя Тема 11 -Дисперсные системы
Тема 11 -Дисперсные системы Кристаллическое строение и кристаллизация металлов
Кристаллическое строение и кристаллизация металлов Агрегатные состояния вещества с точки зрения атомно-молекулярных представлений
Агрегатные состояния вещества с точки зрения атомно-молекулярных представлений Медь и её соединения
Медь и её соединения Оксиды
Оксиды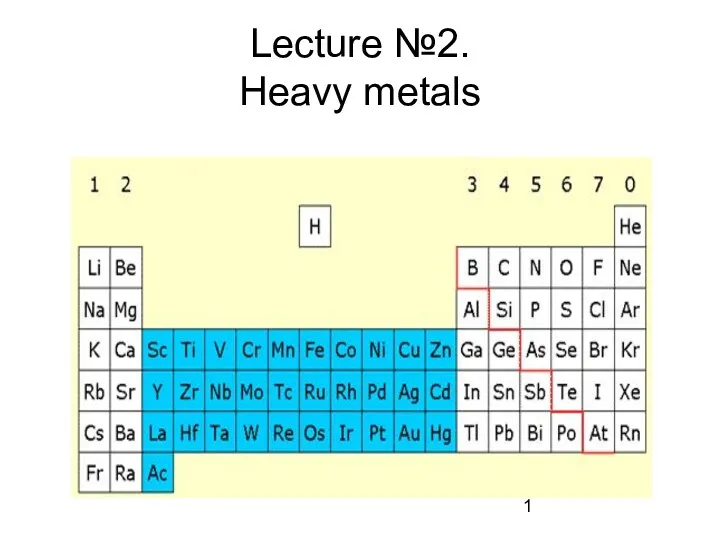 Heavy metals
Heavy metals Хром
Хром Биологическая химия (введение)
Биологическая химия (введение) Арены. Бензол
Арены. Бензол