Содержание
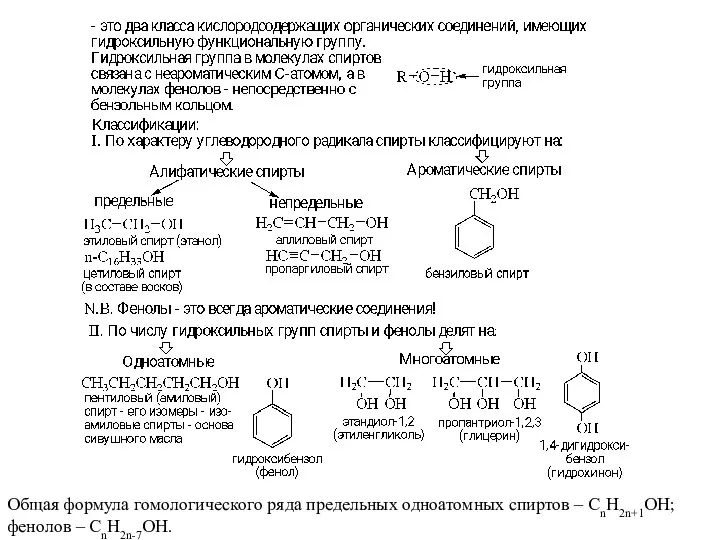
- 2. Общая формула гомологического ряда предельных одноатомных спиртов – СnH2n+1OH; фенолов – CnH2n-7OH.
- 3. Номенклатура. Спирты называют от соответствующих углеводородов с окончанием «ол». Цифрой указывают номер С-атома, при котором находится
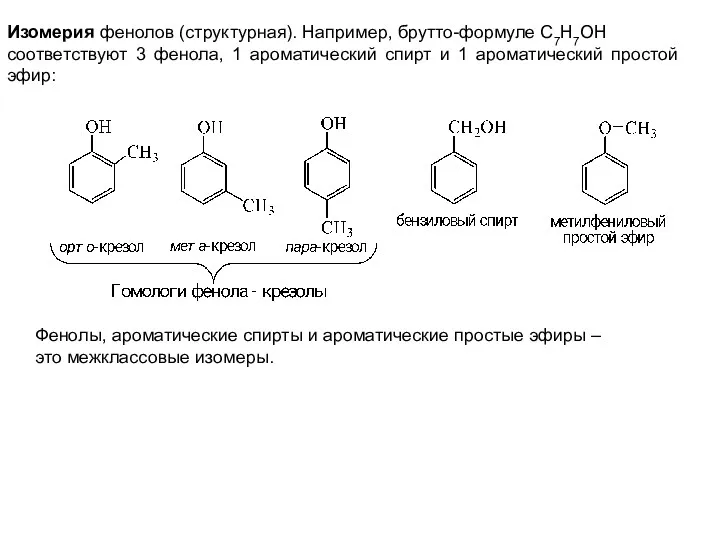
- 4. Изомерия фенолов (структурная). Например, брутто-формуле С7Н7OН соответствуют 3 фенола, 1 ароматический спирт и 1 ароматический простой
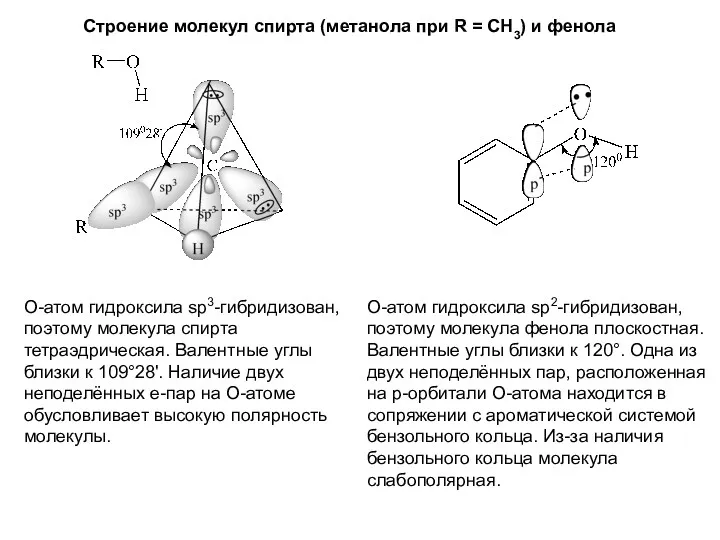
- 5. Строение молекул спирта (метанола при R = CH3) и фенола О-атом гидроксила sp3-гибридизован, поэтому молекула спирта
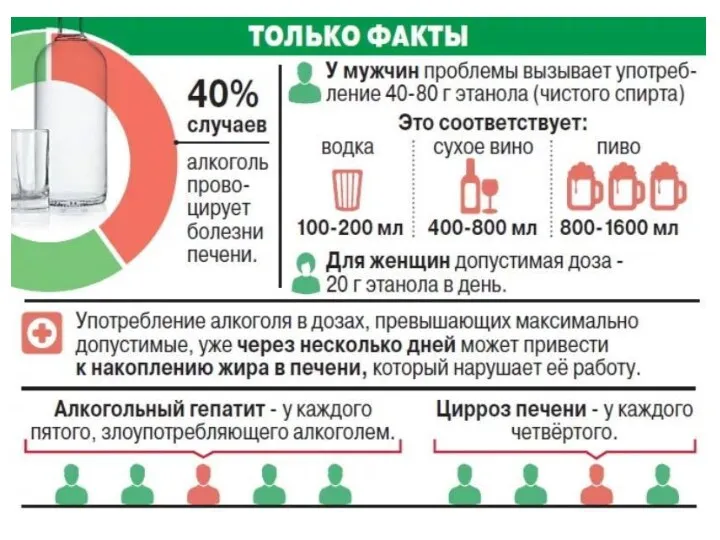
- 6. Физические свойства. Спирты (С1-С11) – жидкости, начиная с С12 – кристаллические вещества. Фенол и его низшие
- 8. Химические свойства. Спирты - амфотерные соединения, так как могут проявлять как свойства кислот, так и свойства
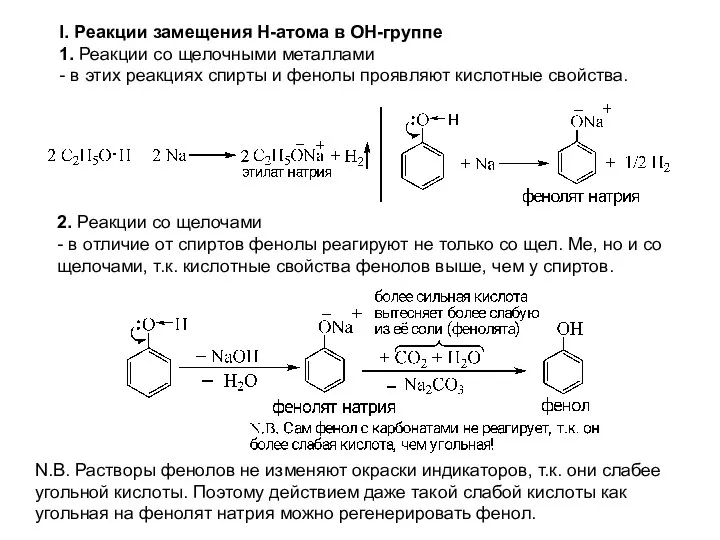
- 9. I. Реакции замещения Н-атома в ОН-группе 1. Реакции со щелочными металлами - в этих реакциях спирты
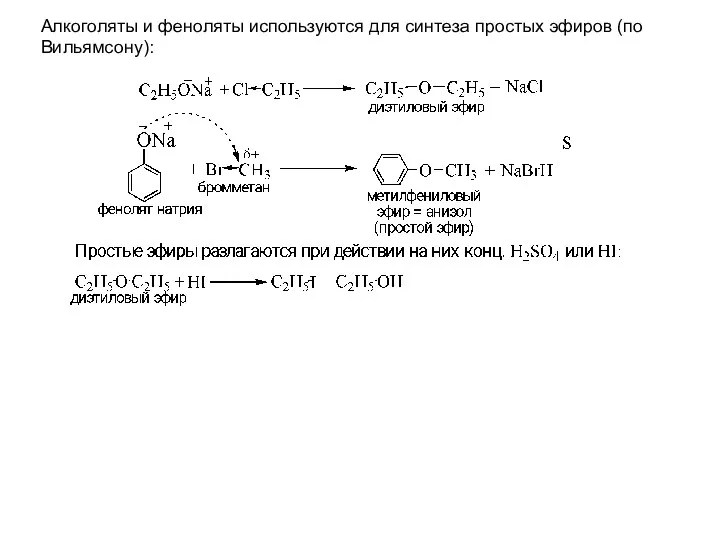
- 10. Алкоголяты и феноляты используются для синтеза простых эфиров (по Вильямсону):
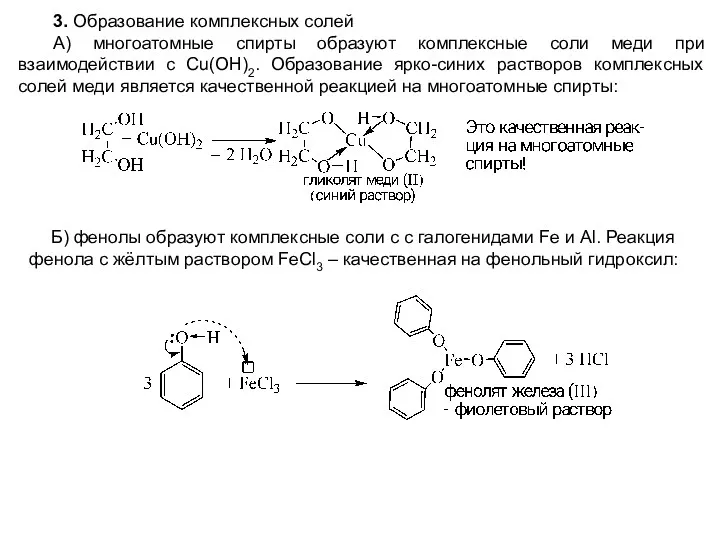
- 11. 3. Образование комплексных солей А) многоатомные спирты образуют комплексные соли меди при взаимодействии с Cu(OН)2. Образование
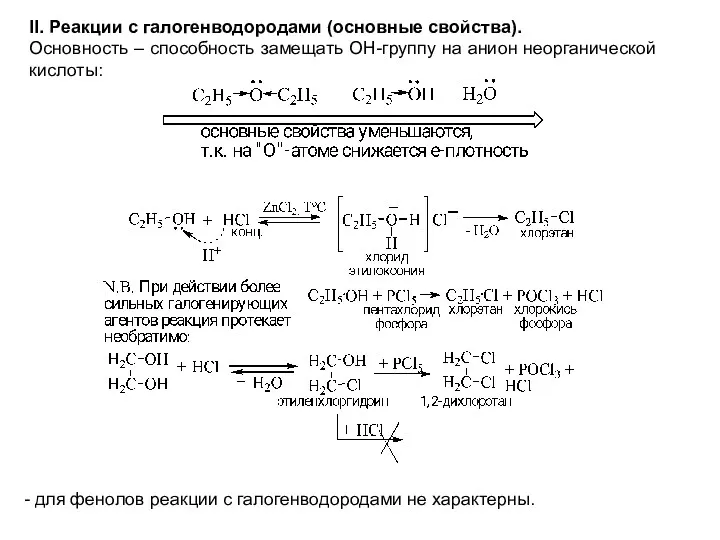
- 12. II. Реакции с галогенводородами (основные свойства). Основность – способность замещать ОН-группу на анион неорганической кислоты: -
- 13. III. Этерификация спиртов неорганическими и органическими кислотами: А) спирт + кислородсодержащая неорганическая кислота Б) спирт +
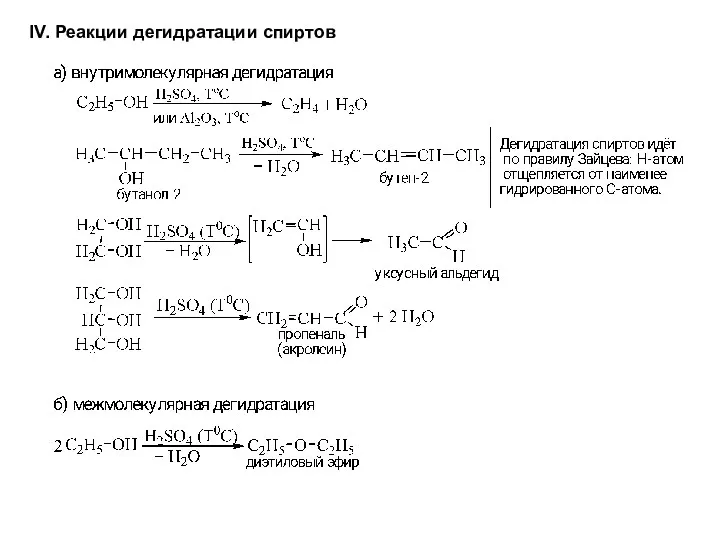
- 14. IV. Реакции дегидратации спиртов
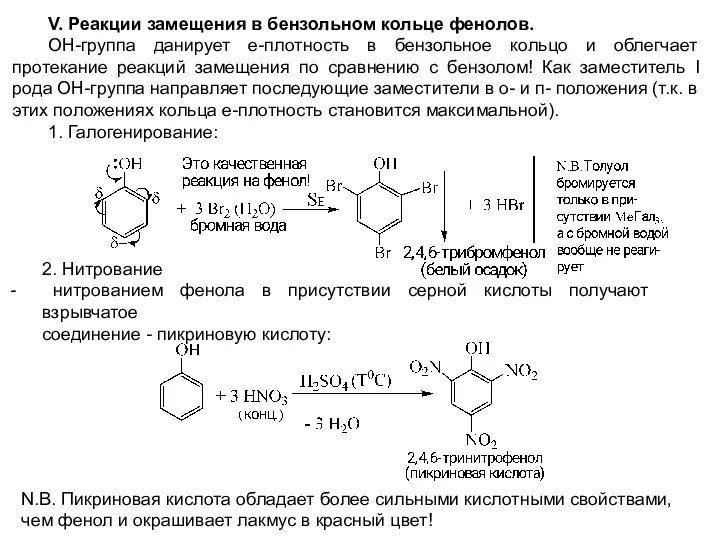
- 15. V. Реакции замещения в бензольном кольце фенолов. ОН-группа данирует е-плотность в бензольное кольцо и облегчает протекание
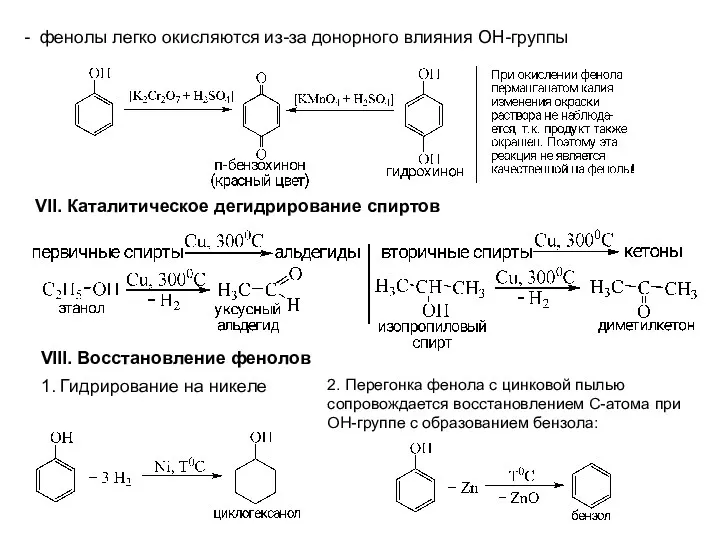
- 16. VI. Окисление спиртов и фенолов
- 17. - фенолы легко окисляются из-за донорного влияния ОН-группы VII. Каталитическое дегидрирование спиртов VIII. Восстановление фенолов 1.
- 18. Получение и применение спиртов и фенолов. I. Получение спиртов 1. Общие способы получения а) Гидратация алкенов
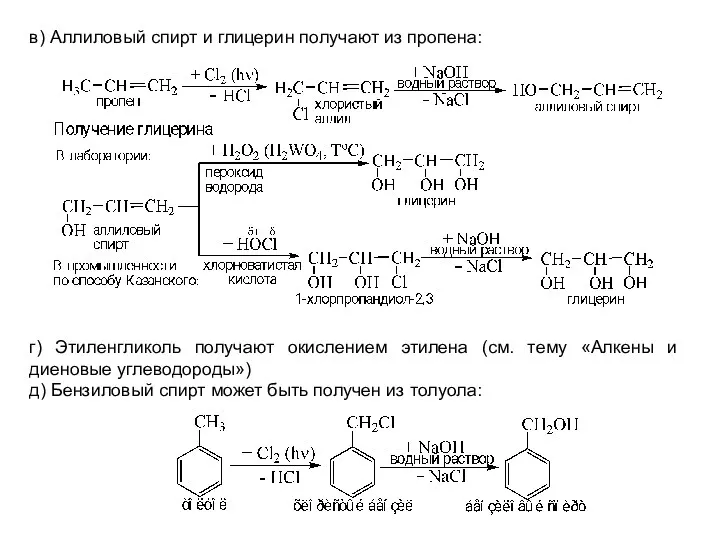
- 19. в) Аллиловый спирт и глицерин получают из пропена: г) Этиленгликоль получают окислением этилена (см. тему «Алкены
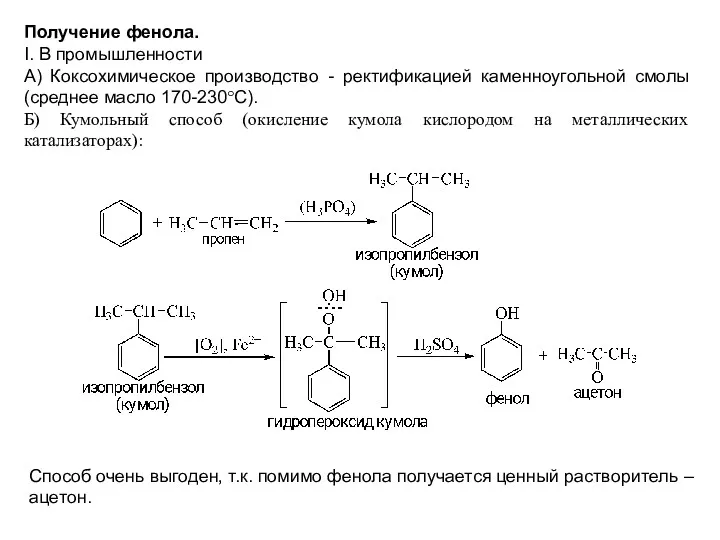
- 20. Получение фенола. I. В промышленности А) Коксохимическое производство - ректификацией каменноугольной смолы (среднее масло 170-230°С). Б)
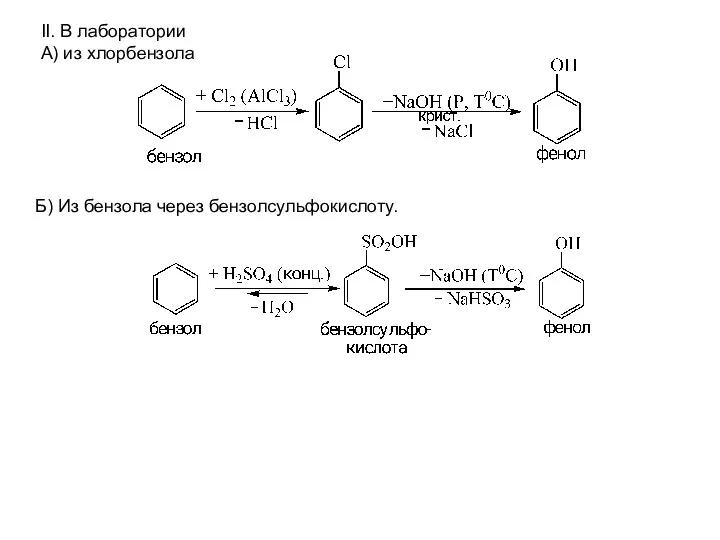
- 21. II. В лаборатории А) из хлорбензола Б) Из бензола через бензолсульфокислоту.
- 23. Скачать презентацию






 Органикалық қышқылдарды алу. Тамақ өнеркәсібіндегі органикалық қышқылдардың тәжірибелік мәні
Органикалық қышқылдарды алу. Тамақ өнеркәсібіндегі органикалық қышқылдардың тәжірибелік мәні Чистые вещества и смеси
Чистые вещества и смеси Проект познавательно-исследовательской деятельности. Удивительная соль
Проект познавательно-исследовательской деятельности. Удивительная соль Нұсқа талдау
Нұсқа талдау Обмен липидов
Обмен липидов Кислоты, их классификация и свойства
Кислоты, их классификация и свойства Подготовка к ГИА. А14. Определение характера среды раствора кислот и щелочей с помощью индикаторов. Реакции на ионы в растворе
Подготовка к ГИА. А14. Определение характера среды раствора кислот и щелочей с помощью индикаторов. Реакции на ионы в растворе Производство серной кислоты контактным способом
Производство серной кислоты контактным способом Состав веществ. Причины многообразия веществ
Состав веществ. Причины многообразия веществ Протолитические равновесия и процессы. Лекция 3
Протолитические равновесия и процессы. Лекция 3 Технология выращивания кристаллов методом Чохральского
Технология выращивания кристаллов методом Чохральского Азот и его соединения. Повторение
Азот и его соединения. Повторение Пайдалы қазба
Пайдалы қазба Физические свойства минералов
Физические свойства минералов Хинолин және хинуклидин, 4- жағдайда алмасқан хинолин туындыларының дәрілік заттарын талдау
Хинолин және хинуклидин, 4- жағдайда алмасқан хинолин туындыларының дәрілік заттарын талдау Чистые вещества и смеси
Чистые вещества и смеси Рождение органической химии
Рождение органической химии Азотные удобрения
Азотные удобрения Алкандар. Метан молекуласының құрылысы Метан және оның гомологтарының қасиеттері
Алкандар. Метан молекуласының құрылысы Метан және оның гомологтарының қасиеттері Строение вещества. Строение атома и периодическая система элементов
Строение вещества. Строение атома и периодическая система элементов Водород. Строение, свойства, получение, применение
Водород. Строение, свойства, получение, применение Кремний и его соединения
Кремний и его соединения Маңызды химиялық өндірістер
Маңызды химиялық өндірістер Дефекты в твердых телах
Дефекты в твердых телах Хлор (лат. Chlorum, Cl)
Хлор (лат. Chlorum, Cl) Процессы нитрования
Процессы нитрования Синтетические моющие средства, порошки, омыление, выпадение в осадок мыла, жиров
Синтетические моющие средства, порошки, омыление, выпадение в осадок мыла, жиров Основные классы неорганических соединений
Основные классы неорганических соединений