Содержание
- 2. План 1. Электродные потенциалы и механизм их возникновения. 2. Уравнение Нернста. 3. Потенциометрия. Электроды, применяемые для
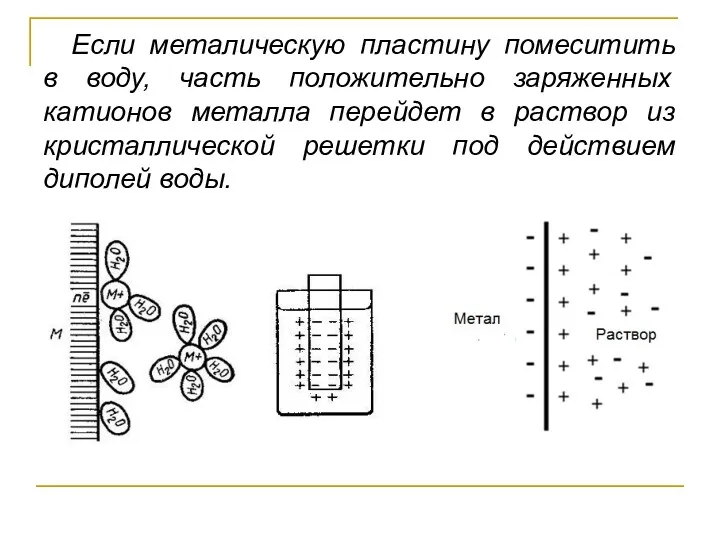
- 3. Если металическую пластину помеситить в воду, часть положительно заряженных катионов металла перейдет в раствор из кристаллической
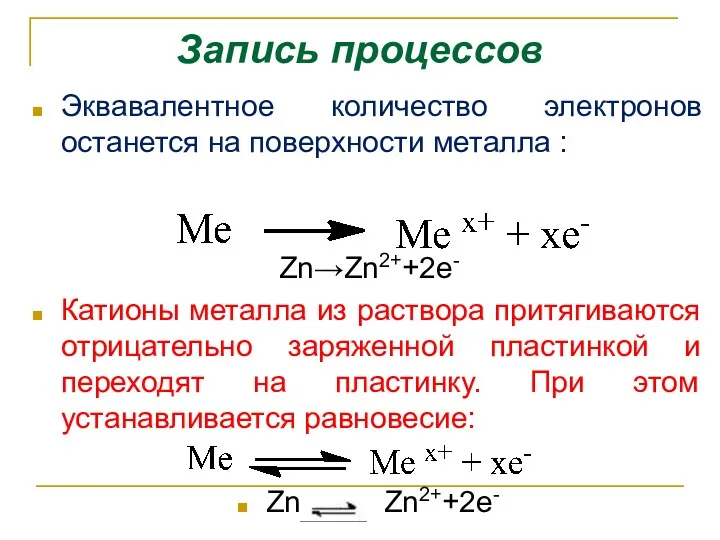
- 4. Запись процессов Эквавалентное количество электронов останется на поверхности металла : Zn→Zn2++2e- Катионы металла из раствора притягиваются
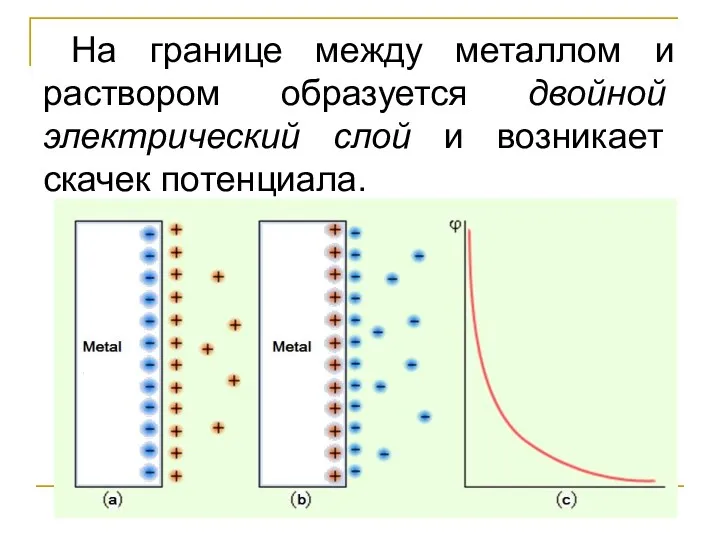
- 5. На границе между металлом и раствором образуется двойной электрический слой и возникает скачек потенциала.
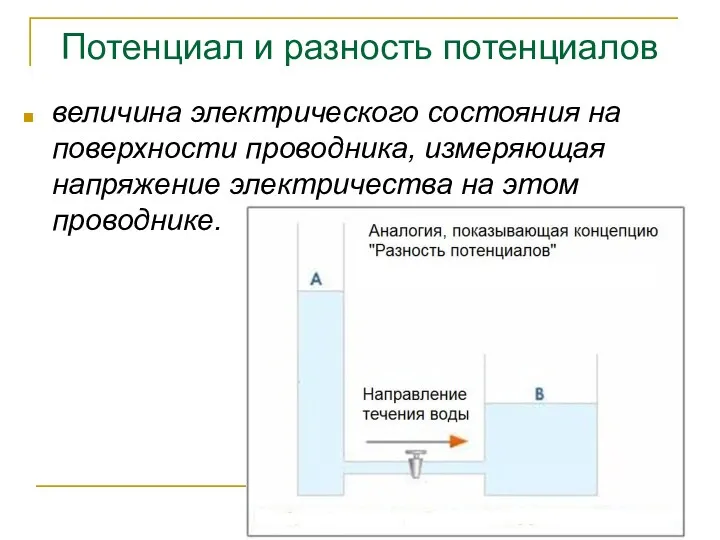
- 6. Потенциал и разность потенциалов величина электрического состояния на поверхности проводника, измеряющая напряжение электричества на этом проводнике.
- 7. Аналогия между разностью потенциалов и разностью температур
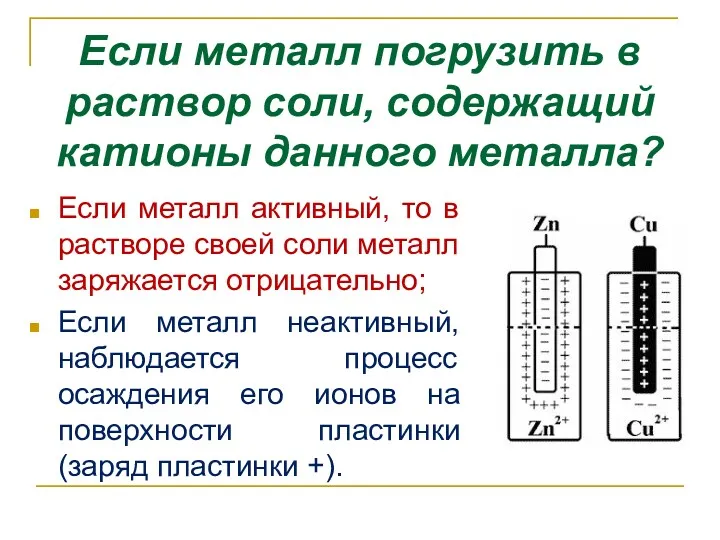
- 8. Если металл погрузить в раствор соли, содержащий катионы данного металла? Если металл активный, то в растворе
- 9. Уравнение Нернста
- 10. Уравнение Нернста. Для электродов, обратимых относительно катиона, это уравнение выглядит так: Для электродов, обратимых относительно аниона,
- 11. Переход от наутурального к десятичному логарифму (при 25°С) ⇒
- 12. Потенциометрия. Физико-химический метод исследования, основанный на измерении ЭДС. Достоинства метода: ∙ возможность определения различных физико-химических характеристик;
- 13. Электроды Электродом называют проводник, погруженный в раствор электролита Запись электрода: Cu │ Cu 2+ , Ag
- 14. Электроды первого рода. Их потенциалы обратимы обратимы относительно катиона или аниона элемента из которого состоит электрод
- 15. Водородный электрод. Разновидностью электродов первого рода являются газовые электроды. Наиболее важный представитель – водородный электрод, с
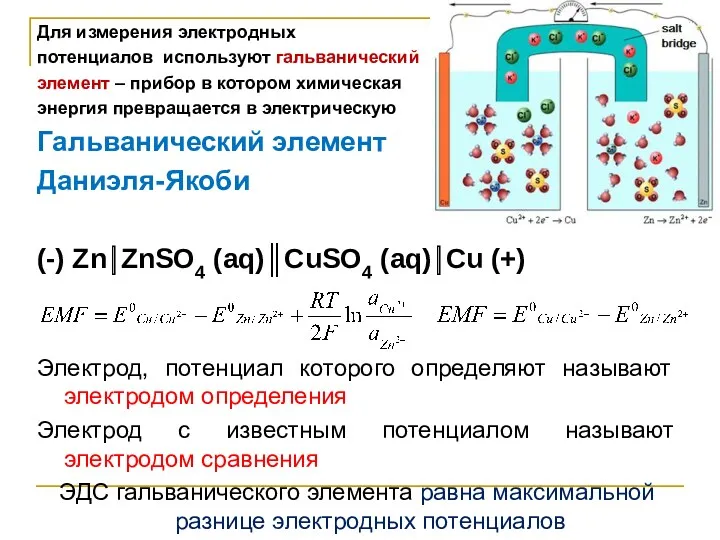
- 16. Для измерения электродных потенциалов используют гальванический элемент – прибор в котором химическая энергия превращается в электрическую
- 17. Электроды второго рода. Их потенциалы обратимы относительно анионов, образующих с катионом металла электрода малорастворимый осадок Электроды,
- 18. Хлорсеребряный электрод Представляет собой серебряную проволоку (1), покрытую слоем AgCl (2) и опущенную в раствор KCl
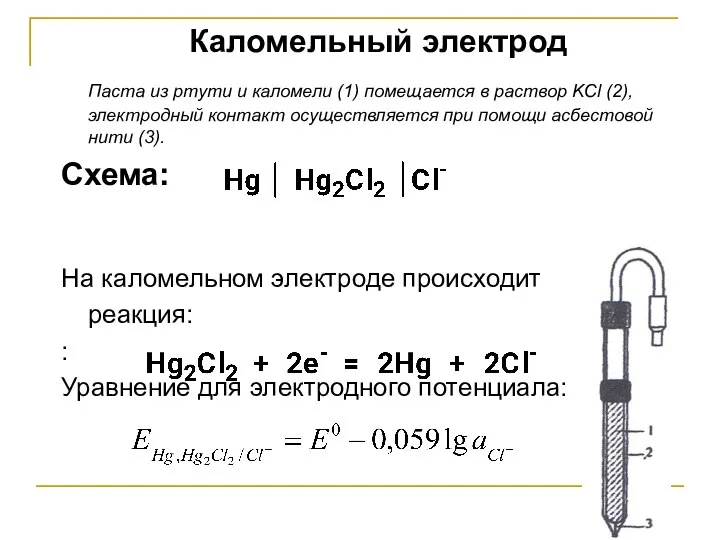
- 19. Каломельный электрод Паста из ртути и каломели (1) помещается в раствор KCl (2), электродный контакт осуществляется
- 20. Редокс-электроды Электроды, состоящие из инертных электродов первого рода, погруженных в раствор электролита, в которых содержатся однотипные
- 21. Хингидронный электрод Состоит из платиновой пластинки, погруженной в насы-щенный раствор хингидрона. Схема: На хингидронном электроде протекает
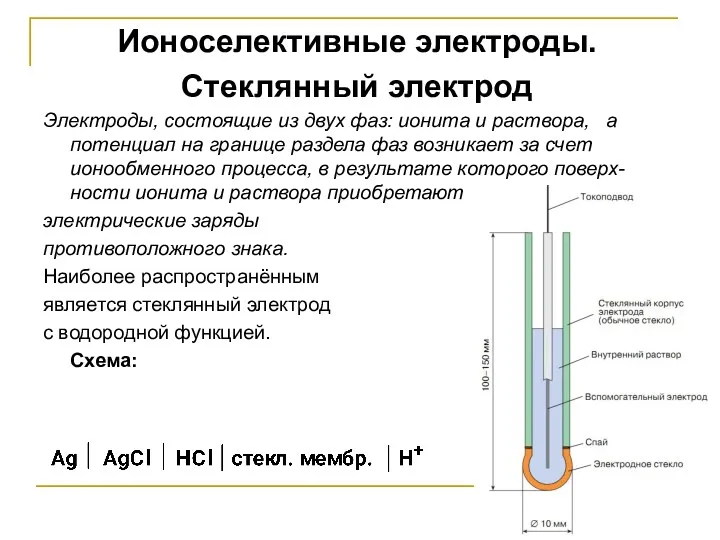
- 22. Ионоселективные электроды. Стеклянный электрод Электроды, состоящие из двух фаз: ионита и раствора, а потенциал на границе
- 23. Применение стеклянного электрода основано на том, что стекло содержит катионы, которые могут обмениваться с катионами, находящимися
- 24. Пара электродов для измерения рН Хлорсеребряный Стеклянный
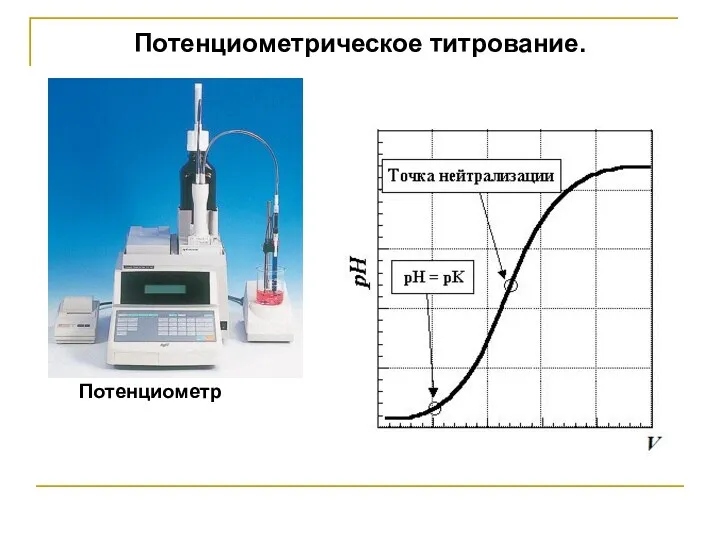
- 25. Потенциометрическое титрование. Основано на резком изменении потенциала ин-дикаторного электрода в момент достижения точки эквивалентности. Для проведения
- 26. Потенциометрическое титрование. Потенциометр
- 27. Диффузионный и мембранный потенциалы. Природа биопотенциалов.
- 28. Разность потенциалов на границе между растворами с различным составом или концентрацией называют диффузионным потенциалом. Если растворы
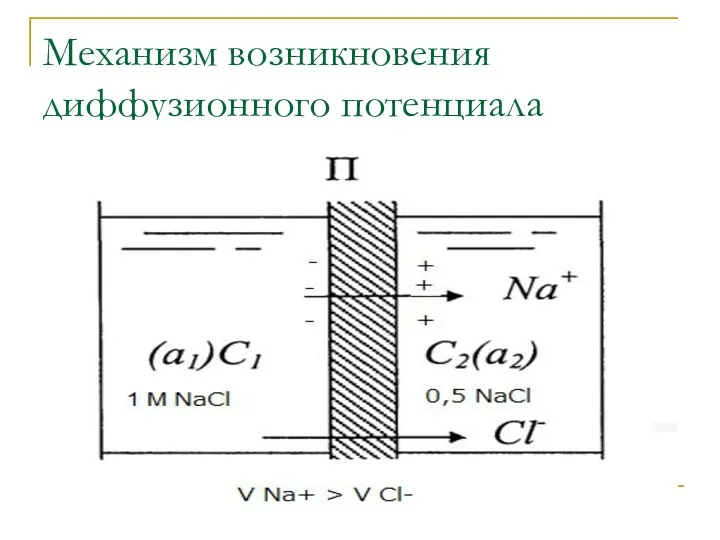
- 29. Механизм возникновения диффузионного потенциала
- 30. При соприкосновении растворов разных концентраций растворённое вещество диффундирует в раствор с меньшей концентрацией. Если диффундирующие ионы
- 31. Мембранный потенциал Диффузионный потенциал может сильно возрасти, если растворы электролитов разных концентраций разделить мембраной, проницаемой только
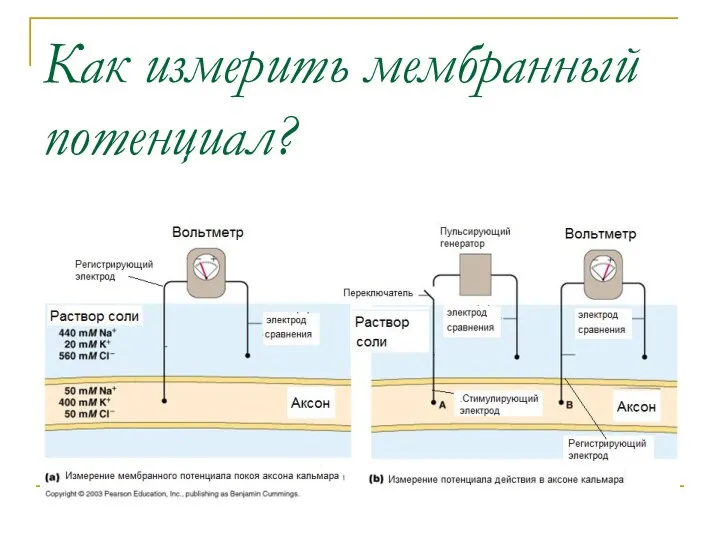
- 32. Как измерить мембранный потенциал?
- 33. Разность концентраций ионов
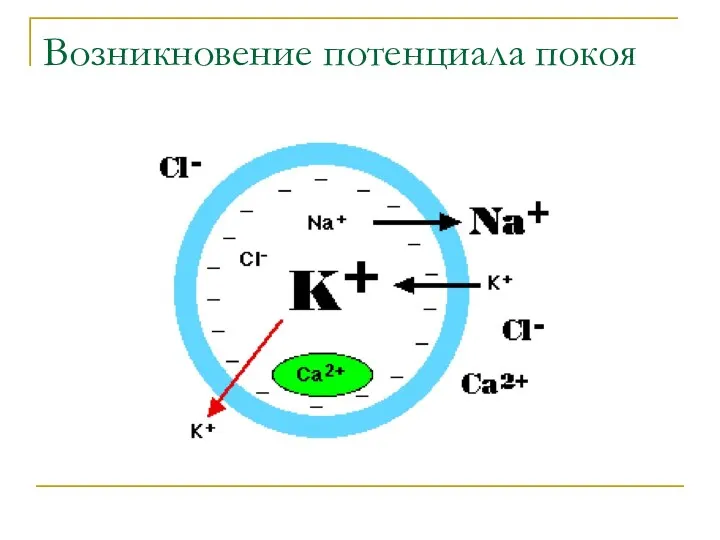
- 34. Возникновение потенциала покоя
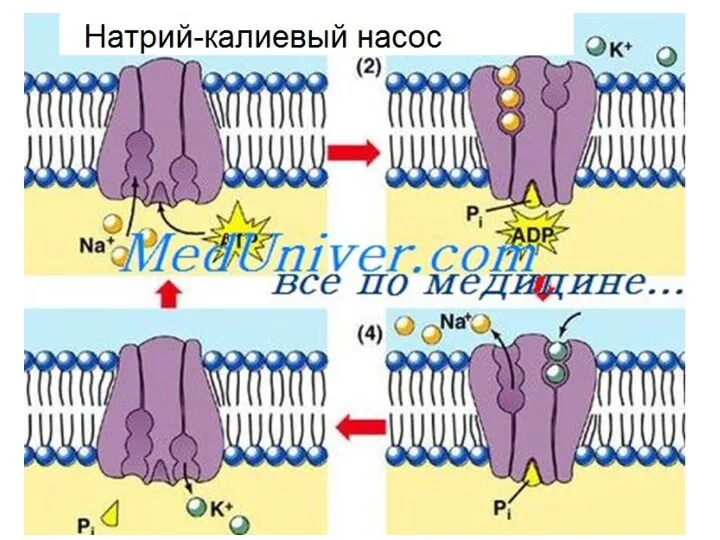
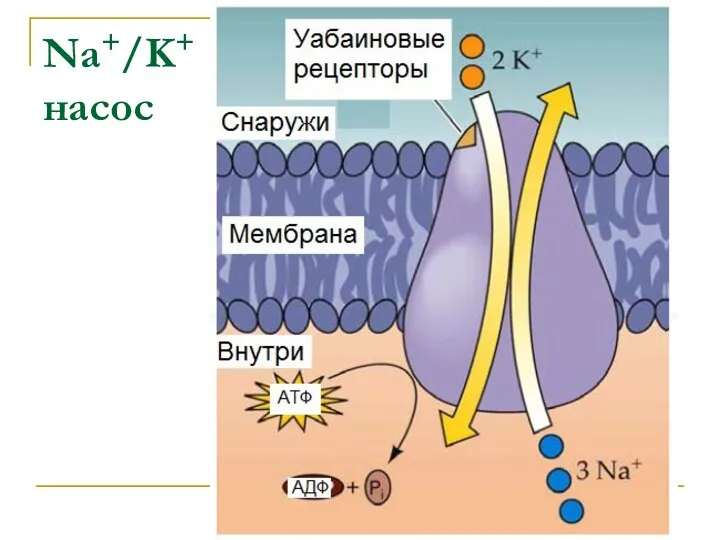
- 35. 1. Na+/K+ транспортер (ATФ зависимый насос) – активный транспорт(против градиента). ? Два иона K+ поступают в
- 37. Na+/K+ насос
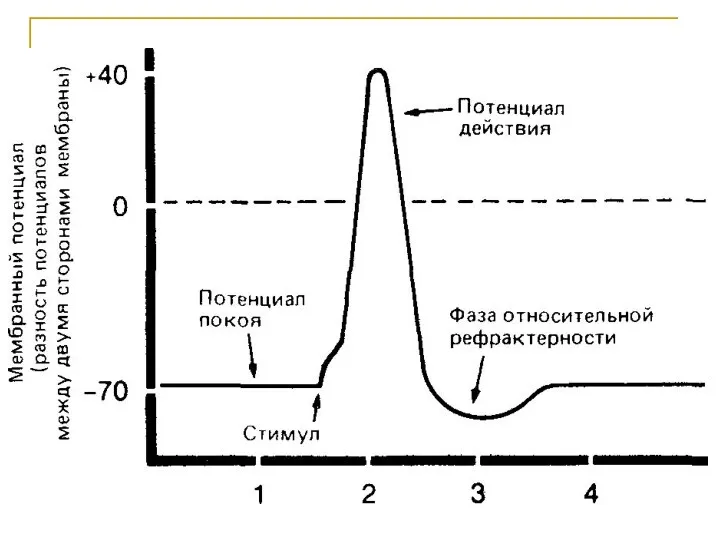
- 39. Потенциал действия Na+каналы имеют ворота ? реагируют на небольшую раздражение, тем что открываются ? это увеличивает
- 40. Мембранный потенциал нервной клетки равен –75 мВ и почти целиком определяется ионами калия. В момент возбуждения
- 41. Формирование потенциала действия обусловлено двумя ионными потоками через мембрану: поток ионов Na+ внутрь клетки приводит к
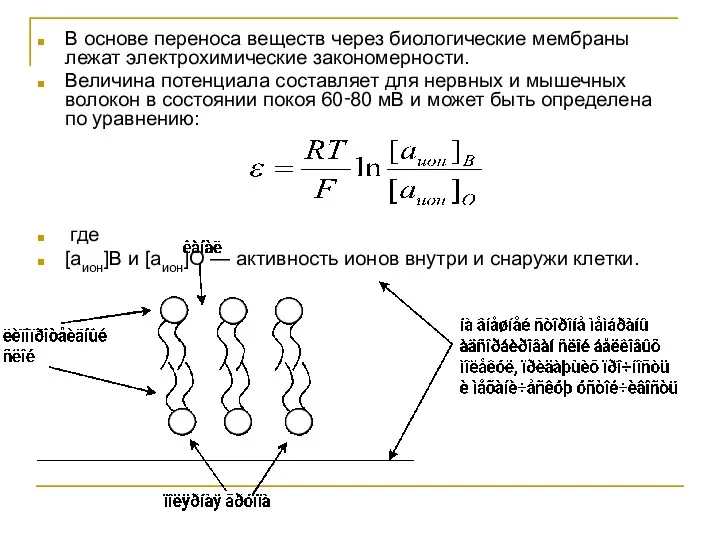
- 42. В основе переноса веществ через биологические мембраны лежат электрохимические закономерности. Величина потенциала составляет для нервных и
- 43. В узкие канальцы липопротеидного слоя [в состоянии покоя] могут проходить ионы К+ и не проходят ионы
- 44. Значение редокс и мембранных потенциалов в медицине
- 45. Биопотенциалы различных органов ЭКГ -электрокардиография ЭЭГ-электроэнцефалография ЭМГ - электромиография ЭОГ- электроокулография
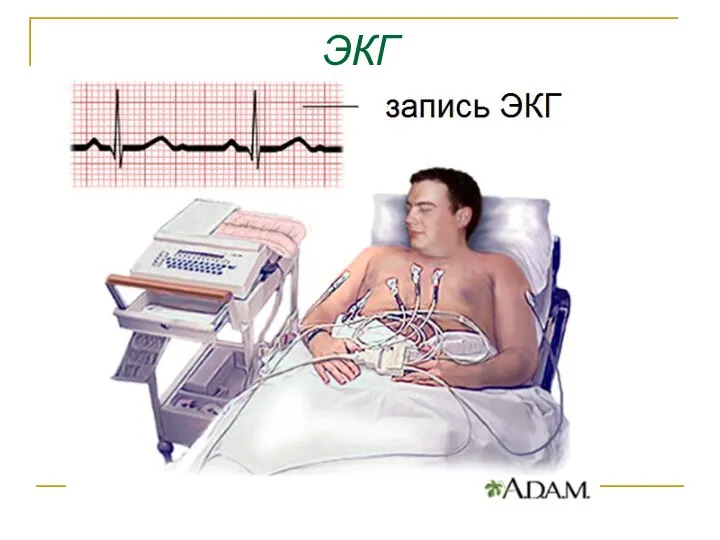
- 46. ЭКГ
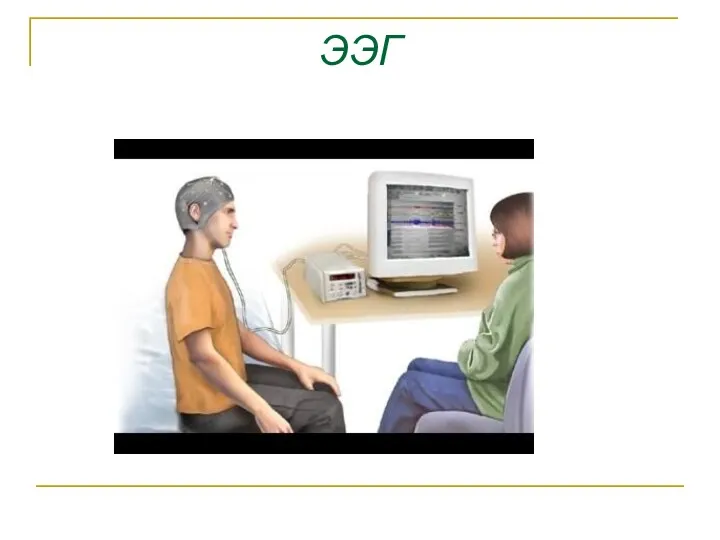
- 47. ЭЭГ
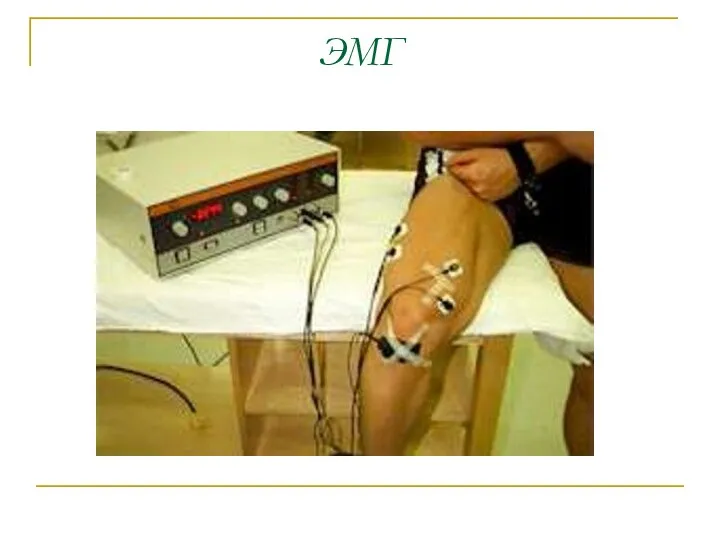
- 48. ЭМГ
- 50. Скачать презентацию

























![В узкие канальцы липопротеидного слоя [в состоянии покоя] могут проходить](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/409043/slide-42.jpg)


 Клуб правильного питания. Часть 1
Клуб правильного питания. Часть 1 Вроджені вади грудної клітки
Вроджені вади грудної клітки Эпидемиология и профилактика холеры
Эпидемиология и профилактика холеры Обоснование применения визуальных методов исследования в гинекологии
Обоснование применения визуальных методов исследования в гинекологии Балалардағы эндокриндік патологияның визуалді диагностика әдістерінің ерекшеліктері
Балалардағы эндокриндік патологияның визуалді диагностика әдістерінің ерекшеліктері Тактические принципы работы выездных бригад скорой медицинской помощи
Тактические принципы работы выездных бригад скорой медицинской помощи Сальмонеллёзы. Этиология
Сальмонеллёзы. Этиология Инфекция. Роль микроорганизмов в развитии инфекционных заболеваний человека
Инфекция. Роль микроорганизмов в развитии инфекционных заболеваний человека Анализ ассортимента антиаритмических препаратов в аптечной организации
Анализ ассортимента антиаритмических препаратов в аптечной организации Жүрекшелер фибрилляция кезінде анти аритмиялық препараттарды (амидарон, флекайнид) салыстыру
Жүрекшелер фибрилляция кезінде анти аритмиялық препараттарды (амидарон, флекайнид) салыстыру Совершенствование организационной структуры медицинской организации (на примере ООО ММЦ Диалайн)
Совершенствование организационной структуры медицинской организации (на примере ООО ММЦ Диалайн) Ісік жасушаларын зерттеу
Ісік жасушаларын зерттеу Раневые инфекции. Этиологическая структура
Раневые инфекции. Этиологическая структура Современные принципы организации акушерскогинекологической помощи
Современные принципы организации акушерскогинекологической помощи Презентация ООИБ-ПНД
Презентация ООИБ-ПНД Клиника и лечение современной холеры
Клиника и лечение современной холеры Страховая модель здравоохранения
Страховая модель здравоохранения Жүре пайда болған жүрек ақаулары
Жүре пайда болған жүрек ақаулары Назальный глюкагон как альтернатива введению глюкагона у детей с сахарным диабетом I типа при гипогликемических состояниях
Назальный глюкагон как альтернатива введению глюкагона у детей с сахарным диабетом I типа при гипогликемических состояниях Профилактика врожденной патологии лица
Профилактика врожденной патологии лица Опухолевый рост
Опухолевый рост Интерннің өзіндік жұмысы
Интерннің өзіндік жұмысы Гематогенді остеомиелит
Гематогенді остеомиелит Симптоматическая артериальная гипертензия
Симптоматическая артериальная гипертензия Эпилепсия. Классификация припадков. Первая помощь
Эпилепсия. Классификация припадков. Первая помощь Правильная осанка
Правильная осанка Диссеминированное внутрисосудистое свертывание крови (ДВС)
Диссеминированное внутрисосудистое свертывание крови (ДВС) Интерферон короткого действия
Интерферон короткого действия