Электрохимия. Понятие электрохимии. Электроды. Гальванические цепи. Окислительно-восстановительные электроды. (Лекция 6.1) презентация
Содержание
- 2. ЦЕЛИ ЛЕКЦИИ ОБУЧАЮЩАЯ: сформировать знания об основах электрохимии, формировании электродного потенциала, уравнении Нернста, классификации электродов, гальванических
- 3. Электрохимия
- 4. Электрохимия устанавливает механизмы процессов и явлений, протекающих на границе раздела фаз с участием заряженных частиц, в
- 5. Электродный потенциал Электрохимические процессы – частный случай окислительно-восстановительных реакций: Red1 + Ox2 Ox1 +Red2 Zn +
- 6. Медико-биологическое значение темы Окислительно-восстановительные процессы являются необходимыми звеньями в сложной цепи как анаболических, так катаболических процессов.
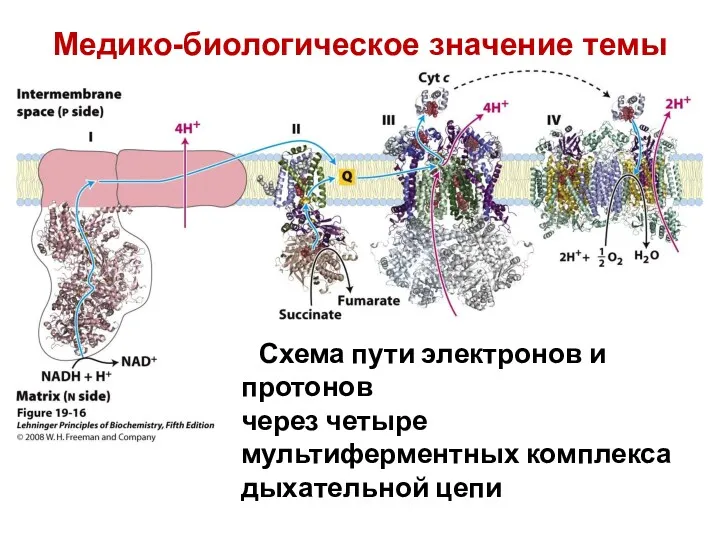
- 7. В митохондриях окисление происходит в результате переноса электронов от органических субстратов на кислород, который при этом
- 8. На трех таких стадиях разность потенциалов больше 0,17 В. В этом случае количество выделяющейся энергии примерно
- 9. Схема пути электронов и протонов через четыре мультиферментных комплекса дыхательной цепи Медико-биологическое значение темы
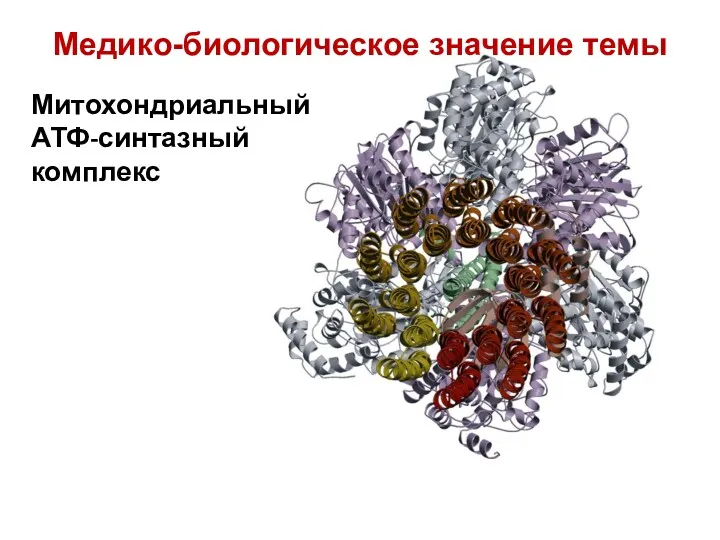
- 10. Митохондриальный АТФ-синтазный комплекс Медико-биологическое значение темы
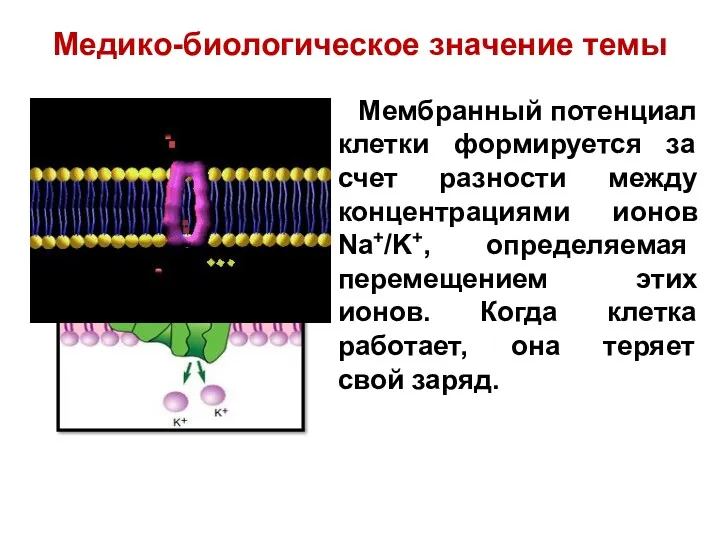
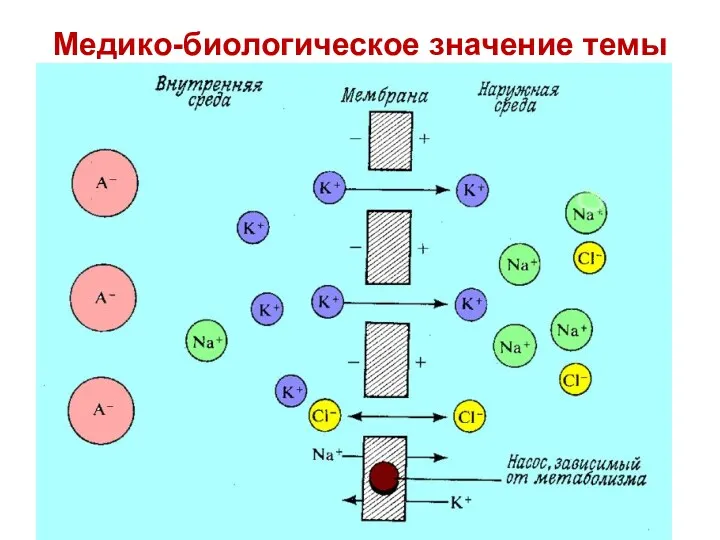
- 11. Мембранный потенциал клетки формируется за счет разности между концентрациями ионов Na+/K+, определяемая перемещением этих ионов. Когда
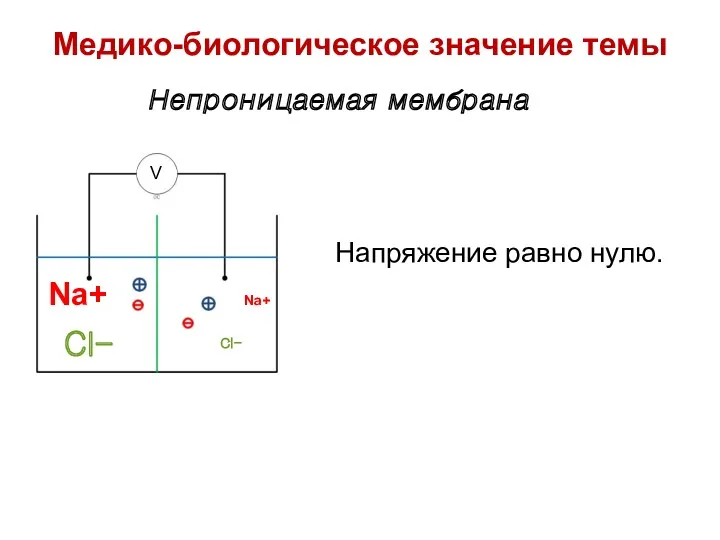
- 12. Непроницаемая мембрана Na+ Cl- Na+ Cl- V Напряжение равно нулю. Медико-биологическое значение темы
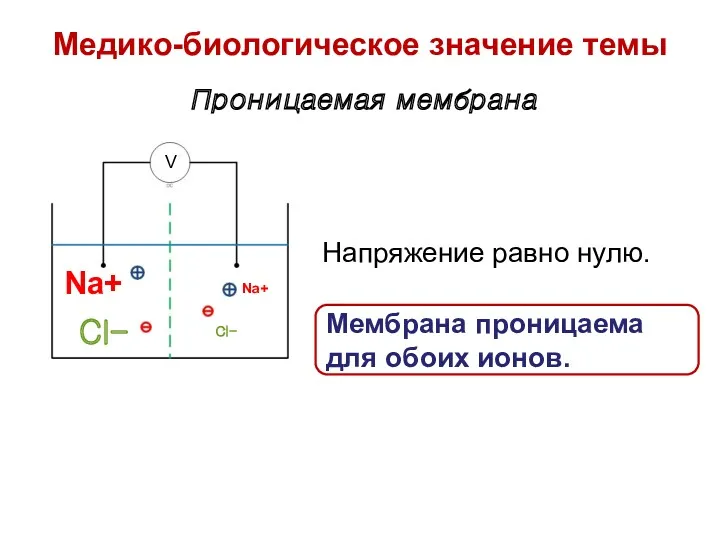
- 13. Проницаемая мембрана Na+ Na+ Cl- Cl- Мембрана проницаема для обоих ионов. V Напряжение равно нулю. Медико-биологическое
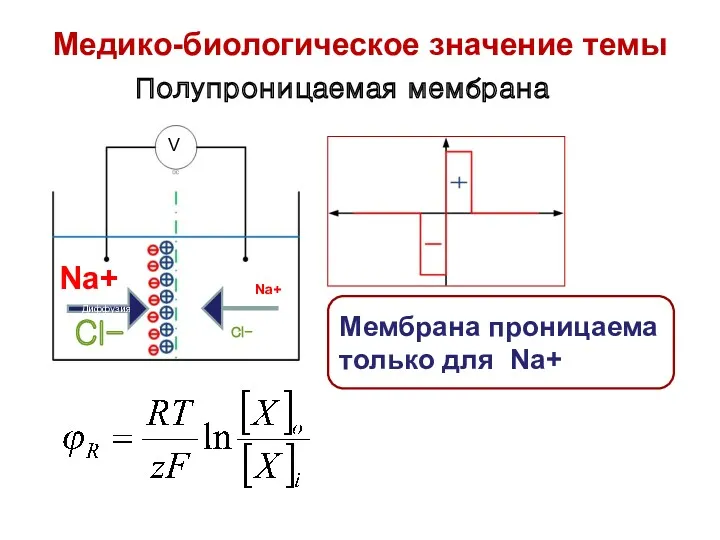
- 14. Полупроницаемая мембрана Na+ Cl- Na+ Cl- Мембрана проницаема только для Na+ V Диффузия Силы Кулона Медико-биологическое
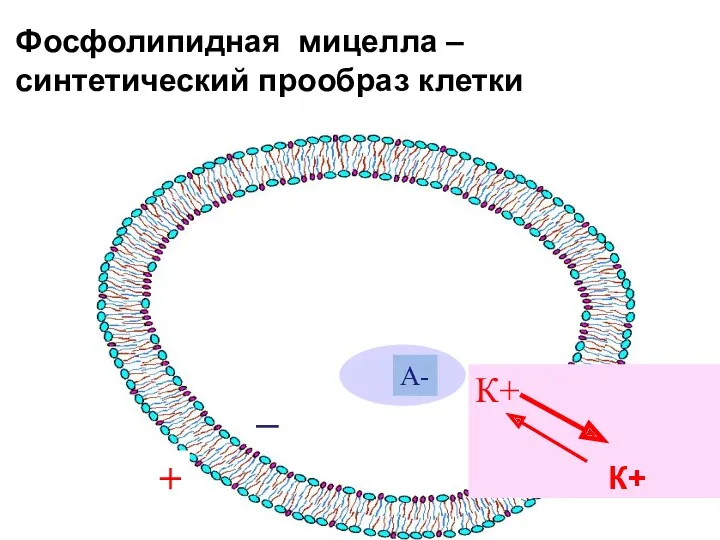
- 15. Фосфолипидная мицелла – синтетический прообраз клетки
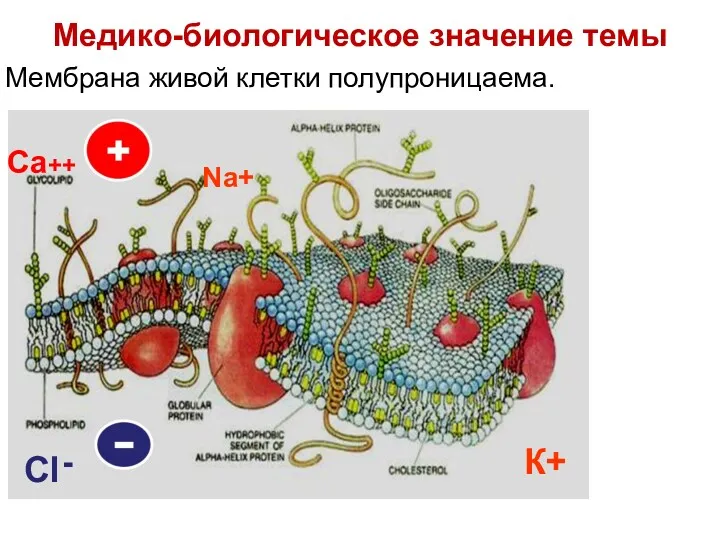
- 16. Мембрана живой клетки полупроницаема. К+ Na+ Са++ Cl - Медико-биологическое значение темы
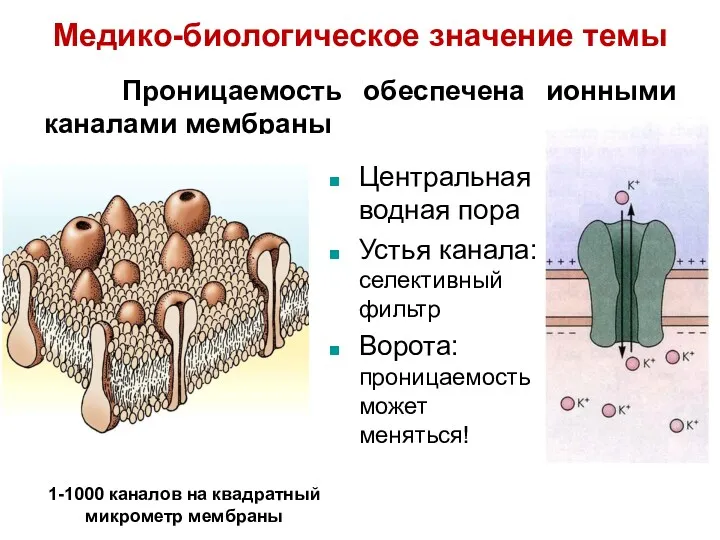
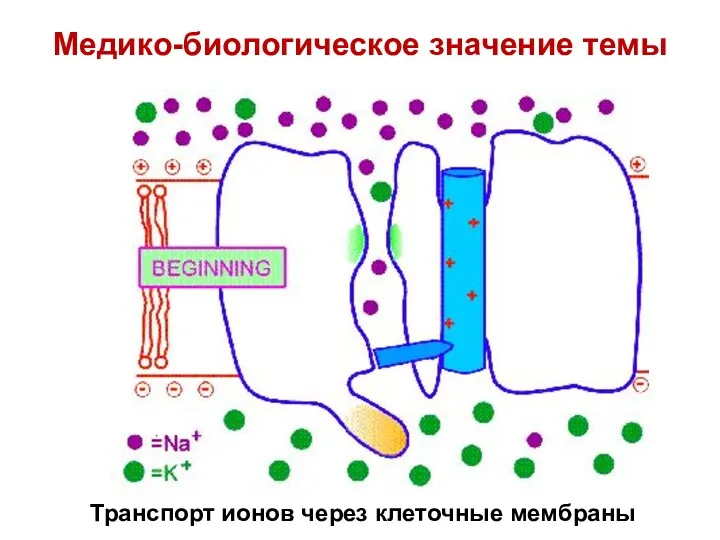
- 17. Проницаемость обеспечена ионными каналами мембраны 1-1000 каналов на квадратный микрометр мембраны Центральная водная пора Устья канала:
- 18. Нобелевская премия 1991 г. в области физиологии и медицины Эрвин Нейер и Берт Сакманн «за открытия
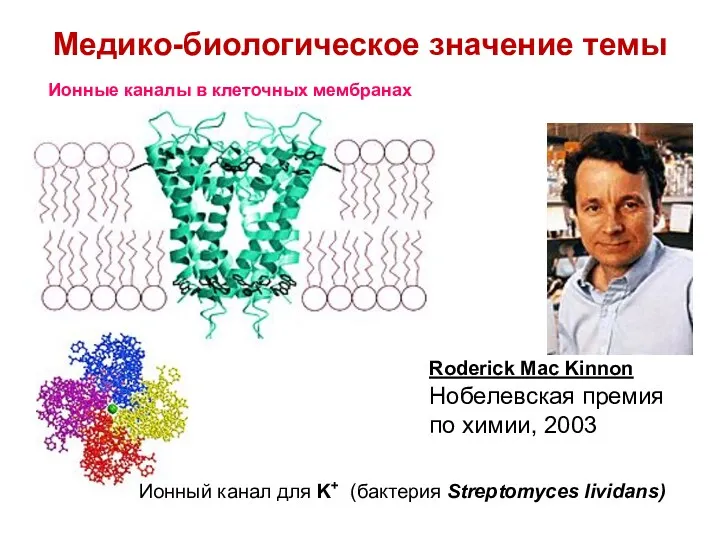
- 19. Ионные каналы в клеточных мембранах Roderick Mac Kinnon Нобелевская премия по химии, 2003 Ионный канал для
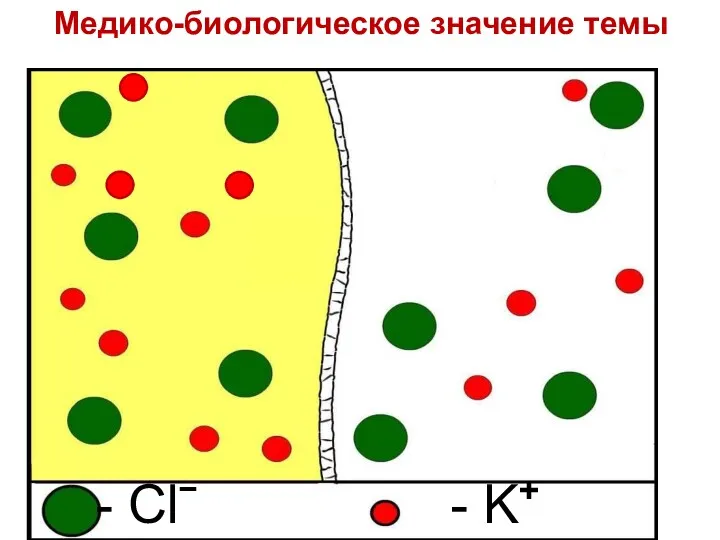
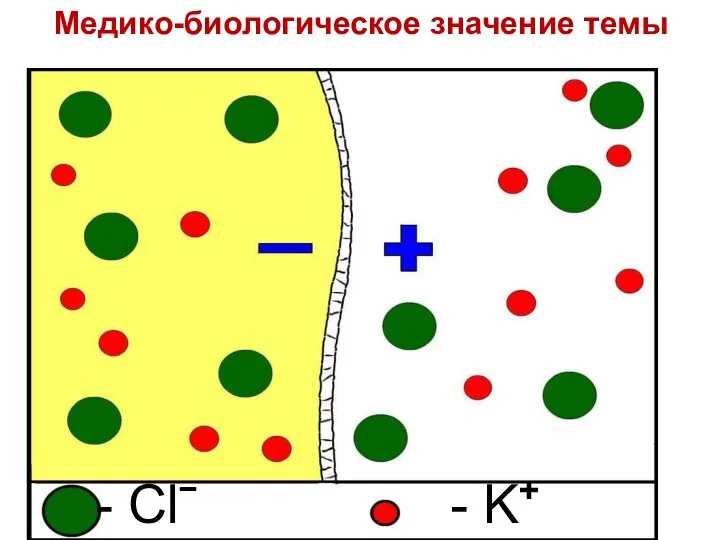
- 20. - Clˉ - K+ Медико-биологическое значение темы
- 21. - Clˉ - K+ Медико-биологическое значение темы
- 22. Медико-биологическое значение темы
- 23. Транспорт ионов через клеточные мембраны Медико-биологическое значение темы
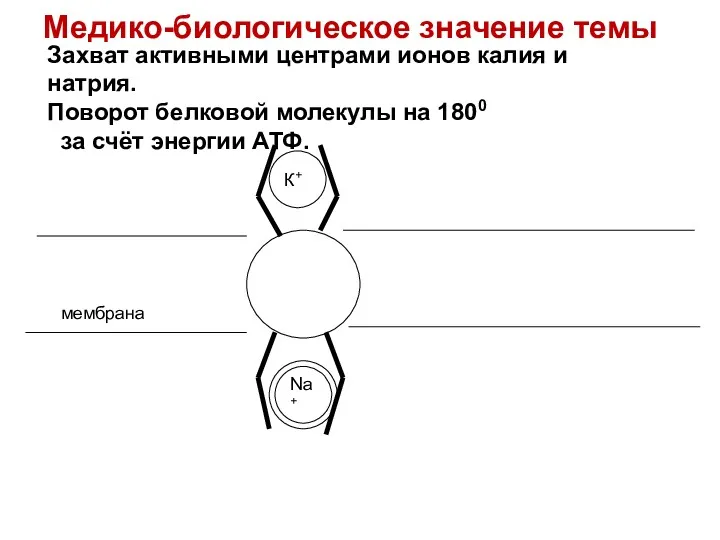
- 24. мембрана Захват активными центрами ионов калия и натрия. Поворот белковой молекулы на 1800 за счёт энергии
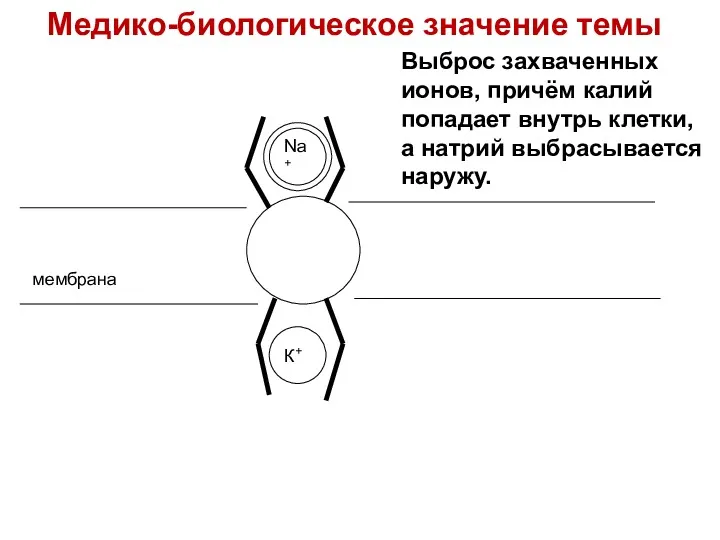
- 25. К+ мембрана Выброс захваченных ионов, причём калий попадает внутрь клетки, а натрий выбрасывается наружу. Медико-биологическое значение
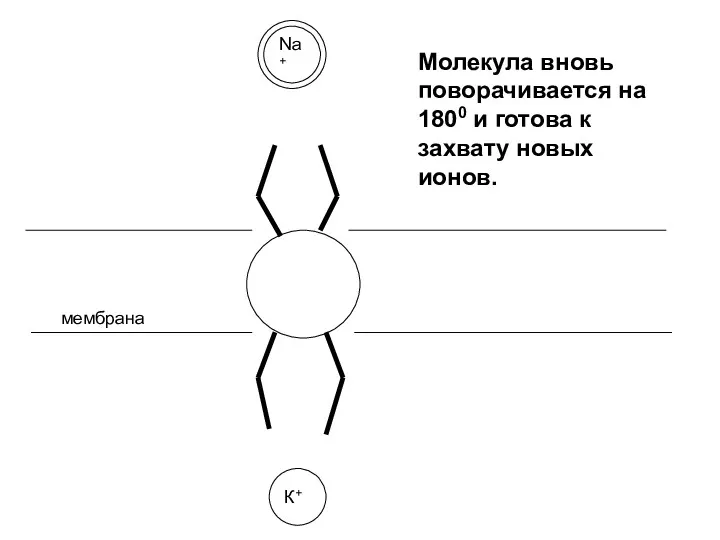
- 26. мембрана Молекула вновь поворачивается на 1800 и готова к захвату новых ионов. К+
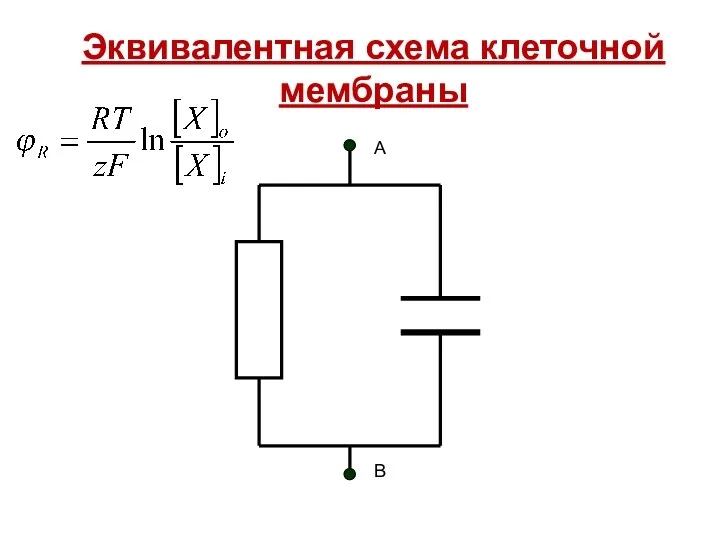
- 27. Эквивалентная схема клеточной мембраны А В
- 28. Электрохимия является фундаментом таких методов анализа, как кондуктометрия, потенциометрия, полярография, вольт- и амперометрия, широко применяемых в
- 29. Свойства фармацевтических препаратов находятся в непосредственной связи с их окислительно-восстановительными свойствами. Так, многие антисептические и дезинфицирующие
- 30. Медико-биологическое значение темы
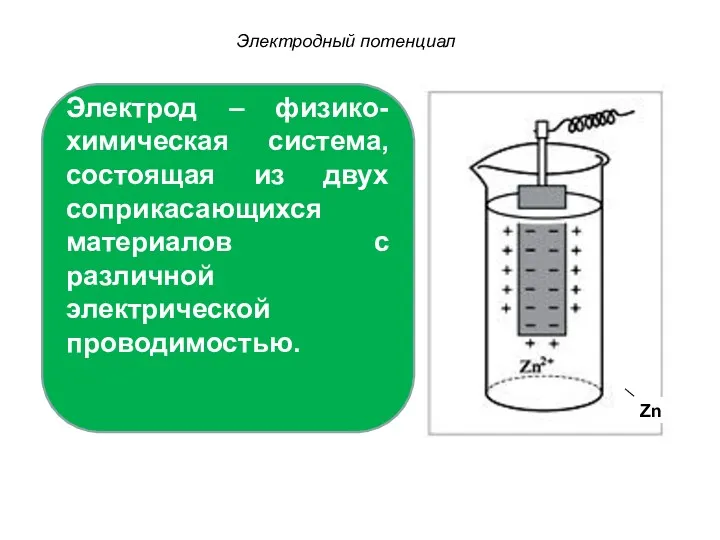
- 31. Электродный потенциал Zn Электрод – физико-химическая система, состоящая из двух соприкасающихся материалов с различной электрической проводимостью.
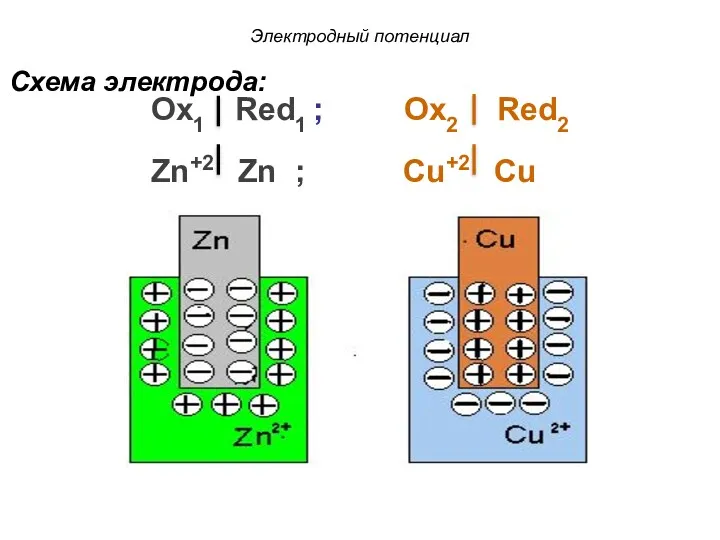
- 32. Электродный потенциал Схему электрода изображают в виде вертикальной черты, которая разделяет твердую и жидкую фазы. Например,
- 33. Схема электрода: Ox1 Red1 ; Ox2 Red2 Zn+2 Zn ; Cu+2 Cu Электродный потенциал
- 34. Электродный потенциал Электродным потенциалом (φ) называют максимальную разность потенциалов, возникающую на границе твердая фаза – раствор
- 35. На границе раздела фаз возможны переходы поверхностных частиц из одной фазы в другую, если это сопровождается
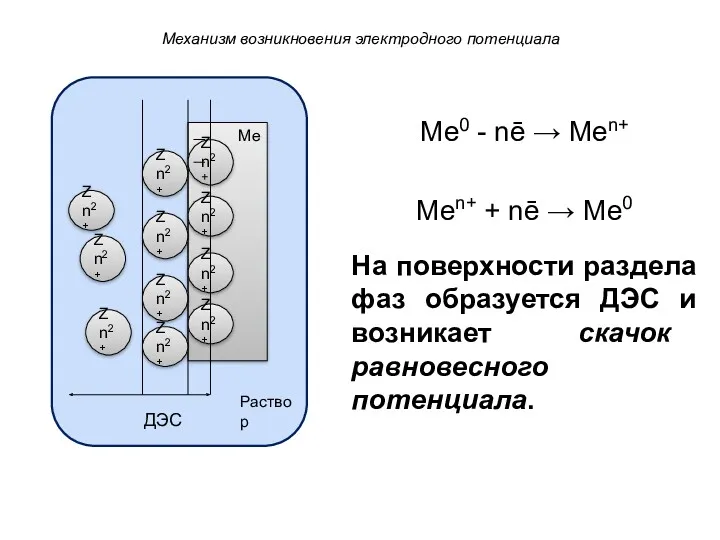
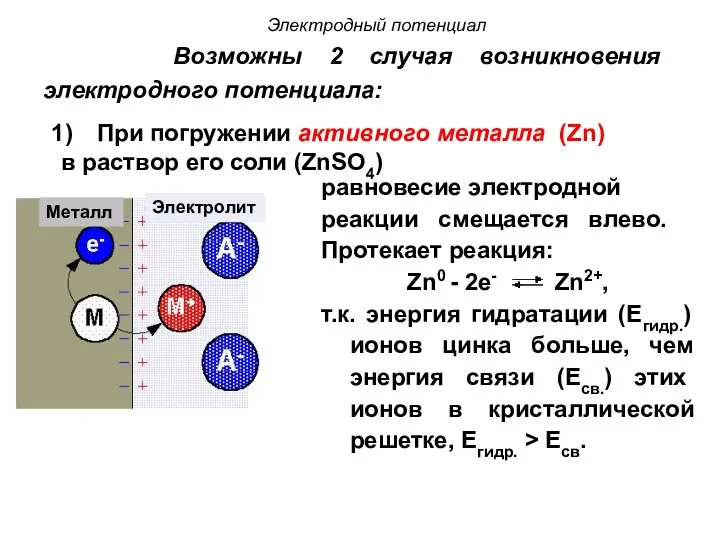
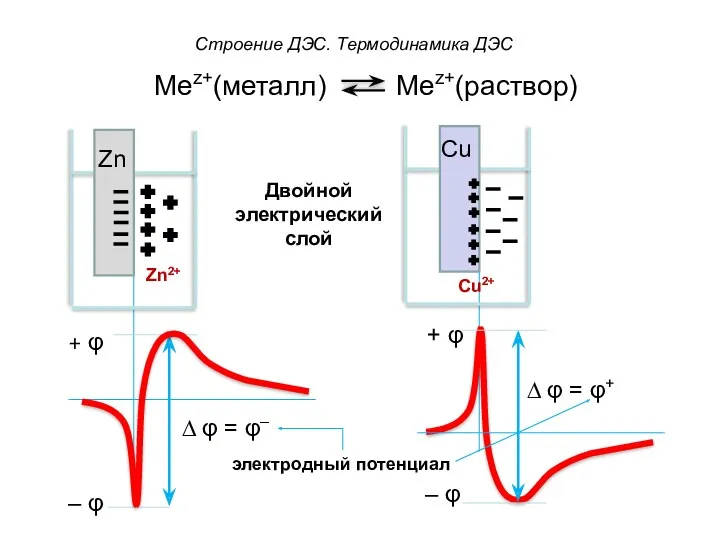
- 36. При погружении металла в раствор его одноименной соли, в системе металл – раствор устанавливается равновесие: Меn+
- 37. Механизм возникновения электродного потенциала Ме0 - nē → Mеn+ Mеn+ + nē → Ме0 Zn2+ Zn2+
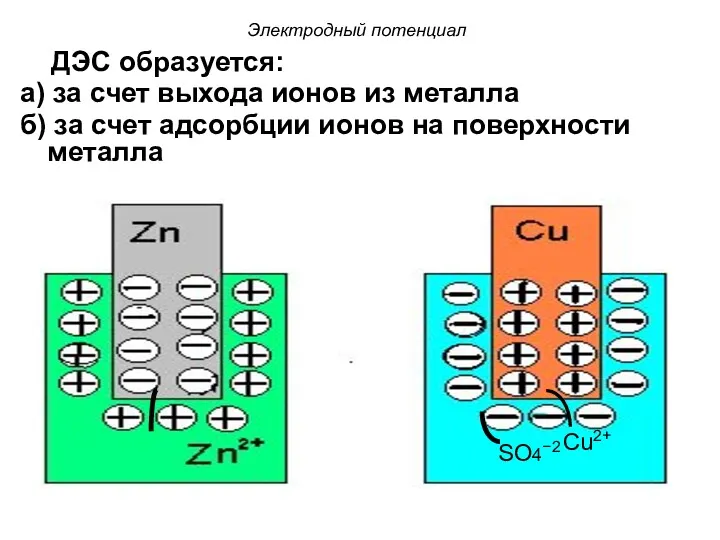
- 38. ДЭС образуется: а) за счет выхода ионов из металла б) за счет адсорбции ионов на поверхности
- 39. Возможны 2 случая возникновения электродного потенциала: No current равновесие электродной реакции смещается влево. Протекает реакция: Zn0
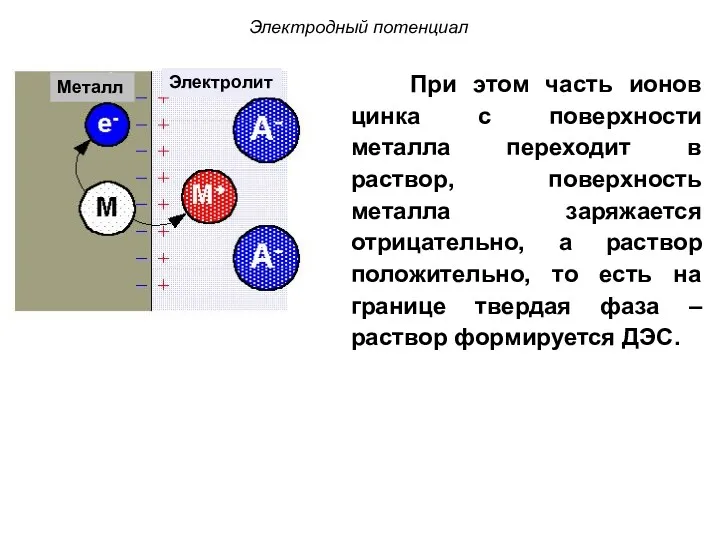
- 40. No current При этом часть ионов цинка с поверхности металла переходит в раствор, поверхность металла заряжается
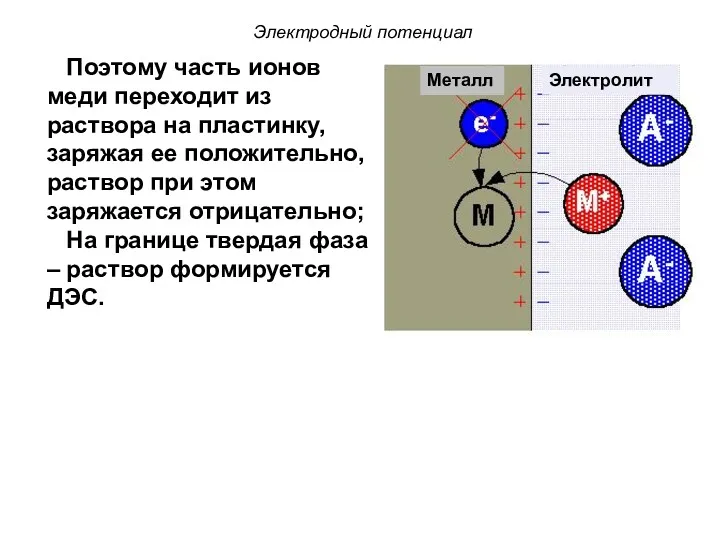
- 41. 2) При погружении неактивного металла (Cu) в раствор его соли (CuSO4) В этом случае энергия связи
- 42. Электродный потенциал Поэтому часть ионов меди переходит из раствора на пластинку, заряжая ее положительно, раствор при
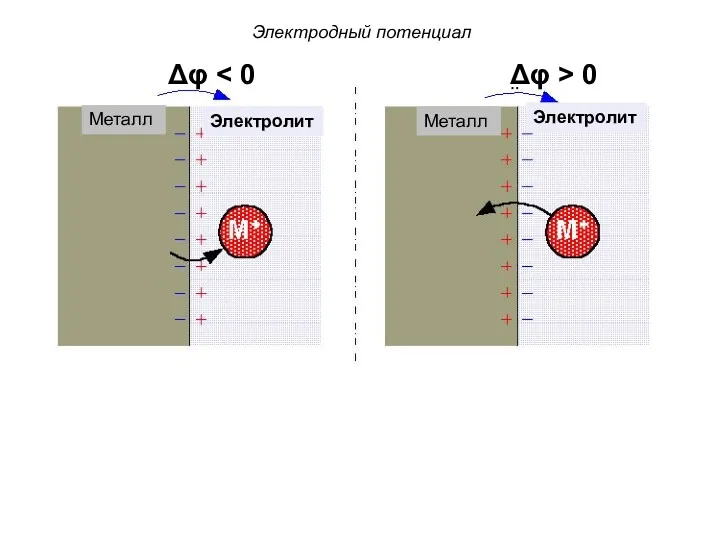
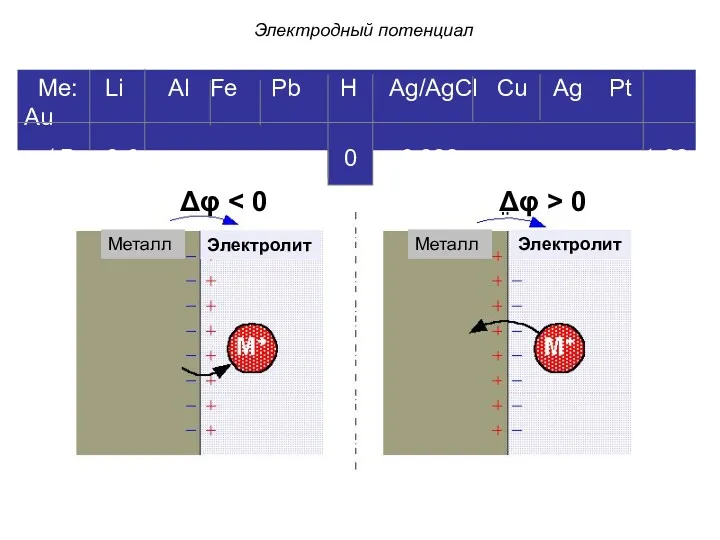
- 43. Электродный потенциал No current Δφ 0 Металл Электролит Электролит Металл
- 44. Электродный потенциал No current Δφ 0 Металл Металл Электролит Электролит
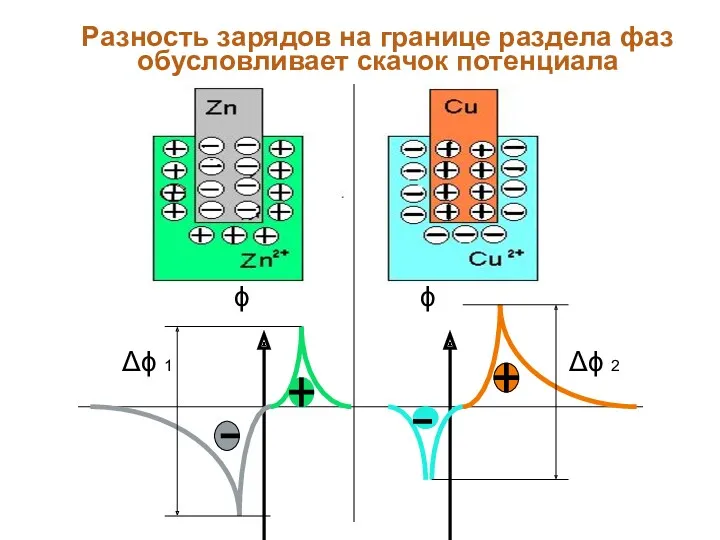
- 45. Разность зарядов на границе раздела фаз обусловливает скачок потенциала
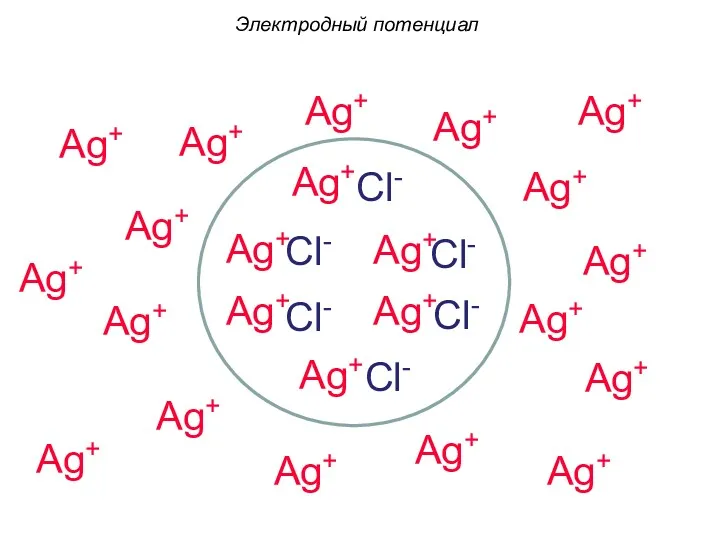
- 46. Электродный потенциал Существуют и другие механизмы возникновения ДЭС, например, процесс адсорбции адсорбата на поверхности адсорбента. При
- 47. Ag+ Cl- Ag+ Ag+ Cl- Ag+ Ag+ Ag+ Cl- Ag+ Ag+ Ag+ Ag+ Ag+ Ag+ Ag+
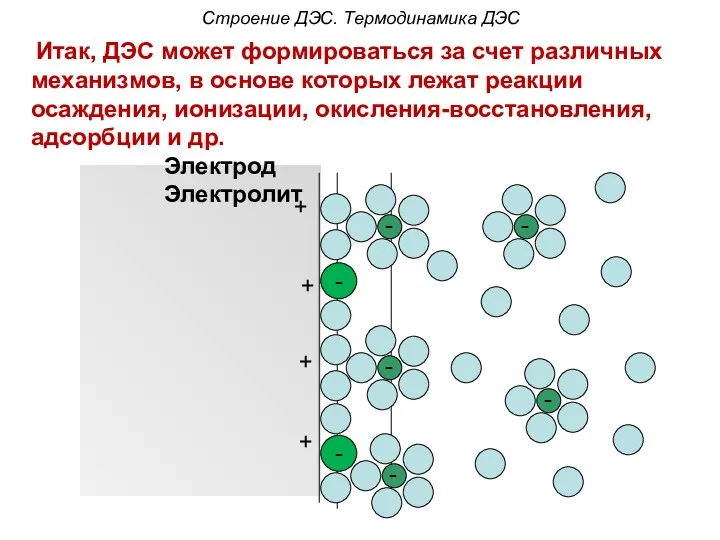
- 48. + + + + Электрод Электролит Итак, ДЭС может формироваться за счет различных механизмов, в основе
- 49. Строение ДЭС по Штерну ДЭС можно сравнить с конденсатором, одна обкладка которого – металл, другая –
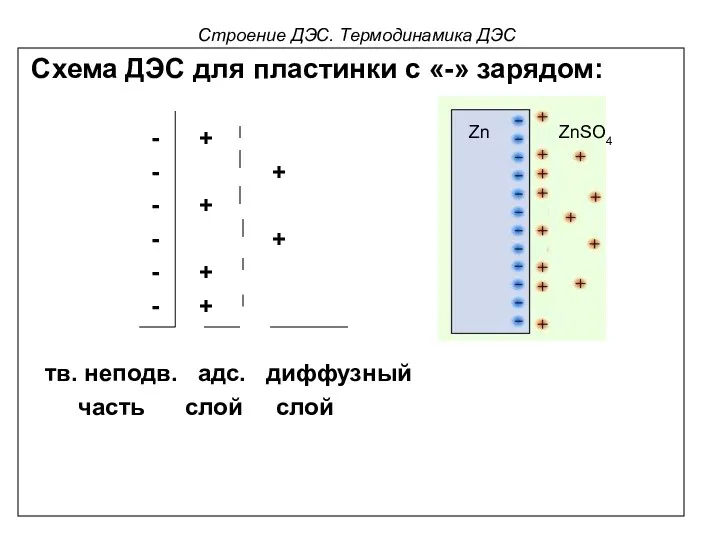
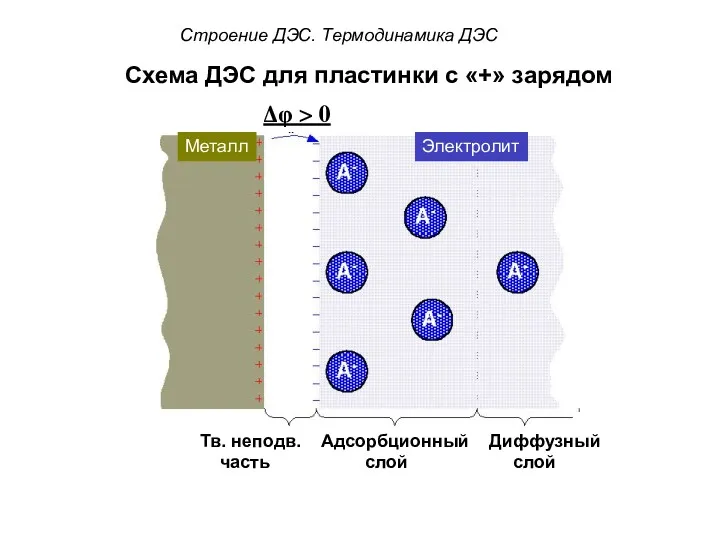
- 50. Строение ДЭС. Термодинамика ДЭС Подвижную часть ДЭС можно разделить на две части: 1) Адсорбционный слой –
- 51. Строение ДЭС. Термодинамика ДЭС
- 52. Строение ДЭС. Термодинамика ДЭС Схема ДЭС для пластинки с «-» зарядом: - + - + -
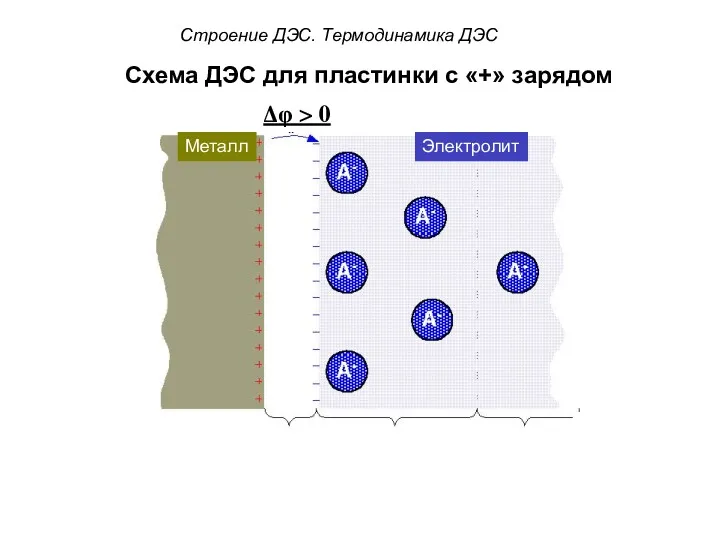
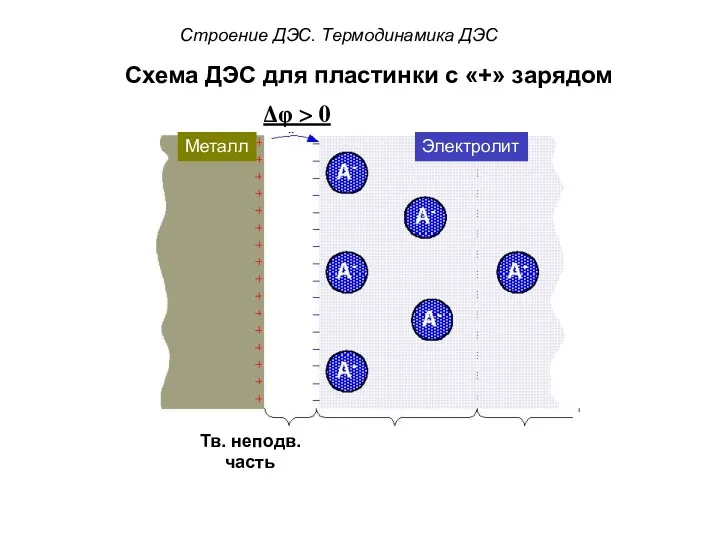
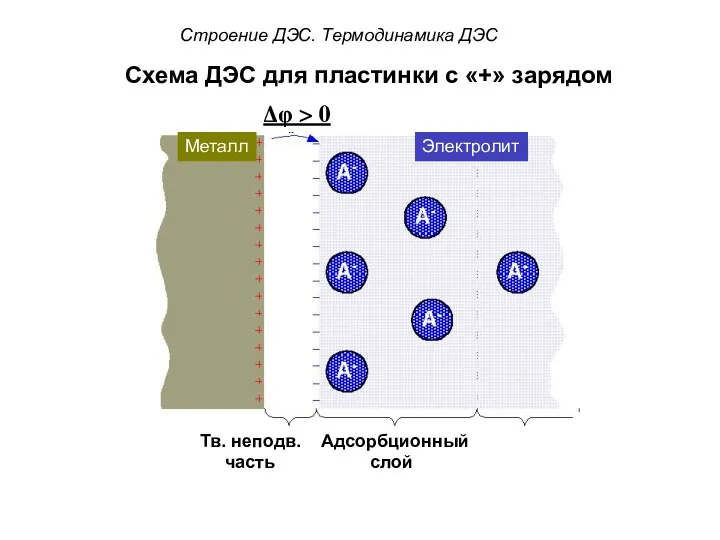
- 53. Схема ДЭС для пластинки с «+» зарядом Δφ > 0 ? ? ? Металл Электролит Строение
- 54. Схема ДЭС для пластинки с «+» зарядом Δφ > 0 ? ? ? Металл Электролит Строение
- 55. Схема ДЭС для пластинки с «+» зарядом Δφ > 0 ? ? ? Металл Электролит Строение
- 56. Схема ДЭС для пластинки с «+» зарядом Δφ > 0 ? ? ? Металл Электролит Строение
- 57. Строение ДЭС. Термодинамика ДЭС От величины электродного потенциала (φ) зависит величина работы, которая совершается системой при
- 58. В изобарно-изотермических условиях работа равна уменьшению энергии Гиббса: тогда: Строение ДЭС. Термодинамика ДЭС
- 59. Уравнение Нернста Вольтер Герман Нернст Нернст – Эйнштейн – Планк – Миллиган – фон Лауэ
- 60. Уравнение Нернста: φ – электродный потенциал [В], φ0 – стандартный электродный потенциал - характеризует природу электрода.
- 61. Уравнение Нернста При подстановке констант в выражение и переводе натурального логарифма в десятичный (ln= 2,3 ·lg),
- 62. Уравнение Нернста Например, уравнение Нернста для цинкового электрода для 298 K: Для 291 K уравнение Нернста
- 63. Факторы, влияющие на величину электродного потенциала Концентрация ионов металла в растворе: чем больше концентрация катионов в
- 64. Электродный потенциал нельзя измерить непосредственно. Можно измерять только разность потенциалов или электродвижущую силу (E). Для этого
- 65. Гальванический элемент - это электрохимическая система, состоящая из двух электродов любого типа и в которой самопроизвольно
- 66. Гальванические элементы: электрохимические - источником электрической энергии является химическая реакция. концентрационные - источником электрической энергии служат
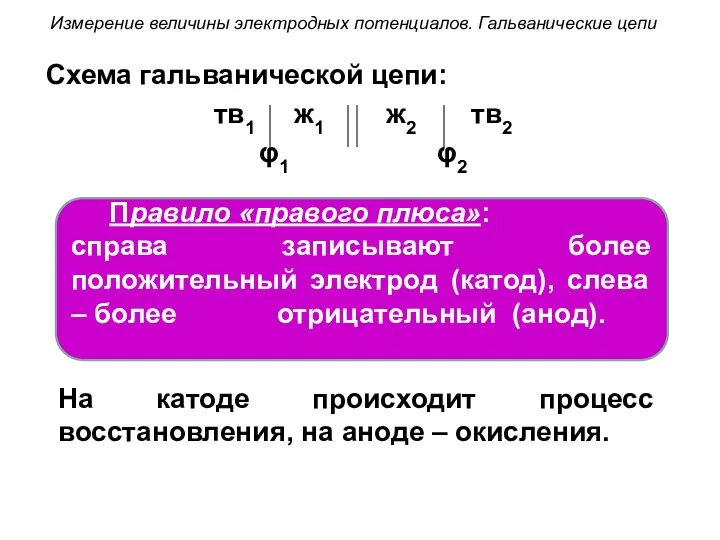
- 67. Схема гальванической цепи: тв1 ж1 ж2 тв2 φ1 φ2 Правило «правого плюса»: справа записывают более положительный
- 68. Расчет ЭДС гальванического элемента Электродвижущая сила (Е) – это разность электродных потенциалов катода и анода в
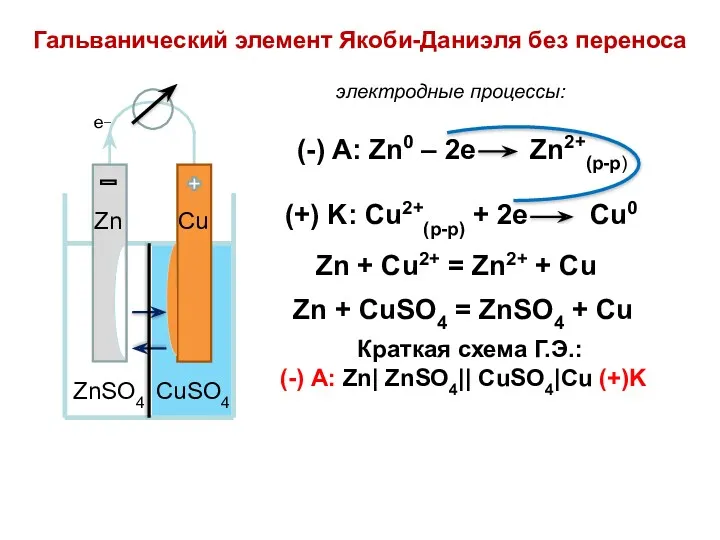
- 69. Гальванический элемент Якоби-Даниэля без переноса Zn Cu Zn + CuSO4 = ZnSO4 + Cu электродные процессы:
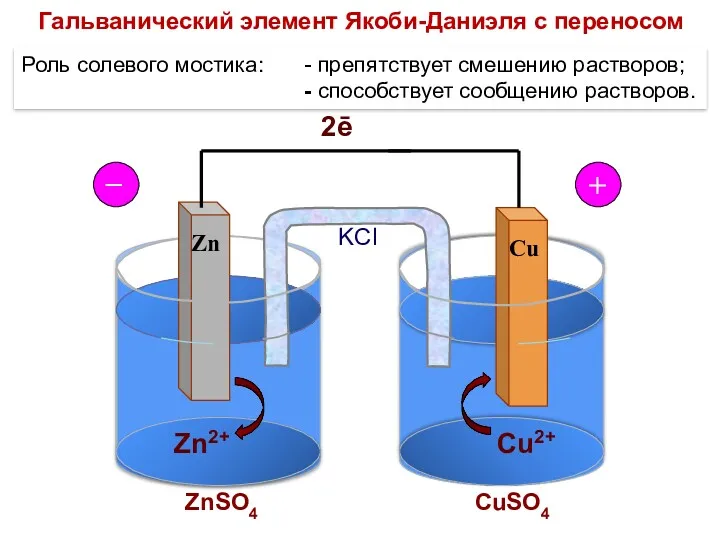
- 70. Zn2+ Cu2+ 2ē Zn Cu _ + ZnSO4 CuSO4 KCl Роль солевого мостика: - препятствует смешению
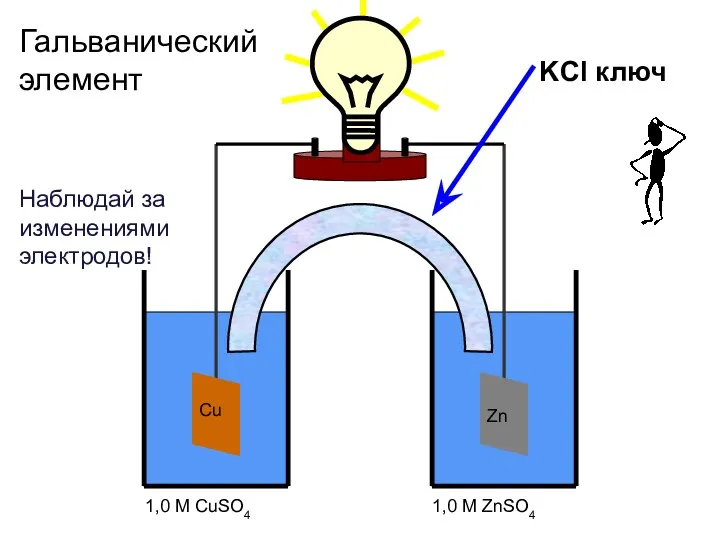
- 71. Cu 1,0 M CuSO4 Zn 1,0 M ZnSO4 KCl ключ Гальванический элемент Наблюдай за изменениями электродов!
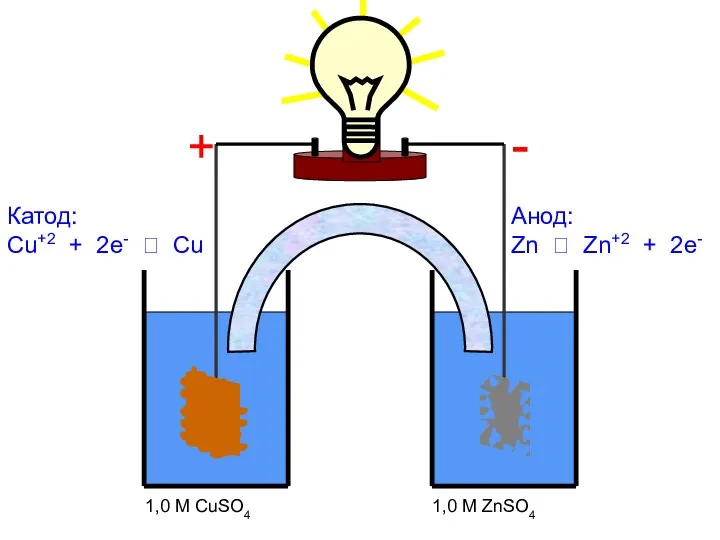
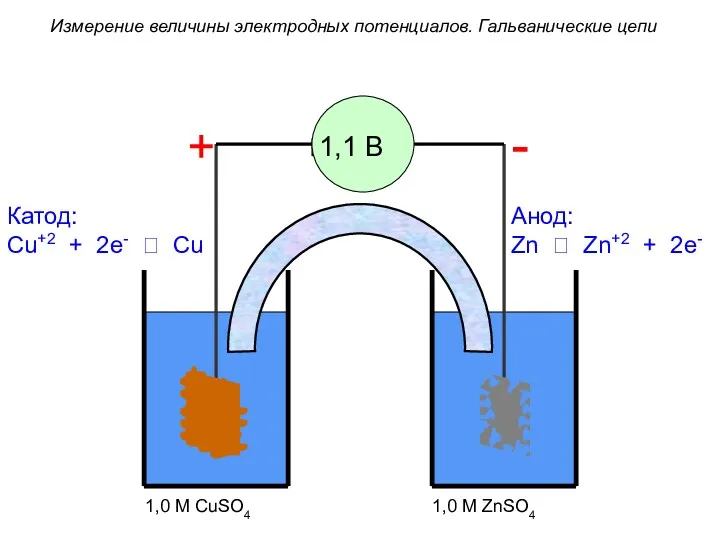
- 72. Cu 1,0 M CuSO4 Zn 1,0 M ZnSO4 Катод: Cu+2 + 2e- ? Cu Анод: Zn
- 73. Cu 1,0 M CuSO4 Zn 1,0 M ZnSO4 Катод: Cu+2 + 2e- ? Cu Анод: Zn
- 74. Концентрационные ГЭ ( – ) Ag ⏐AgNO3⏐⏐ AgNO3⏐ Ag ( + ) ɑ1 ɑ2 это система
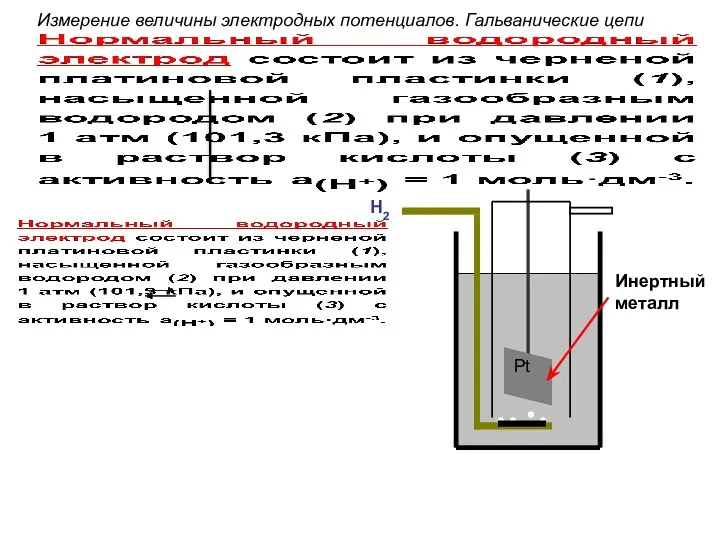
- 75. Для измерения стандартных электродных потенциалов собирают гальваническую цепь, состоящую из исследуемого электрода и стандартного водородного электрода,
- 76. Измерение величины электродных потенциалов. Гальванические цепи
- 77. H2 Инертный металл Измерение величины электродных потенциалов. Гальванические цепи Pt
- 78. Измерение величины электродных потенциалов. Гальванические цепи Уравнение Нернста для нормального водородного электрода: Так как , тогда
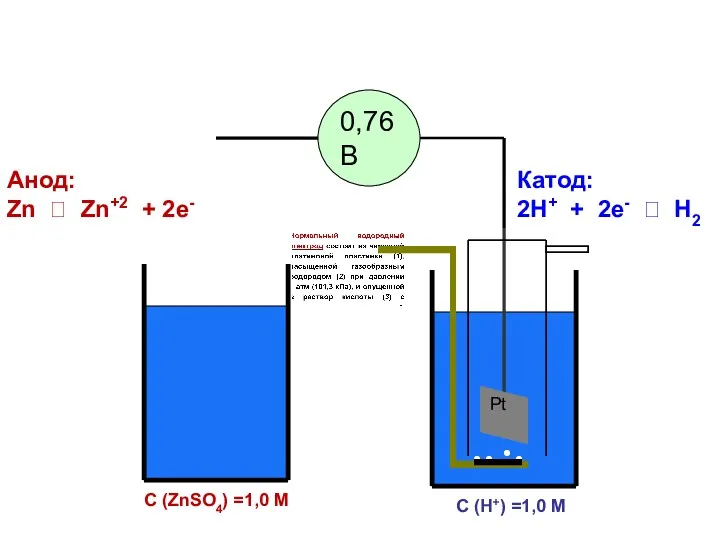
- 79. Измерение величины электродных потенциалов. Гальванические цепи
- 80. Pt С (H+) =1,0 M С (ZnSO4) =1,0 M 0,76 В Катод: 2H+ + 2e- ?
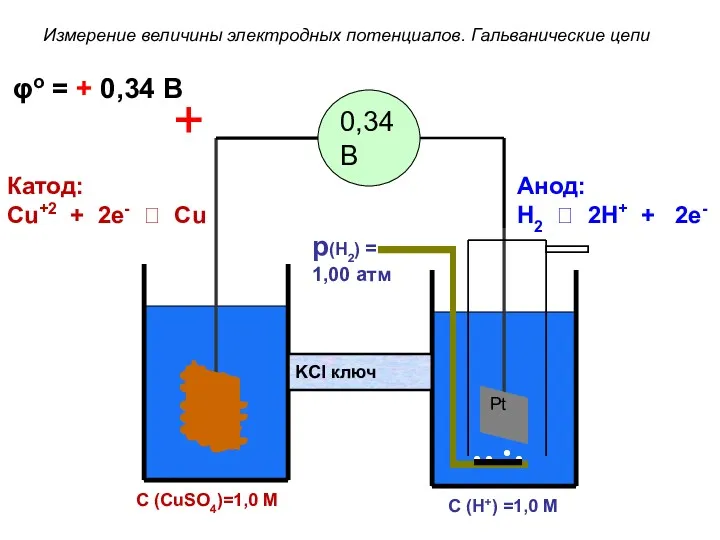
- 81. Измерение величины электродных потенциалов. Гальванические цепи
- 82. p(H2) = 1,00 атм Pt С (H+) =1,0 M Cu C (CuSO4)=1,0 M 0,34 В Катод:
- 83. Al+3 + 3e- ? Al φo = - 1,66 В Zn+2 + 2e- ? Zn φo
- 84. Электрохимический ряд напряжений металлов Увеличение электродного потенциала Усиление окислительных свойств Уменьшение химической активности металла Активные Средней
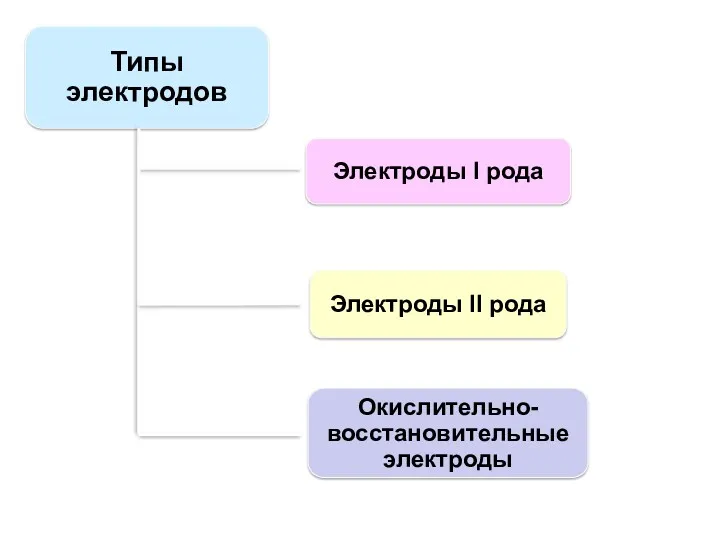
- 85. Типы электродов Электроды I рода Электроды II рода Окислительно-восстановительные электроды
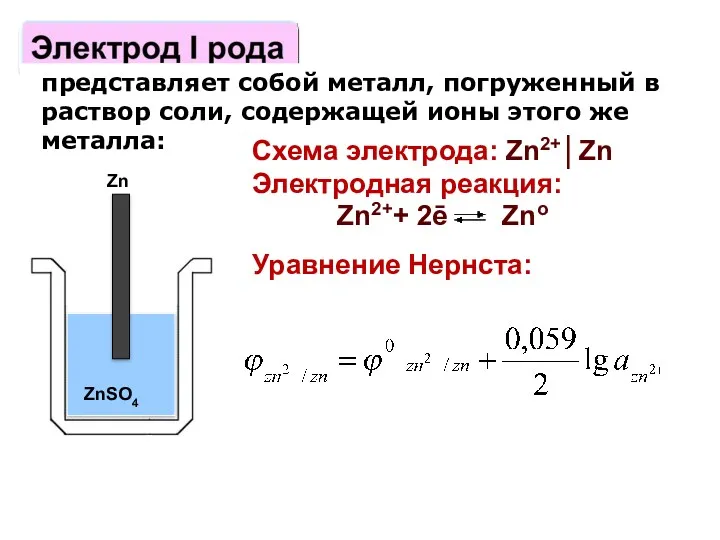
- 86. представляет собой металл, погруженный в раствор соли, содержащей ионы этого же металла: Zn ZnSO4 Схема электрода:
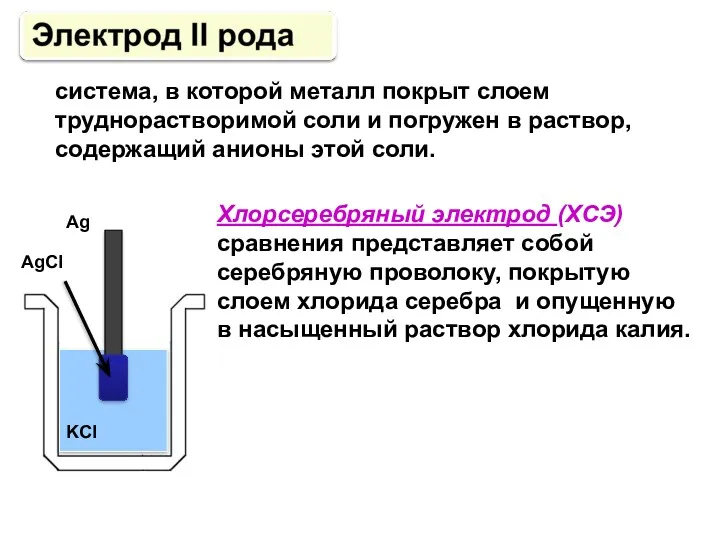
- 87. система, в которой металл покрыт слоем труднорастворимой соли и погружен в раствор, содержащий анионы этой соли.
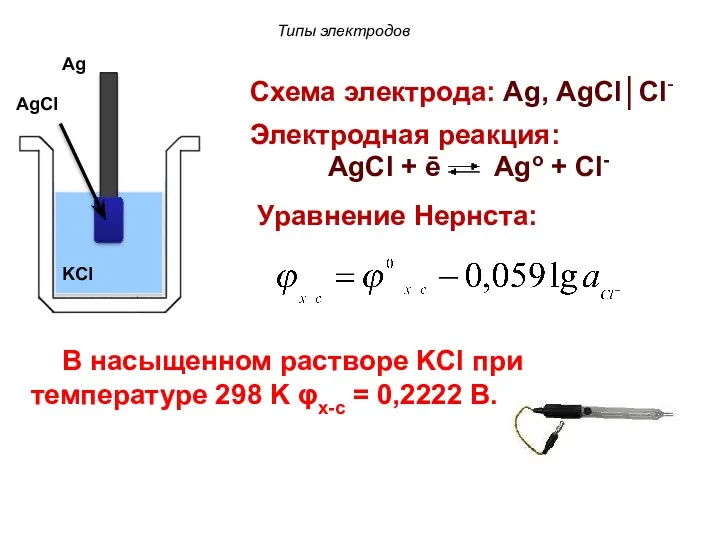
- 88. Схема электрода: Ag, AgCl│Cl- Электродная реакция: AgCl + ē Ago + Cl- Уравнение Нернста: Типы электродов
- 89. Раствор, содержащий одновременно окисленную и восстановленную формы вещества, называют окислительно-восстановительной (red-ox) системой. Инертный токопроводящий металл (например,
- 90. Окислительно-восстановительные электроды Pt ox (окисленная форма) red (восстановленная форма) Электродная реакция: ox + n e- red
- 91. Окислительно-восстановительные электроды Red-ox-электроды делятся на простые и сложные. В простых электродах для осуществления электродной реакции ox
- 92. Окислительно-восстановительные электроды Уравнение Нернста-Петерса: Уравнение Нернста-Петерса для Т 298 К:
- 93. Pt FeSO4 + Fe2(SO4)3 Схема электрода: Pt Fe3+, Fe2+ Электродная реакция: Fe3+ + 1ē Fe2+ Уравнение
- 94. Окислительно-восстановительные электроды Например: Pt [Fe (CN)6]3- [Fe (CN)6]4- Электродная реакция: [Fe(CN)6]3- + 1e- [Fe(CN)6]4- Уравнение Нернста-Петерса:
- 95. Окислительно-восстановительные электроды В сложных электродах в осуществлении электродной реакции помимо окисленной и восстановленной форм принимают участие
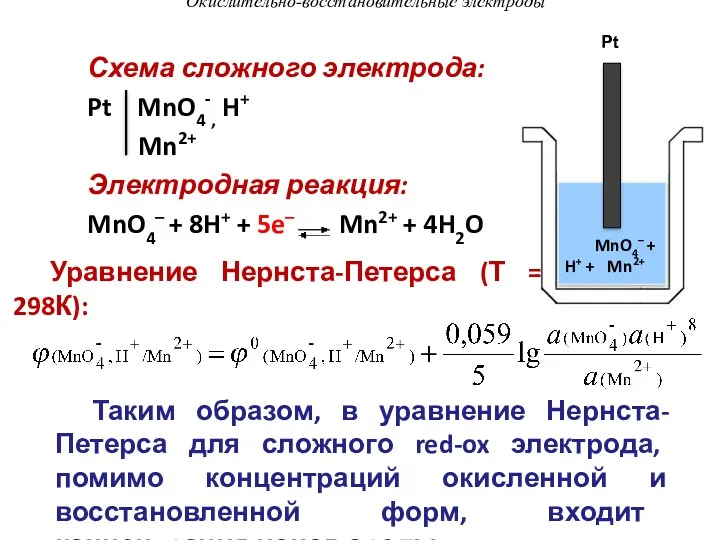
- 96. Окислительно-восстановительные электроды Схема сложного электрода: Pt MnO4-, H+ Mn2+ Электродная реакция: MnO4– + 8H+ + 5e–
- 97. Типы электродов по назначению Электроды сравнения Электроды определения
- 98. Электроды сравнения – электроды, потенциалы которых известны, постоянны и воспроизводимы. Водородный электрод сложен по конструкции и
- 99. Электроды сравнения В медико-биологических исследованиях в качестве электрода сравнения широко используют хлорсеребряный электрод. В насыщенном растворе
- 100. Основные требования к электродам определения - специфичность, селективность, высокая чувствительность к концентрации определенных ионов. Электроды определения
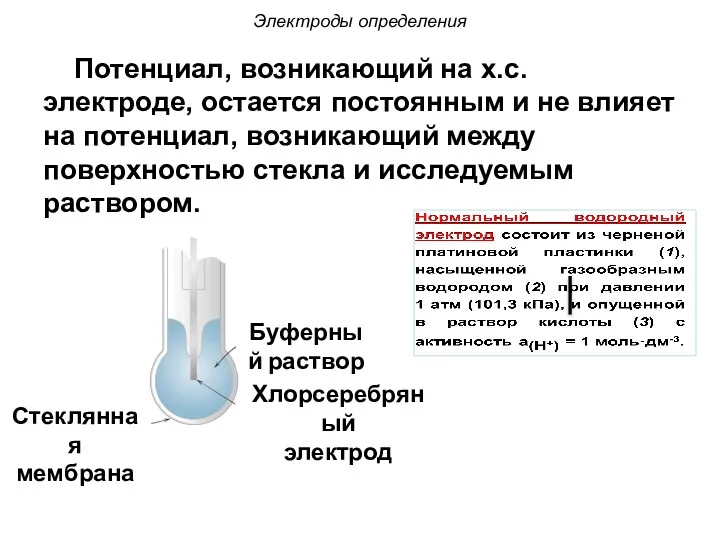
- 101. Электроды определения Наиболее распространенным электродом определения является стеклянный электрод. Он состоит из стеклянной трубки, заканчивающейся шариком
- 102. Потенциал, возникающий на х.с. электроде, остается постоянным и не влияет на потенциал, возникающий между поверхностью стекла
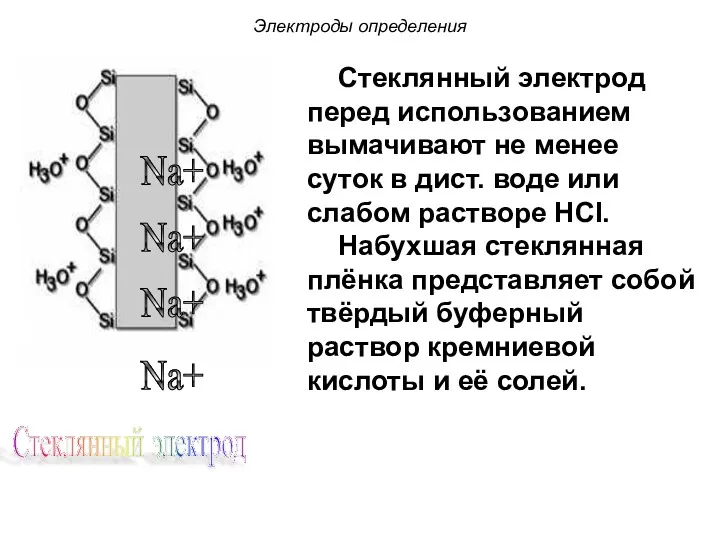
- 103. Электроды определения При помещении стеклянного электрода в раствор в поверхностный слой стекла из раствора интенсивно проникают
- 104. Стеклянный электрод Na+ Na+ Na+ Na+ Электроды определения Стеклянный электрод перед использованием вымачивают не менее суток
- 105. Электроды определения Концентрацию ионов водорода в стекле можно считать постоянной, а уравнение Нернста для стеклянного электрода
- 106. Ионоселективные электроды Это электроды, проявляющие селективное действие относительно тех или иных ионов. C их помощью стало
- 107. Электроды определения В настоящее время число ионоселективных электродов с четко выраженной селективностью к определенным ионам составляет
- 108. Вопросы для самоконтроля Как формируется ДЭС? Охарактеризуйте уравнение Нернста. По каким признакам классифицируются электроды?
- 110. Скачать презентацию




















![Уравнение Нернста: φ – электродный потенциал [В], φ0 – стандартный](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/304582/slide-59.jpg)




















![Окислительно-восстановительные электроды Например: Pt [Fe (CN)6]3- [Fe (CN)6]4- Электродная реакция:](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/304582/slide-93.jpg)










 Жедел бүйрек жетіспеушілігінің клиникалық көріністері
Жедел бүйрек жетіспеушілігінің клиникалық көріністері День трезвости
День трезвости Препараты сульфонилмочевины
Препараты сульфонилмочевины Сифилис. Исторические аспекты
Сифилис. Исторические аспекты Рекомендации ВОЗ по контролю и ведению диареи
Рекомендации ВОЗ по контролю и ведению диареи Дополнительные средства физической реабилитации. Тема 3
Дополнительные средства физической реабилитации. Тема 3 Алдыңғы ішперде қабырғасының анатомиясы. Іштің шекаралары
Алдыңғы ішперде қабырғасының анатомиясы. Іштің шекаралары Период грудного возраста
Период грудного возраста Ботулизм. Классификация
Ботулизм. Классификация Кариес зубов
Кариес зубов Недостаточность кровообращения: принципы фармакотерапии. Кардиотонические средства
Недостаточность кровообращения: принципы фармакотерапии. Кардиотонические средства Профилактика гриппа у пожилых людей
Профилактика гриппа у пожилых людей Здоровье зубов
Здоровье зубов Острая ревматическая лихорадка (болезнь Сокольского – Буйо)
Острая ревматическая лихорадка (болезнь Сокольского – Буйо) Сложное дополнение
Сложное дополнение Жатырдан тыс жүктілік. Аналық безінің апоплексиясы. Кистаның жарылуы
Жатырдан тыс жүктілік. Аналық безінің апоплексиясы. Кистаның жарылуы Расспрос больных с заболеваниями органов дыхания. Общий осмотр. Осмотр и пальпация грудной клетки. Перкуссия легких
Расспрос больных с заболеваниями органов дыхания. Общий осмотр. Осмотр и пальпация грудной клетки. Перкуссия легких Харківська інституція педіатричної гастроентерології – підґрунтя здоров’я населення міста Харкова
Харківська інституція педіатричної гастроентерології – підґрунтя здоров’я населення міста Харкова Сухой глаз в работе врача первичного звена
Сухой глаз в работе врача первичного звена Гинекологиялық науқастардан анамнез жинау
Гинекологиялық науқастардан анамнез жинау Ревматология. Иммуногенетика
Ревматология. Иммуногенетика Первая доврачебная помощь при ДТП
Первая доврачебная помощь при ДТП Депрессивные расстройства в неврологии
Депрессивные расстройства в неврологии Егде жастағы және қарттардың тамақтануы
Егде жастағы және қарттардың тамақтануы General physiology of receptors system. Somatic sensations: the tactile and position senses, pain, headache
General physiology of receptors system. Somatic sensations: the tactile and position senses, pain, headache Инсульт деген не. Қауіп қатер факторлары
Инсульт деген не. Қауіп қатер факторлары Kanser geli̇şi̇mi̇
Kanser geli̇şi̇mi̇ Туляремия
Туляремия