Содержание
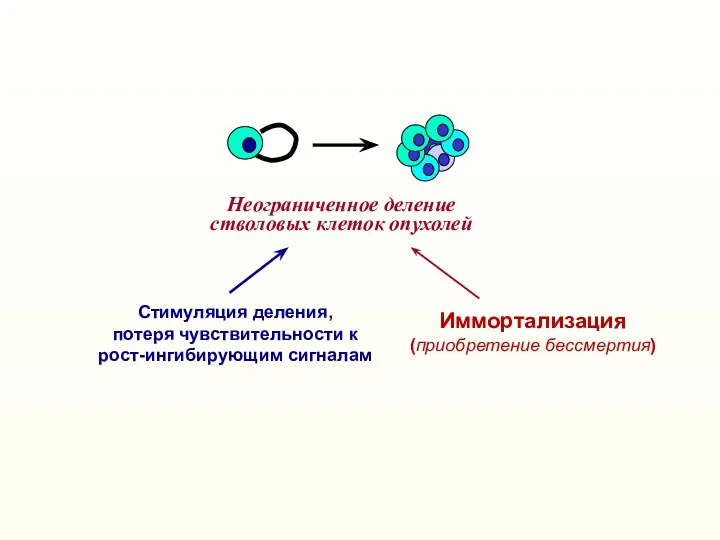
- 2. Неограниченное деление стволовых клеток опухолей Стимуляция деления, потеря чувствительности к рост-ингибирующим сигналам Иммортализация (приобретение бессмертия)
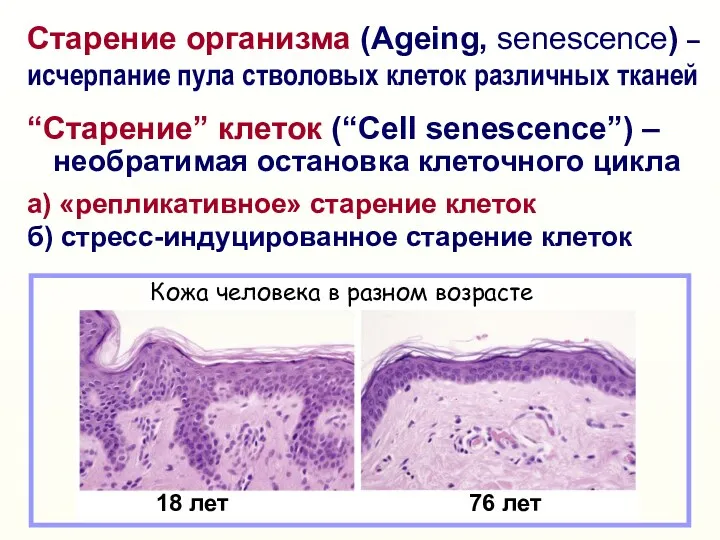
- 3. Старение организма (Ageing, senescence) – исчерпание пула стволовых клеток различных тканей “Старение” клеток (“Cell senescence”) –
- 4. Иммортализация – отмена репликативного клеточного старения Нормальные клетки могут быть иммортальны – эмбриональные стволовые клетки Старение
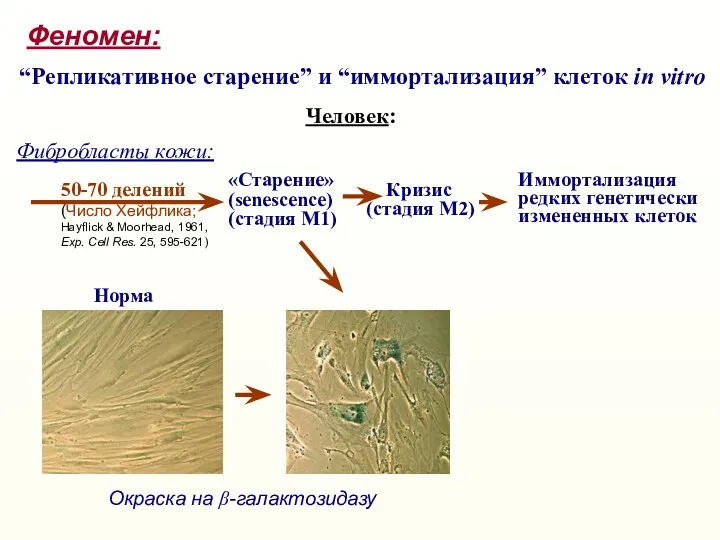
- 5. Феномен: “Репликативное старение” и “иммортализация” клеток in vitro Человек: 50-70 делений (Число Хейфлика; Hayflick & Moorhead,
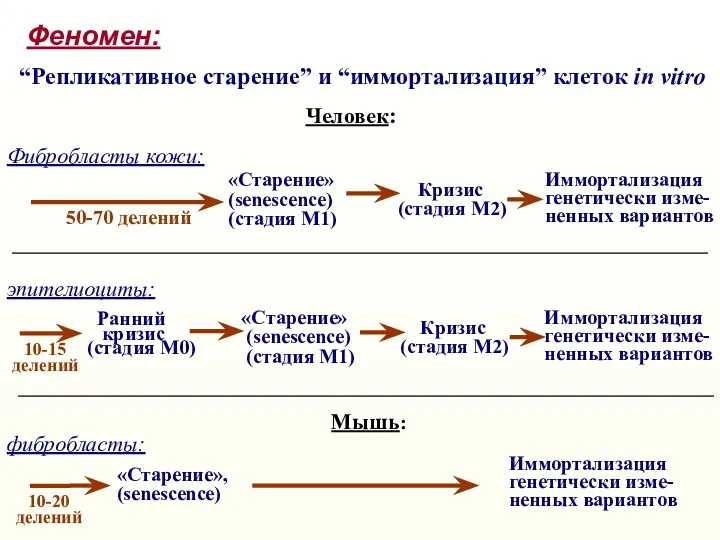
- 6. Феномен: “Репликативное старение” и “иммортализация” клеток in vitro Человек: 50-70 делений Фибробласты кожи: Иммортализация генетически изме-
- 7. Иммортализация – отмена репликативного клеточного старения Опухолевые клетки иммортальны – перевиваемые линии клеток (асцит Эрлиха, HeLa
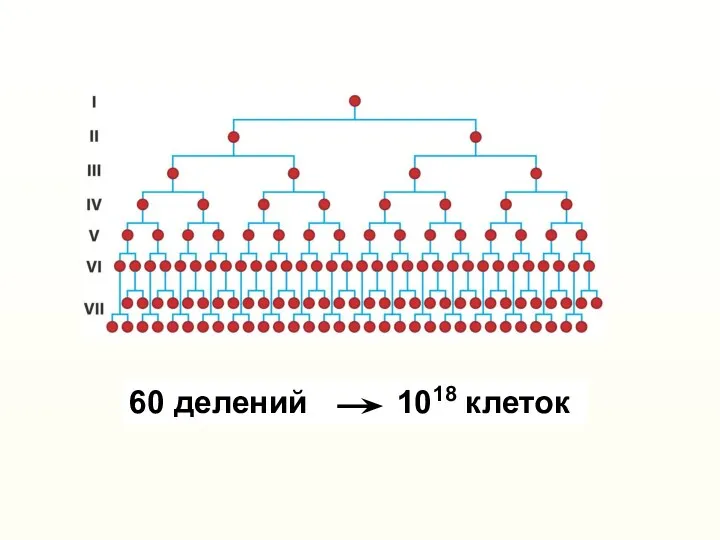
- 8. 60 делений 1018 клеток
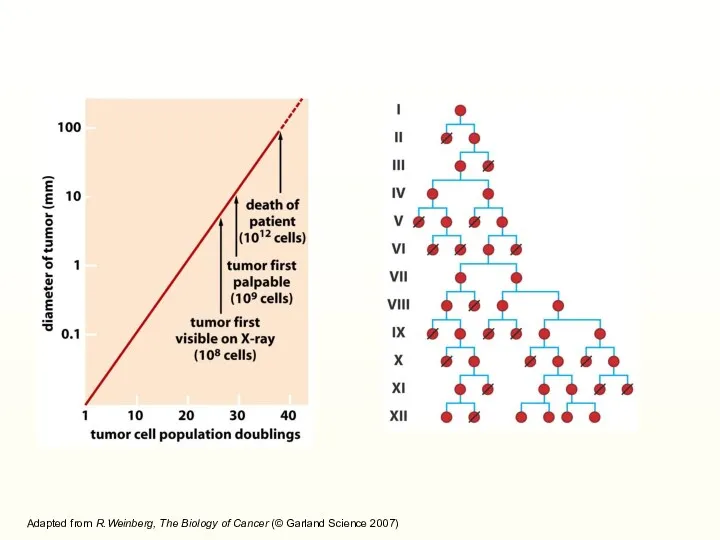
- 9. Adapted from R.Weinberg, The Biology of Cancer (© Garland Science 2007)
- 10. Наиболее общие признаки репликативного старения клеток Необратимый арест пролиферации (не может быть отменен физиологическими стимулами) Увеличение
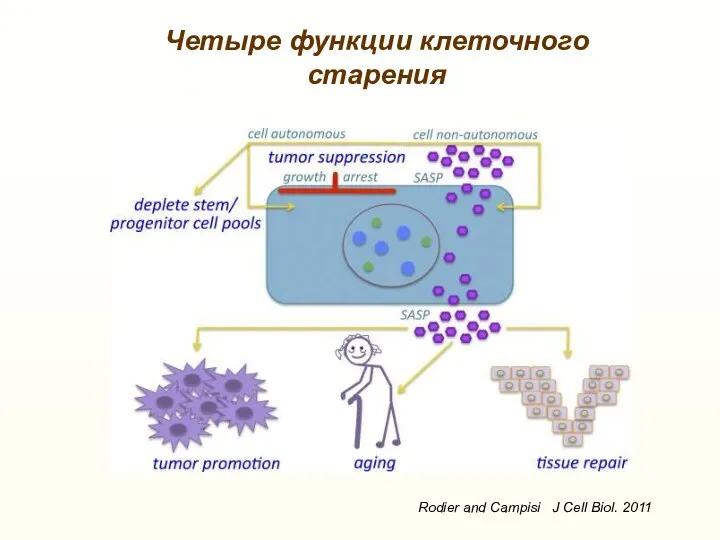
- 11. Четыре функции клеточного старения Rodier and Campisi J Cell Biol. 2011
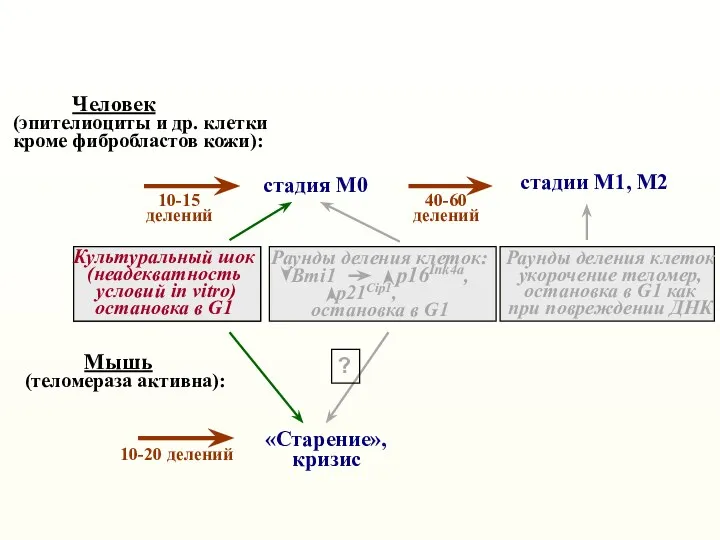
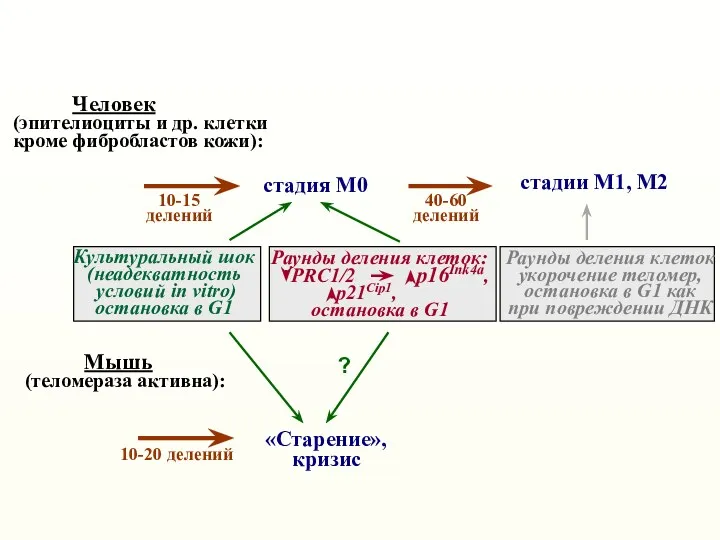
- 12. стадия М0 стадии М1, М2 Человек (эпителиоциты и др. клетки кроме фибробластов кожи): «Старение», кризис Мышь
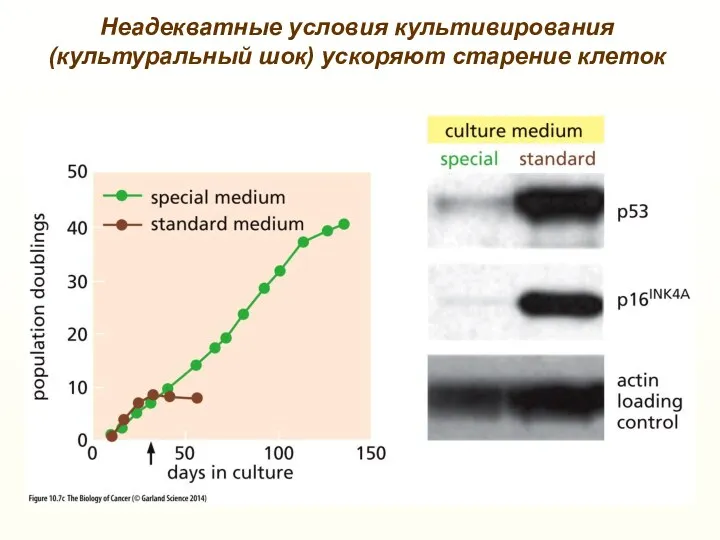
- 13. Неадекватные условия культивирования (культуральный шок) ускоряют старение клеток
- 14. стадия М0 стадии М1, М2 Человек (эпителиоциты и др. клетки кроме фибробластов кожи): «Старение», кризис Мышь
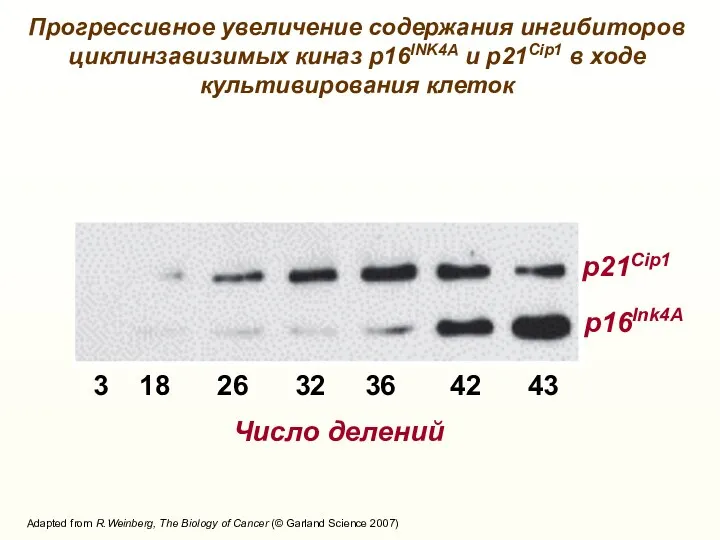
- 15. Число делений 3 18 26 32 36 42 43 p21Cip1 p16Ink4А Adapted from R.Weinberg, The Biology
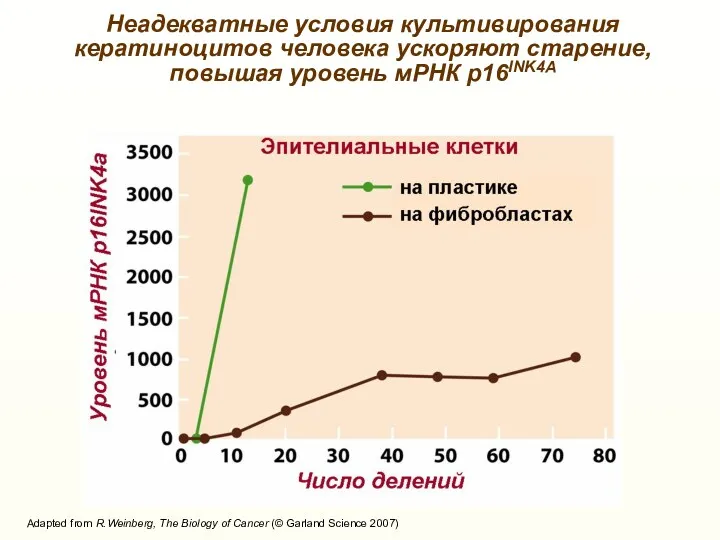
- 16. Adapted from R.Weinberg, The Biology of Cancer (© Garland Science 2007) Неадекватные условия культивирования кератиноцитов человека
- 17. Роль р16Ink4a в «старении» гемопоэтических cтволовых клеток (ГСК) in vivo 1. В популяции отсортированных ГСК уровень
- 18. Репликативное старение стволовых и недифференцированных клеток in vivo Ключевой механизм – увеличение содержания p16Ink4a вследствие инактивации
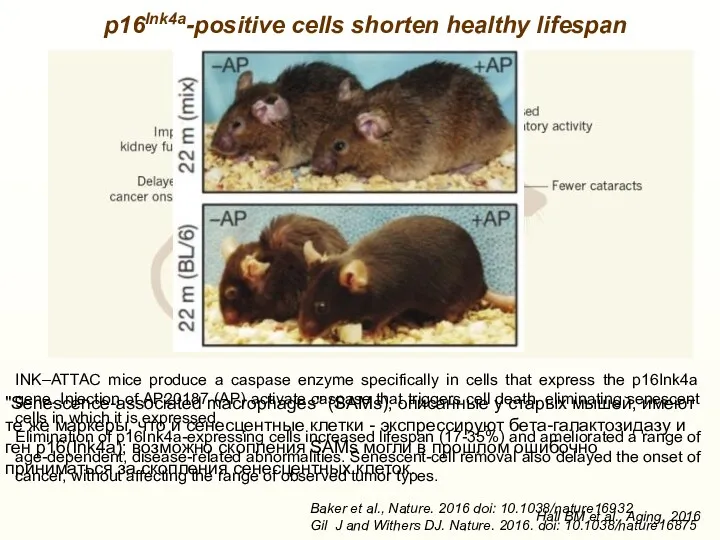
- 19. p16Ink4a-positive cells shorten healthy lifespan Baker et al., Nature. 2016 doi: 10.1038/nature16932 Gil J and Withers
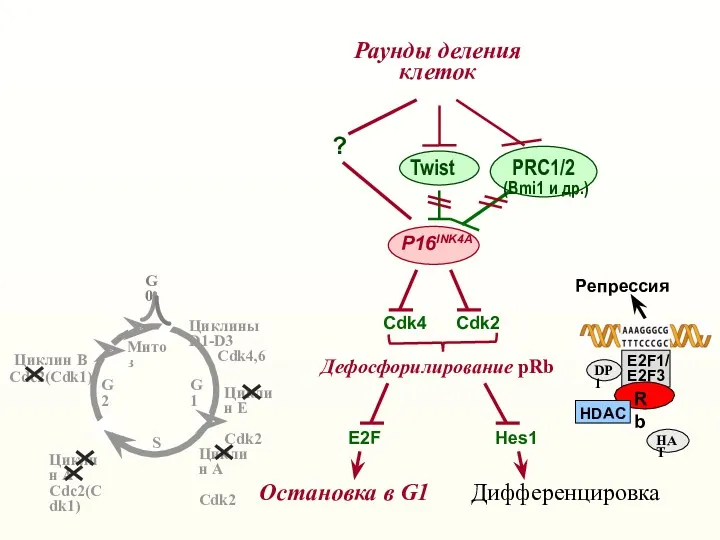
- 20. Раунды деления клеток Cdk4 Cdk2 Остановка в G1 P16INK4A PRC1/2 (Bmi1 и др.) ? Дефосфорилирование pRb
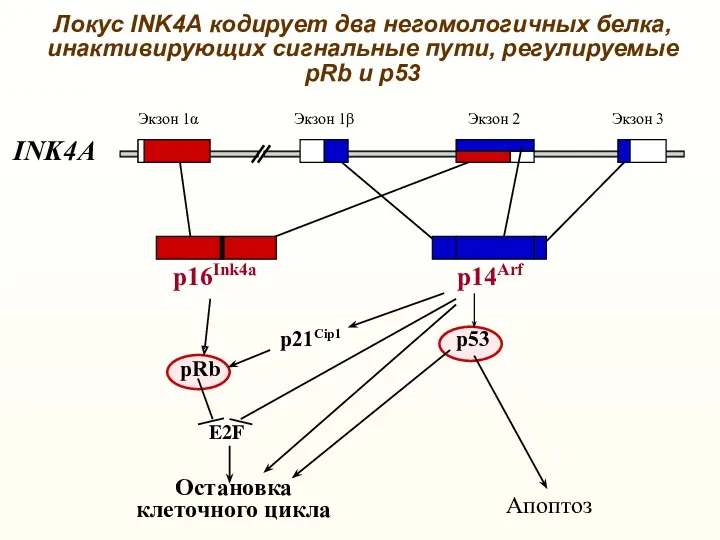
- 21. Локус INK4А кодирует два негомологичных белка, инактивирующих сигнальные пути, регулируемые pRb и p53
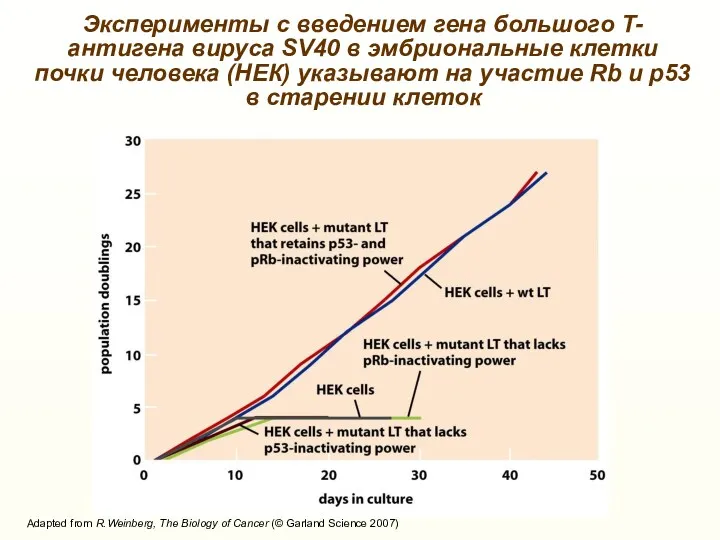
- 22. Adapted from R.Weinberg, The Biology of Cancer (© Garland Science 2007) Эксперименты с введением гена большого
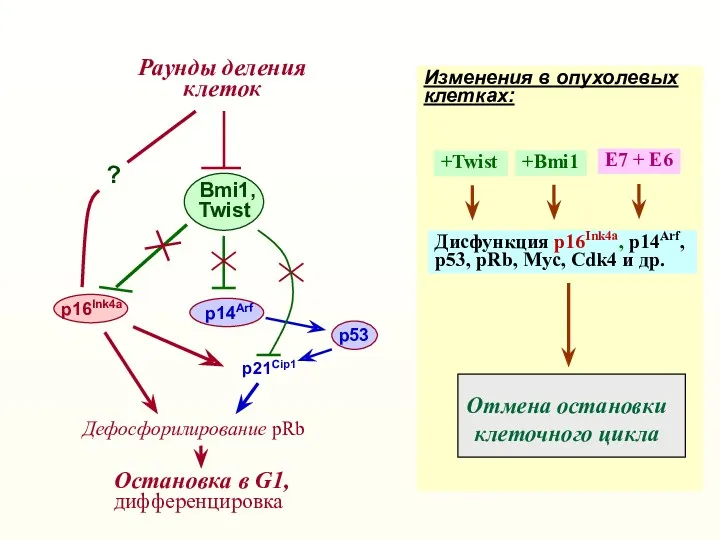
- 23. Раунды деления клеток p21Cip1 Остановка в G1, дифференцировка p16Ink4a Bmi1, Twist p53 p14Arf Отмена остановки клеточного
- 24. Другие функции Bmi1 Компонент PRC1 комплекса, участвующего в ремоделировании структуры хроматина и модификации гистонов Активирован во
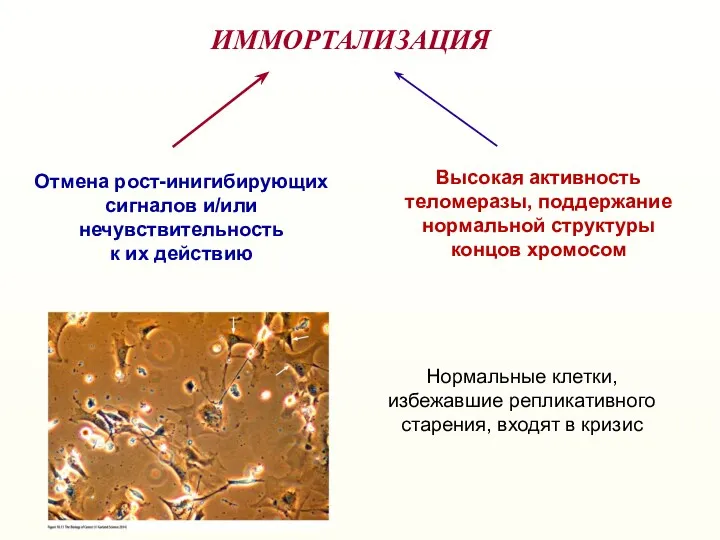
- 25. ИММОРТАЛИЗАЦИЯ Отмена рост-инигибирующих сигналов и/или нечувствительность к их действию Высокая активность теломеразы, поддержание нормальной структуры концов
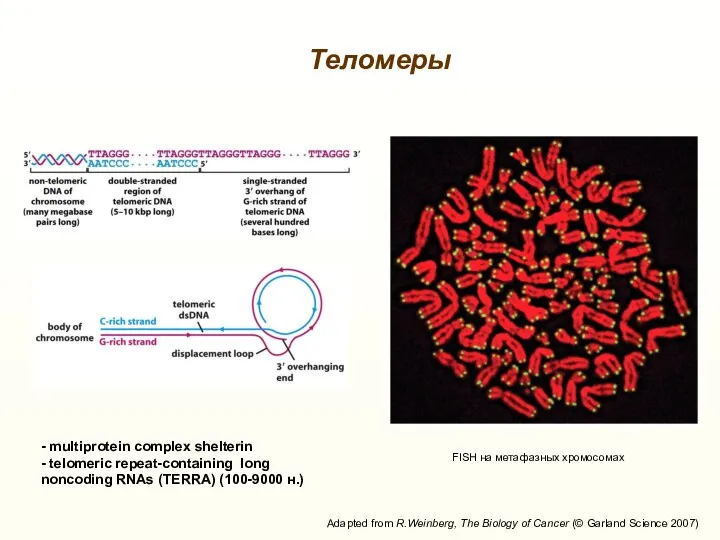
- 26. Adapted from R.Weinberg, The Biology of Cancer (© Garland Science 2007) FISH на метафазных хромосомах Теломеры
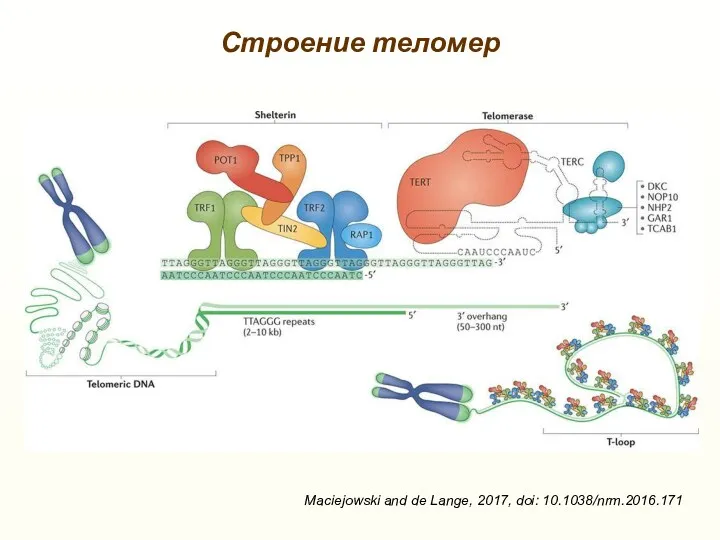
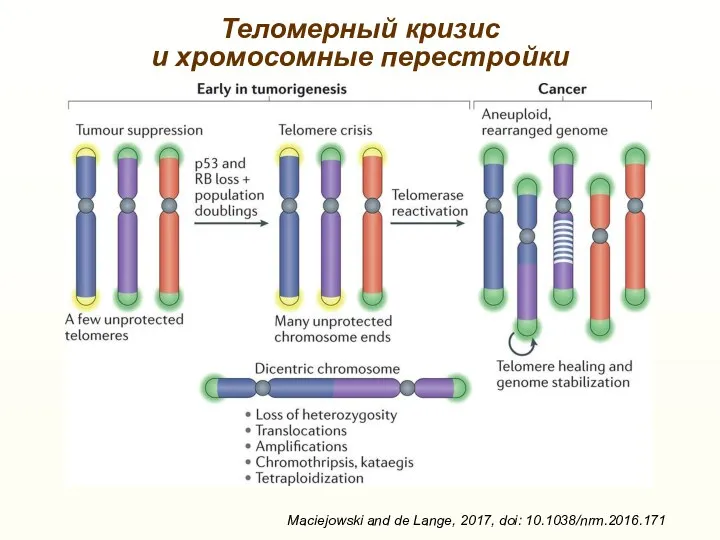
- 27. Строение теломер Maciejowski and de Lange, 2017, doi: 10.1038/nrm.2016.171
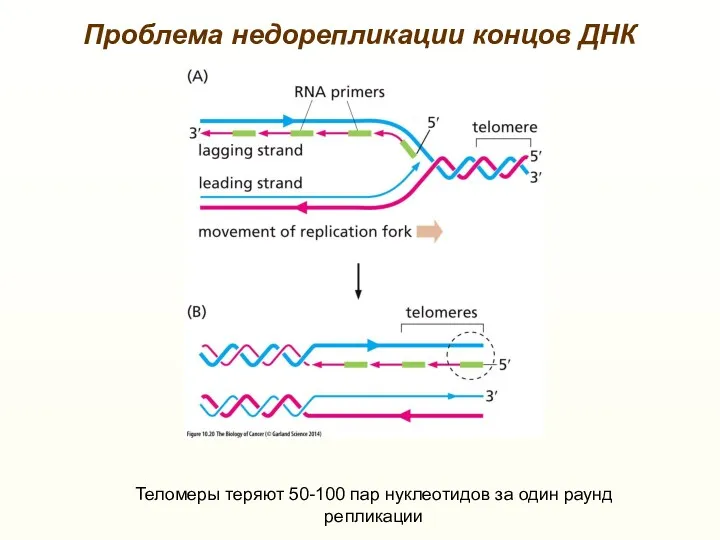
- 28. Проблема недорепликации концов ДНК Теломеры теряют 50-100 пар нуклеотидов за один раунд репликации
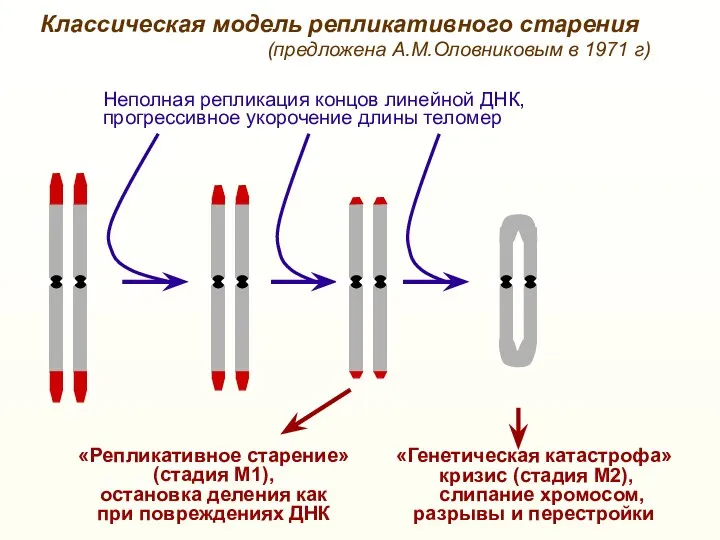
- 29. «Репликативное старение» (стадия М1), остановка деления как при повреждениях ДНК «Генетическая катастрофа» кризис (стадия М2), слипание
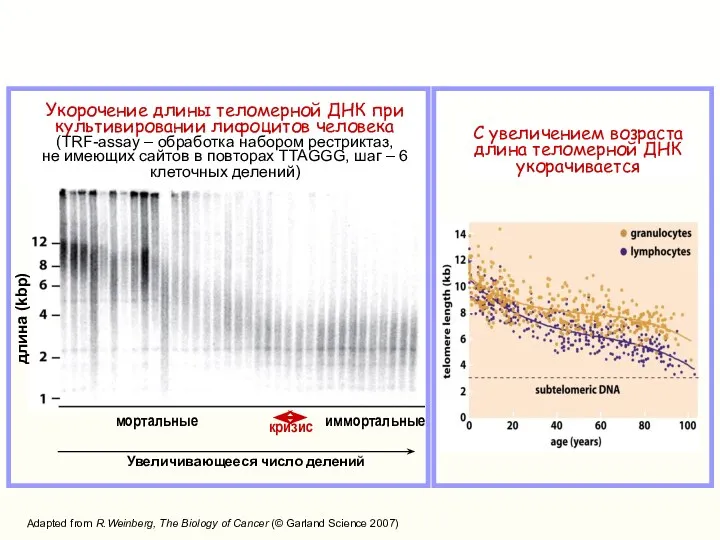
- 30. кризис мортальные иммортальные Увеличивающееся число делений длина (kbp) Укорочение длины теломерной ДНК при культивировании лифоцитов человека
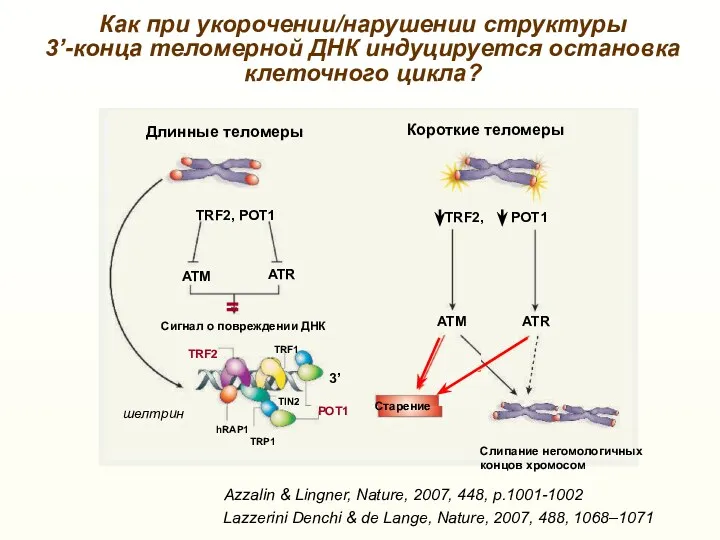
- 31. Как при укорочении/нарушении структуры 3’-конца теломерной ДНК индуцируется остановка клеточного цикла? Azzalin & Lingner, Nature, 2007,
- 32. Теломерный кризис и хромосомные перестройки Maciejowski and de Lange, 2017, doi: 10.1038/nrm.2016.171
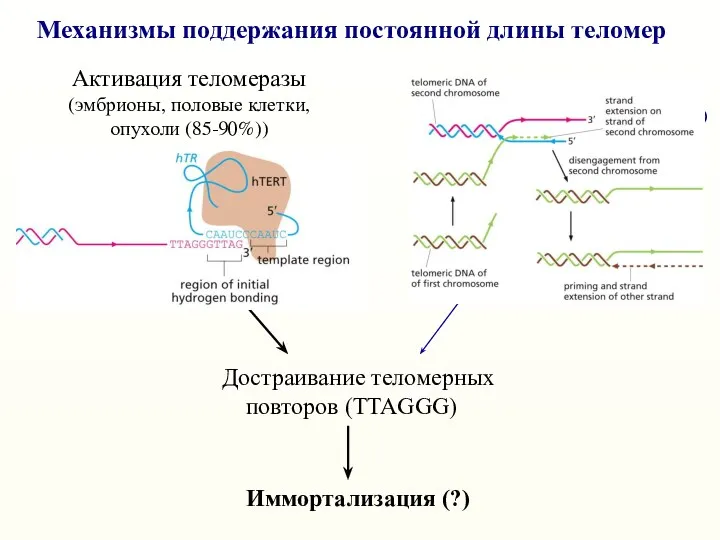
- 33. Механизмы поддержания постоянной длины теломер Активация теломеразы (эмбрионы, половые клетки, опухоли (85-90%)) ALT (Alternative Lengthening of
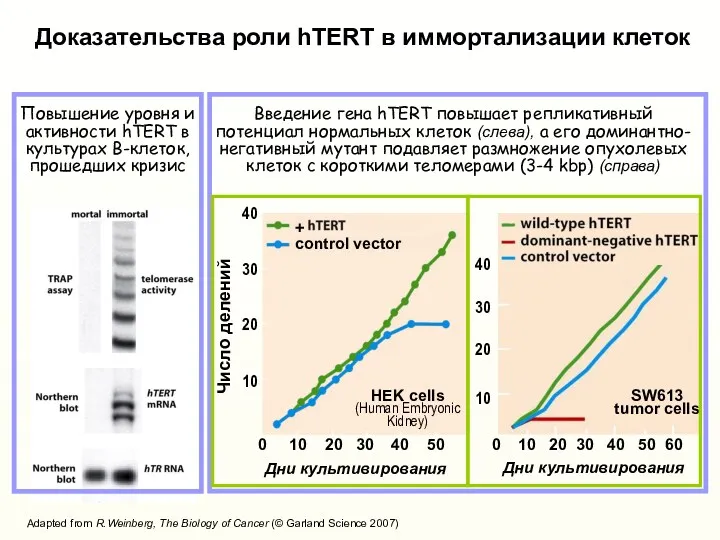
- 34. Введение гена hTERT повышает репликативный потенциал нормальных клеток (слева), а его доминантно-негативный мутант подавляет размножение опухолевых
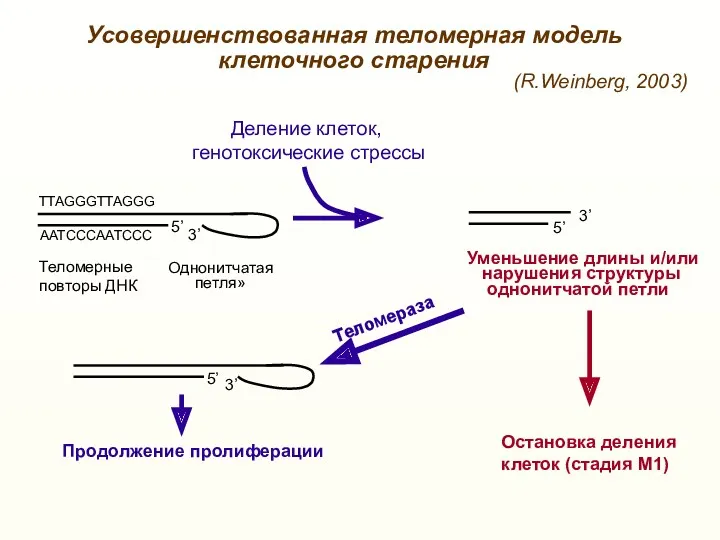
- 35. Усовершенствованная теломерная модель клеточного старения Теломерные повторы ДНК Однонитчатая петля» ТTAGGGTTAGGG 5’ 3’ AATCCCAATCCC 5’ 3’
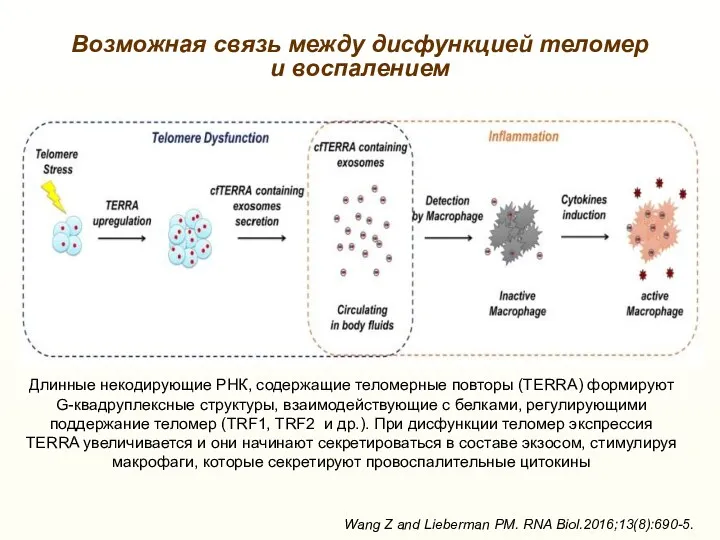
- 36. Возможная связь между дисфункцией теломер и воспалением Wang Z and Lieberman PM. RNA Biol.2016;13(8):690-5. Длинные некодирующие
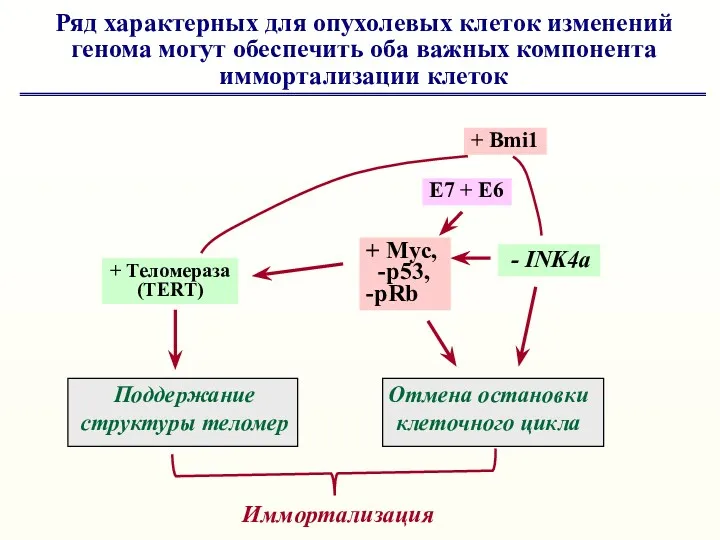
- 37. + Теломераза (TERT) Поддержание структуры теломер Отмена остановки клеточного цикла - INK4a Е7 + Е6 +
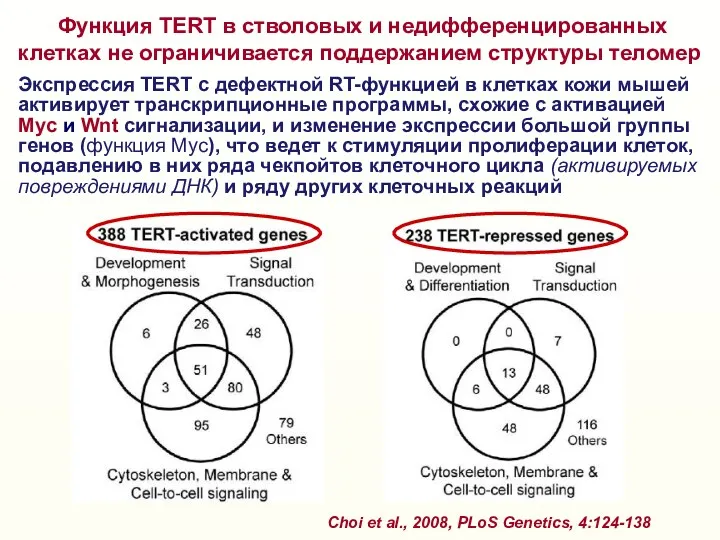
- 38. Функция TERT в стволовых и недифференцированных клетках не ограничивается поддержанием структуры теломер Choi et al., 2008,
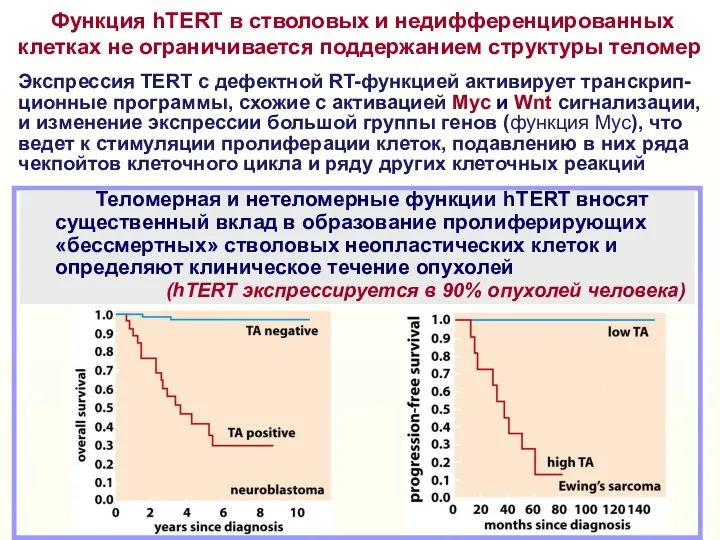
- 39. Функция hTERT в стволовых и недифференцированных клетках не ограничивается поддержанием структуры теломер Экспрессия TERT с дефектной
- 40. Активация сигнальных путей факторов роста, Wnt, NF-κB Усиление стволовых характеристик клетки Улучшение рибосомного биогенеза Подавление апоптоза
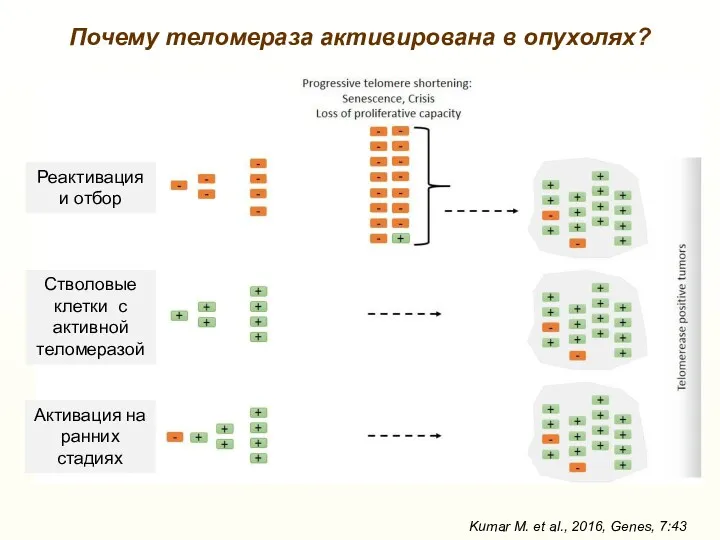
- 41. Почему теломераза активирована в опухолях? Kumar M. et al., 2016, Genes, 7:43
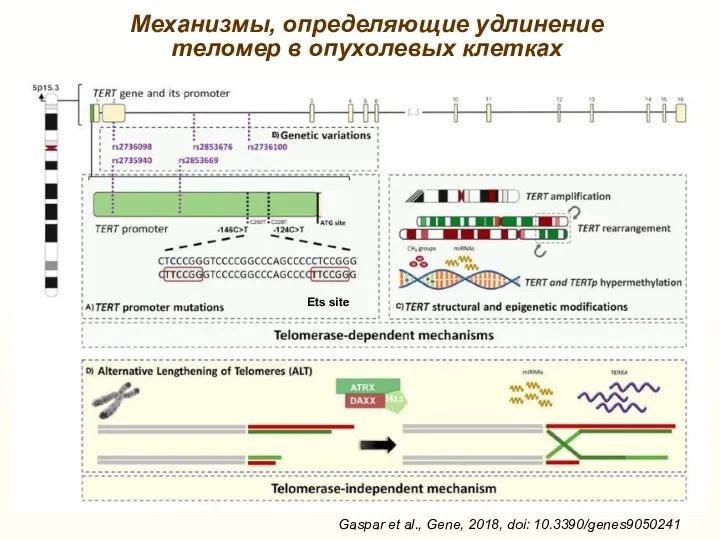
- 42. Механизмы, определяющие удлинение теломер в опухолевых клетках Gaspar et al., Gene, 2018, doi: 10.3390/genes9050241 Ets site
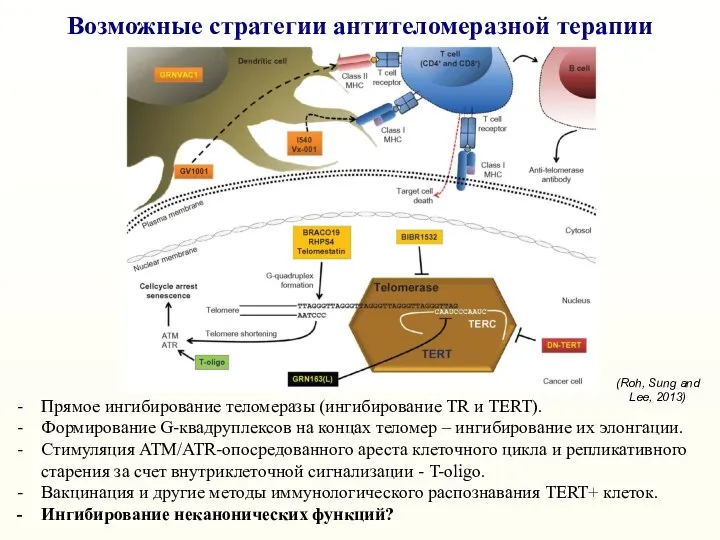
- 43. Возможные стратегии антителомеразной терапии Прямое ингибирование теломеразы (ингибирование TR и TERT). Формирование G-квадруплексов на концах теломер
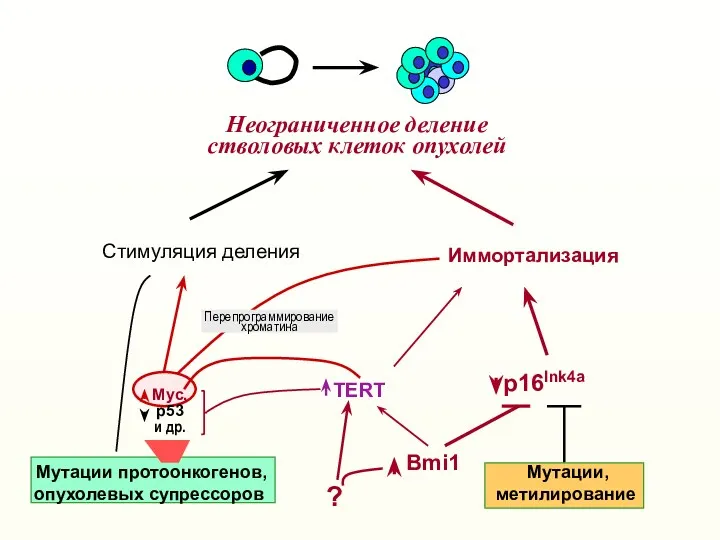
- 44. Неограниченное деление стволовых клеток опухолей Стимуляция деления Иммортализация TERT Bmi1 p16Ink4a ? Myтации протоонкогенов, опухолевых супрессоров
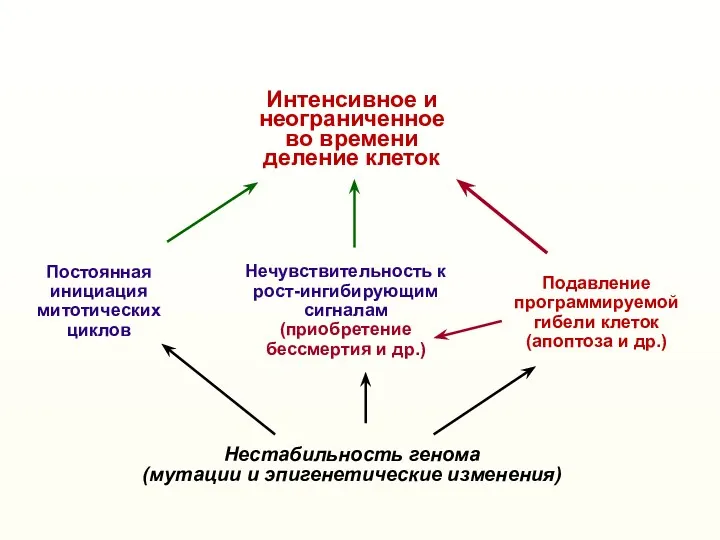
- 45. Нестабильность генома (мутации и эпигенетические изменения) Нечувствительность к рост-ингибирующим сигналам (приобретение бессмертия и др.) Постоянная инициация
- 46. Способы программируемой гибели клеток: Апоптоз 2. Митотическая катастрофа 3. Аутофагия 4. Некроптоз 5. Энтоз
- 48. Скачать презентацию








 Рахіт: причини, фактори, лікування
Рахіт: причини, фактори, лікування Сосудистый тонус и его компоненты
Сосудистый тонус и его компоненты Эпидемиология наркоманий и токсикоманий. Соматические нарушения при болезнях зависимости
Эпидемиология наркоманий и токсикоманий. Соматические нарушения при болезнях зависимости Микола Михайлович Амосов
Микола Михайлович Амосов Методы обследования беременной в женской консультации
Методы обследования беременной в женской консультации Плеврит. Основные формы плевритов
Плеврит. Основные формы плевритов Экстрапирамидалық жүйе жане мишық зақымдану синдромы
Экстрапирамидалық жүйе жане мишық зақымдану синдромы Клинико-психологическая характеристика акалькулии и дискалькулии детского возраста
Клинико-психологическая характеристика акалькулии и дискалькулии детского возраста Тұлғалық сұрақнама, медицинадағы соматикалық науқастардың психофизикалық қалпын клиникалық стандартын бағалау шкаласы
Тұлғалық сұрақнама, медицинадағы соматикалық науқастардың психофизикалық қалпын клиникалық стандартын бағалау шкаласы Методы физиотерапии в реабилитации онкологических больных
Методы физиотерапии в реабилитации онкологических больных Вирусные гепатиты
Вирусные гепатиты Топографическая анатомия нижней конечности. Области мышечной и сосудистой лакуны, бедра, подколенная ямка, ягодичная область
Топографическая анатомия нижней конечности. Области мышечной и сосудистой лакуны, бедра, подколенная ямка, ягодичная область Экстракорпоральные методы коррекции волемического статуса у пациентов в критических состояниях
Экстракорпоральные методы коррекции волемического статуса у пациентов в критических состояниях Имплантаты в стоматологии
Имплантаты в стоматологии Избранные вопросы интенсивной терапии неотложных состояний у детей
Избранные вопросы интенсивной терапии неотложных состояний у детей Психоорганический синдром и когнитивные нарушения – взгляд психиатра
Психоорганический синдром и когнитивные нарушения – взгляд психиатра Доғалы протез
Доғалы протез Тромбопрофилактика у пациентов с ФП как путь снижения смертности от неинфекционных заболеваний
Тромбопрофилактика у пациентов с ФП как путь снижения смертности от неинфекционных заболеваний Шок. Общие патофизиологические аспекты шока. Контрольные вопросы
Шок. Общие патофизиологические аспекты шока. Контрольные вопросы Балалардағы ауыз қуысы шырышты қабатының аурулары
Балалардағы ауыз қуысы шырышты қабатының аурулары Папулосквамозні дерматози
Папулосквамозні дерматози СПИД – последняя, смертельная стадия ВИЧ-инфекции. Часть 2
СПИД – последняя, смертельная стадия ВИЧ-инфекции. Часть 2 Гемофильная инфекция
Гемофильная инфекция Синдром поликистозных яичников
Синдром поликистозных яичников ҚР дәрілік заттарға сараптаманы жүргізу ережесі мен тәртібі
ҚР дәрілік заттарға сараптаманы жүргізу ережесі мен тәртібі Ведение физиологических родов
Ведение физиологических родов Аутоиммунный гепатит. Перекрест с первичным биллиарным холангитом
Аутоиммунный гепатит. Перекрест с первичным биллиарным холангитом Болезни оперированного желудка. Демпинг-синдром
Болезни оперированного желудка. Демпинг-синдром