Клеточные повреждения. Клеточные повреждения, устойчивое нарушение клеточного гомеостазиса. Классификация клеточных повреждений презентация
Содержание
- 2. КЛЕТОЧНЫЕ ПОВРЕЖДЕНИЯ Это устойчивое нарушение клеточного гомеостазиса: биохимического, структурного и функционального
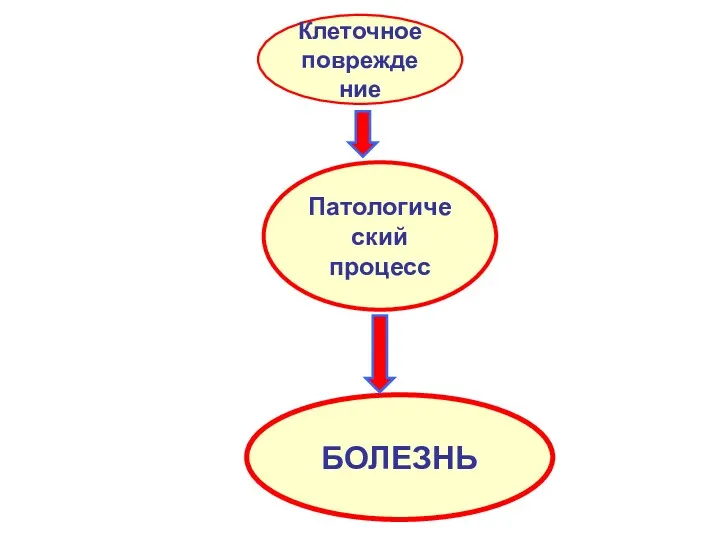
- 3. Клеточное повреждение Патологический процесс БОЛЕЗНЬ
- 4. КЛАССИФИКАЦИЯ КЛЕТОЧНЫХ ПОВРЕЖДЕНИЙ: По последовательности возникновения: 1. первичные (вызваны непосредственно патогенным фактором) 2. вторичные (вызваны первичными
- 5. По специфичности: 1. специфические (соответствуют характеру патогенного фактора) 2. неспецифические (одинаковы для многих патогенных факторов)
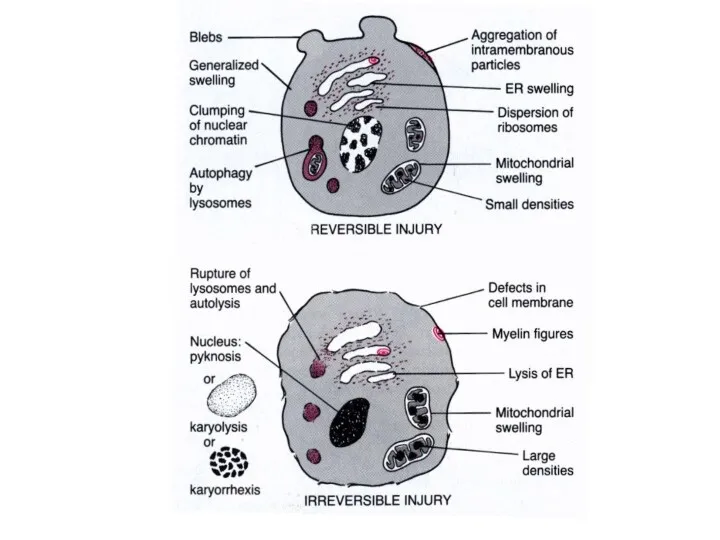
- 6. По характеру обратимости: обратимые 2. необратимые
- 7. По локализации: повреждения клеточной мембраны; повреждения митохондрий; повреждения лизосом; повреждения ядра; повреждения эндоплазматического ретикулума; повреждения цитоскелета
- 8. В зависимости от клеточной структуры вовлеченной в патологический процесс: ▬ Мембранопатии ▬ Митохондриальные нарушения ▬ Нарушения
- 9. КЛЕТОЧНАЯ МЕМБРАНА первый барьер на пути действия повреждающих факторов Механические Физические Химические Осмотические Свободные радикалы Инфекционные
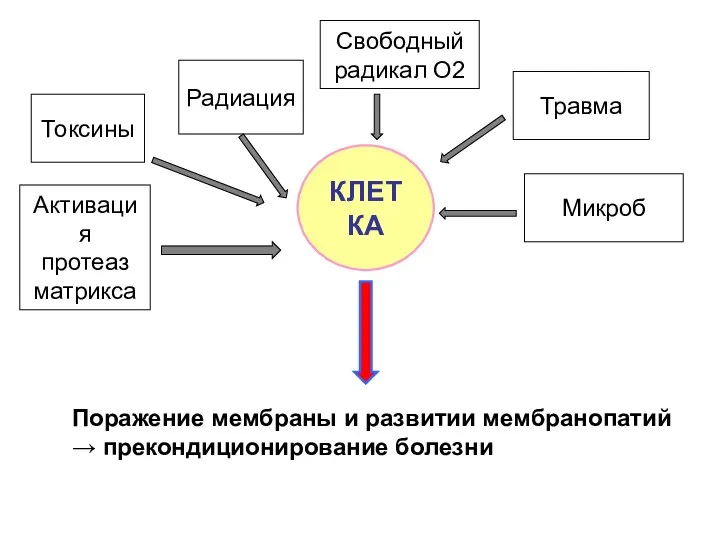
- 10. Поражение мембраны и развитии мембранопатий → прекондиционирование болезни КЛЕТКA Токсины Радиация Свободный радикал О2 Травма Активация
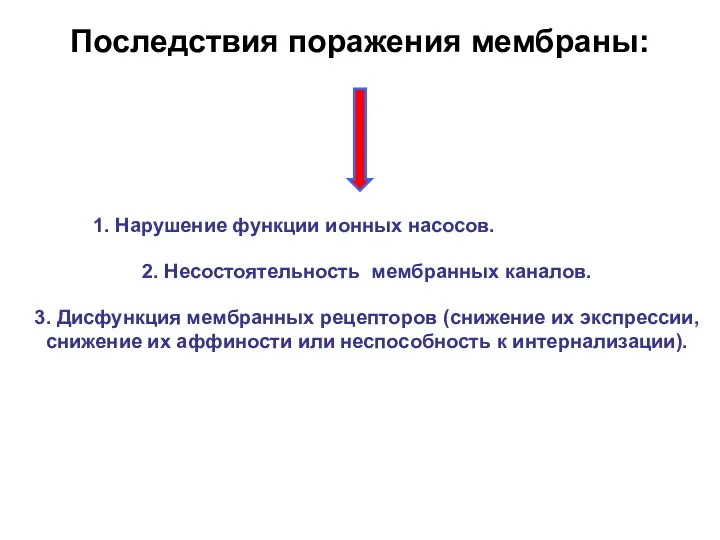
- 11. Последствия поражения мембраны: 1. Нарушение функции ионных насосов. 2. Несостоятельность мембранных каналов. 3. Дисфункция мембранных рецепторов
- 12. Нарушения гомеостаза клеточных ионов ▬ Потеря внутриклеточного калия. ▬ Избыточный вход натрия и кальция в клетку.
- 13. Потеря внутриклеточного калия – гиперполяризация Избыток внутриклеточного натрия – гиперосмолярность, отёк клетки, осмогенный цитолиз снижение потенциала
- 14. Нарушения межклеточных электрических контактов из-за снижения экспресии конексинов (Сх43, 45) Нарушение проводимости потенциала гипер– и деполяризации
- 15. Избыток кальция в цитоплазме: ▬ активация АТФ-аз; ▬ усиление распада АТФ и энергодефицит; ▬ активация протеаз
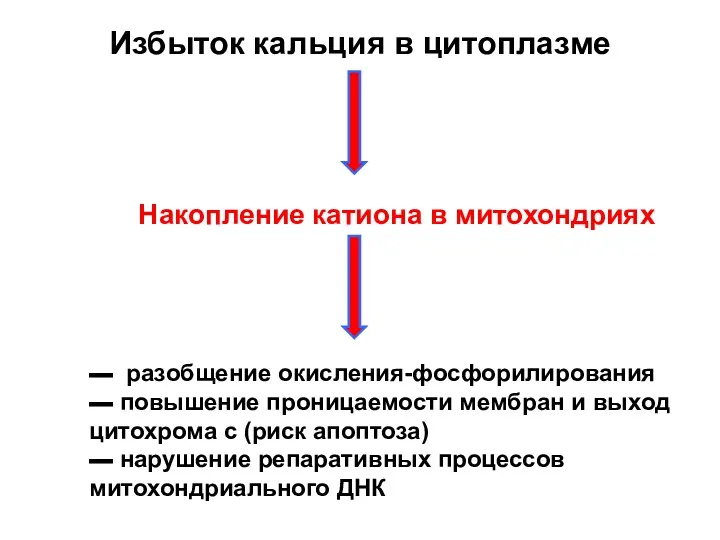
- 16. Избыток кальция в цитоплазме Накопление катиона в митохондриях ▬ разобщение окисления-фосфорилирования ▬ повышение проницаемости мембран и
- 17. Внутриклеточное накопление протонов водорода: ►aцидоз клетки pH ►ингибирование ферментов анаэробного гликолиза ►дефицит энергии активация лизосомальных ферментов
- 18. ПАТОЛОГИЧЕСКИЕ ПРОЦЕССЫ ВСЛЕДСТВИЕ ПОВРЕЖДЕНИЯ МЕМБРАНЫ Клеточные дистрофии Aпоптоз Аутофагия Онкозис Некробиоз Некроз
- 19. ПОВРЕЖДЕНИЯ ЦИТОСКЕЛЕТА Повреждения микроканальцев (20-25 nm); микронитей (15 nm); актина и миозина; Нарушается: форма клетки; внутриклеточная
- 20. ПОСЛЕДСТВИЯ ПОВРЕЖДЕНИЙ ЦИТОСКЕЛЕТА: Иммобилизация сперматозоидов Иммобилизация реснитчатого эпителия Иммобилизация лейкоцитов (ленивые лейкоциты) Нарушение фагоцитоза Нарушение митоза
- 21. ПОВРЕЖДЕНИЯ КЛЕТОЧНОГО ЯДРА Конденсация и маргинализация хроматина, кариопикноз, кариорексис, кариолизис, мутации.
- 22. ПОСЛЕДСТВИЯ ПОВРЕЖДЕНИЯ КЛЕТОЧНОГО ЯДРА ● замедление клеточного цикла, нарушение пролиферации и тканевой регенерации; ● ускорение клеточного
- 23. ПОВРЕЖДЕНИЯ МИТОХОНДРИЙ Набухание Разобщение окисления и фосфорилирования Угнетение окислительных реакций Угнетение цитохромоксидаз Снижение экспрессии коэнзима Q10
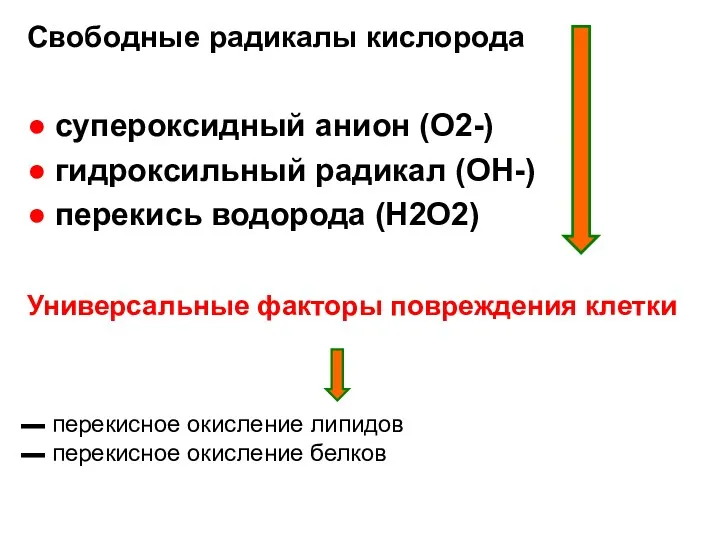
- 24. Свободные радикалы кислорода ● супероксидный анион (O2-) ● гидроксильный радикал (OH-) ● перекись водорода (H2O2) Универсальные
- 25. Источники свободных радикалов О2: 1. Дыхательныя цепь митохондрий (>80%). 2. Метаболизм пуриновых оснований с участием гипо-
- 26. Повреждающее действие СРК на клетку обозначается как оскидативный стресс. Активность оксидативного стресса зависит от антиоксидантной защиты:
- 27. Повреждение митохондриального ДНК: основа наследственных или приобретенных митохондриальных заболеваний. Мит-ДНК в 10 раз более уязвим, чем
- 28. Поражение митохондриального ДНК: Многократное увеличение продукции свободных радикалов кислорода. 2. Нарушение продукции АТФ. 3. Способствует и
- 29. Гипоксия и ишемия (одни из главных факторов заболеваний) проявляют своё повреждающее действие посредством дефицита АТФ и
- 30. Поражения лизосом: Дестабилизация или лабилизация мембраны (несостоятельность сохранения гидролаз внутри органеллы). Перфорация мембраны (массивный выход в
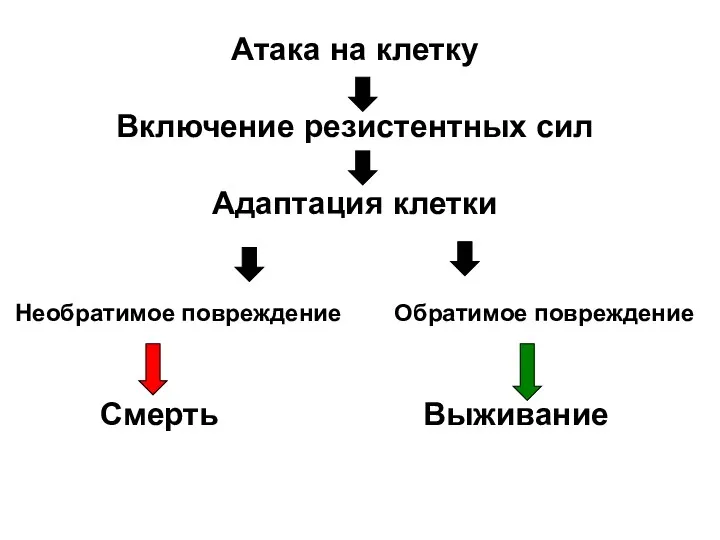
- 32. Атака на клетку Включение резистентных сил Адаптация клетки Необратимое повреждение Обратимое повреждение Смерть Выживание
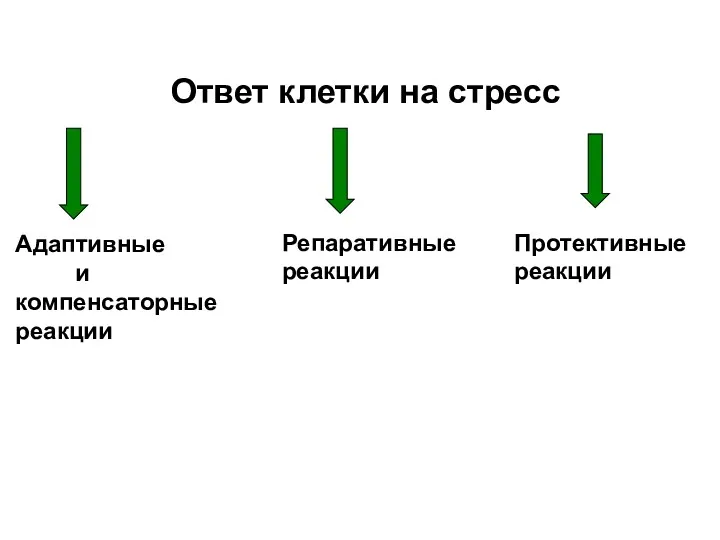
- 33. Ответ клетки на стресс Адаптивные и компенсаторные реакции Репаративные реакции Протективные реакции
- 34. Приспособительные и компенсаторные реакции ● Мобилизация «резервных» молекул и органелл. ● Гиперактивация метаболизма : (активация окисления
- 35. РЕПАРАТИВНЫЕ РЕАКЦИИ 1. Регенерация митохондрий 2. Репарация ДНК: отщепление поврежденного участка (эндонуклеазы); расщепление отторгнутого участка (экзонуклеазы);
- 36. ЗАЩИТНЫЕ РЕАКЦИИ ◙ антиоксидантные системы клетки витамины Е, A, K, С (убихинон или (кофермент Q) супероксид-дисмутаза
- 37. Стабилизаторы лизосомальных мембран – глюкокортикоиды холестерин, витамин Е, витамин С N.B. Змеиный яд (кроматин гремучей змеи)
- 38. Белки теплового шока (клеточного стресса) hsp 84-110 Kda: “stress – block”; “stress-start”; hsp 70 Kda –
- 39. Гены ранних реакций Гены c- fos и c-jun: - не экспрессируются во взрослых клетках, однако могут
- 40. Aнтионкогены Aнтионкоген Rb продуцирует белок p53: при мутациях останавливает митоз в фазе G1, исправляет ошибку либо
- 42. Скачать презентацию































 Жүктілік пен босану кезіндегі ұрықтың жағдайын бағалау. Қосымша зерттеу әдістері
Жүктілік пен босану кезіндегі ұрықтың жағдайын бағалау. Қосымша зерттеу әдістері Потребность пациента в пище и жидкости. Организация питания в стационаре
Потребность пациента в пище и жидкости. Организация питания в стационаре Дәрілік заттардың өзара әрекеттесуі
Дәрілік заттардың өзара әрекеттесуі Өмірге қауіп төндіретін жүрекқантамыр жүйесі аурулары кезіндегі жедел көмек көрсету және диагностикалау алгоритмі
Өмірге қауіп төндіретін жүрекқантамыр жүйесі аурулары кезіндегі жедел көмек көрсету және диагностикалау алгоритмі Дисфагия и диспепсия
Дисфагия и диспепсия История анестезиологии
История анестезиологии Кардиотонические средства (КС)
Кардиотонические средства (КС) Еңбекке уақытша жарамсыздыққа сараптама жүргізу және еңбекке уақытша жарамсыздық парағын және анықтамасын беру қағидалары
Еңбекке уақытша жарамсыздыққа сараптама жүргізу және еңбекке уақытша жарамсыздық парағын және анықтамасын беру қағидалары Болезни, поражающие все части глаза
Болезни, поражающие все части глаза Иммунология. Основные понятия
Иммунология. Основные понятия Сепсистің патофизиологиясы
Сепсистің патофизиологиясы Рекомендации ВНОК по профилактике, диагностике и лечению артериальной гипертонии (второй пересмотр)
Рекомендации ВНОК по профилактике, диагностике и лечению артериальной гипертонии (второй пересмотр) Osler-Weber-Rendu Disease
Osler-Weber-Rendu Disease Физикальные и лабораторно-инструментальные методы исследования пищеварительной и мочевыделительной систем. Лекция №5
Физикальные и лабораторно-инструментальные методы исследования пищеварительной и мочевыделительной систем. Лекция №5 Деформуючий поліартрит. Рентгенограма хворого
Деформуючий поліартрит. Рентгенограма хворого Вегетарианство – за или против
Вегетарианство – за или против Гигиена нервной системы. Умственная работоспособность
Гигиена нервной системы. Умственная работоспособность Физиологические основы питания. (Лекция 11)
Физиологические основы питания. (Лекция 11) Психотропные средства
Психотропные средства Relationship of ontogenesis and phylogenesis
Relationship of ontogenesis and phylogenesis Символы медицины
Символы медицины Лекарственное обеспечение населения
Лекарственное обеспечение населения Повреждение груди
Повреждение груди Острая остановка сердца (Лекция1)
Острая остановка сердца (Лекция1) Инфекции, передаваемые половым путем. Меры их профилактики
Инфекции, передаваемые половым путем. Меры их профилактики Формирование новой модели сестринской службы в условиях реформирования сестринского дела в РК
Формирование новой модели сестринской службы в условиях реформирования сестринского дела в РК Аппендикулярлы инфильтрат
Аппендикулярлы инфильтрат Патология вилочковой железы
Патология вилочковой железы