Содержание
- 2. НОРМАТИВНЫЕ ДОКУМЕНТЫ Федеральный закон Российской Федерации от 20.07.2012 № 125-ФЗ «О донорстве крови и ее компонентов»
- 3. Клиническое использование донорской крови и (или) ее компонентов - медицинская деятельность, связанная с трансфузией (переливанием) донорской
- 4. Субъекты обращения донорской крови и (или) ее компонентов, осуществляющие заготовку, хранение, транспортировку, клиническое использование донорской крови
- 5. Не допускается клиническое использование донорской крови и (или) ее компонентов, условия хранения и транспортировки которых не
- 6. Субъектами обращения донорской крови и (или) ее компонентов используются зарегистрированные в установленном порядке медицинские изделия, предназначенные
- 7. Субъекты обращения донорской крови и (или) ее компонентов обеспечивают представление в Федеральное медико-биологическое агентство информации о
- 8. ТИПОВЫЕ НАРУШЕНИЯ ПРАВИЛ КЛИНИЧЕСКОГО ИСПОЛЬЗОВАНИЯ, ВЫЯВЛЯЕМЫЕ ХОДЕ ПРОВЕРКИ - результаты определения группы крови пациента не выносятся
- 9. - в отдельных случаях в протоколах переливания компонентов донорской крови (переносчики газов крови) отсутствуют результаты проведения
- 10. - в некоторых случаях не представляется возможным идентифицировать реактив (не указано наименование и серия), которым проводили
- 11. - после окончания трансфузии (переливания) донорской крови и (или) ее компонентов донорский контейнер с оставшейся донорской
- 13. Скачать презентацию










 Генетика олигофрений. Группа хромосомных заболеваний
Генетика олигофрений. Группа хромосомных заболеваний Телемедицина. Возможности и перспективы
Телемедицина. Возможности и перспективы 2011-2015 жылдарға Саламатты Қазақстан Қазақстан Республикасы денсаулық сақтау саласын дамытудың мемлекеттік бағдарламасы
2011-2015 жылдарға Саламатты Қазақстан Қазақстан Республикасы денсаулық сақтау саласын дамытудың мемлекеттік бағдарламасы Акне. Иммунная система кожи
Акне. Иммунная система кожи Основы урологии
Основы урологии Hormones and the Endocrine System
Hormones and the Endocrine System Мигрень. Диагностика. Лечение. Профилактика
Мигрень. Диагностика. Лечение. Профилактика Клинические особенности менингококковой инфекции у детей на современном этапе
Клинические особенности менингококковой инфекции у детей на современном этапе Аденовирусные инфекции. Грипп
Аденовирусные инфекции. Грипп Дезинфекция медицинских изделий
Дезинфекция медицинских изделий Вторичные соматические симптомы при поражении нервной системы
Вторичные соматические симптомы при поражении нервной системы Сүйек тінінің жасқа байланысты ерекшеліктері
Сүйек тінінің жасқа байланысты ерекшеліктері Основні переваги грудного вигодовування малят
Основні переваги грудного вигодовування малят Obsessive-Compulsive Disorder
Obsessive-Compulsive Disorder Лекарственные растения и сырье, содержащие жиры и жироподобные вещества. (Лекция 6)
Лекарственные растения и сырье, содержащие жиры и жироподобные вещества. (Лекция 6) Ауыз қуысының микоздары. Ашытқы тәріздес кандида саңырауқұлақтары. Қасиетері, адам патологиясындағы рөлі
Ауыз қуысының микоздары. Ашытқы тәріздес кандида саңырауқұлақтары. Қасиетері, адам патологиясындағы рөлі Какие заболевания называются облигатно-трансмиссивными? Медицинская протозоология
Какие заболевания называются облигатно-трансмиссивными? Медицинская протозоология Пневмонии и рак легких
Пневмонии и рак легких Лор ағзалардың құрылымы мен топографиясының жасқа байланысты ерекшеліктері.Лор ағзалардың патологиясындағы маңызы
Лор ағзалардың құрылымы мен топографиясының жасқа байланысты ерекшеліктері.Лор ағзалардың патологиясындағы маңызы Вирусные гепатиты: лечение и профилактика
Вирусные гепатиты: лечение и профилактика Сіреспеге қарсы қолданылатың дәрілік заттарға сипаттама
Сіреспеге қарсы қолданылатың дәрілік заттарға сипаттама Анализ заболеваемости острыми кишечными инфекциями, вызванные неустановленными инфекционными возбудителями населения
Анализ заболеваемости острыми кишечными инфекциями, вызванные неустановленными инфекционными возбудителями населения День донорства
День донорства Бүйрек және зәр биохимиясы
Бүйрек және зәр биохимиясы Сибирская язва
Сибирская язва Әртүрлі иондаушы сәулелер көздері түрлерінің заттармен өзара әсерлесуі. (Тақырып 2)
Әртүрлі иондаушы сәулелер көздері түрлерінің заттармен өзара әсерлесуі. (Тақырып 2)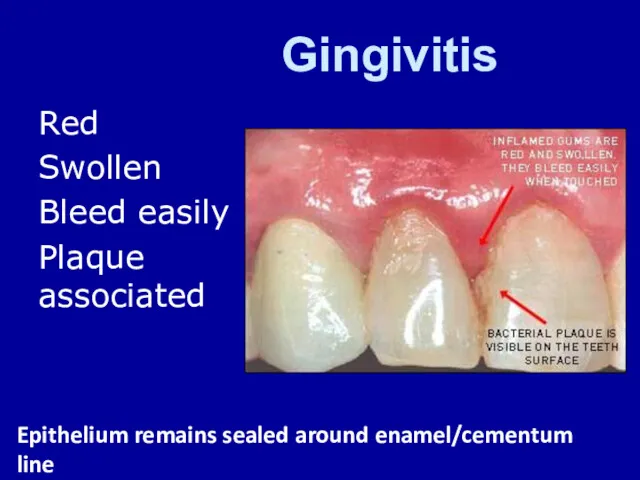 Periodontal Disease
Periodontal Disease Ортодонтические изгибы, их виды и техника нанесения на ортодонтические дуги
Ортодонтические изгибы, их виды и техника нанесения на ортодонтические дуги