Производство лекарственных средств и изделий медицинского назначения в Республике Казахстан презентация
Содержание
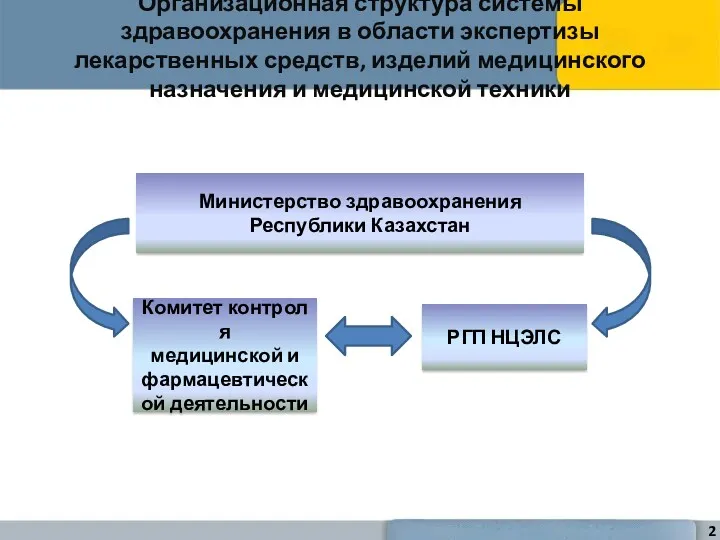
- 2. Организационная структура системы здравоохранения в области экспертизы лекарственных средств, изделий медицинского назначения и медицинской техники Министерство
- 3. Проведение законодательной реформы в сфере обращения ЛС, ИМН и МТ Разработка национальной лекарственной политики Республики Казахстан;
- 4. Проведение законодательной реформы в сфере обращения ЛС, ИМН и МТ продолжение Совершенствование контроля качества ввозимой и
- 5. Директива ЕС 2001/83 Европарламента и Совета ЕС от 06.11.2001 Основной целью любых правил, регулирующих производство, распределение
- 6. Основные требования к фармацевтическому сектору Эффективная и безопасная продукция Качественная фармацевтическая услуга Прогресс в удовлетворении открытых
- 7. безусловной ответственности всех субъектов обращения лекарственных средств постоянного обмена информацией на всех уровнях взаимодействия постоянного внимания
- 8. Основные причины необходимости совершенствования контроля безопасности и качества лекарственных препаратов Фармацевтический рынок в РК находится в
- 9. Что необходимо сделать по совершенствованию контроля качества лекарственных средств бюджетное финансирование в виде государственного задания контроля
- 10. Создание системы контроля качества В мировой практике контроль за качеством и безопасностью ЛС - функция государства
- 11. Создание системы контроля качества продолжение Проведение Государственного контроля дает возможность: Иметь дифференцированный подход к качеству с
- 12. В системе контроля качества ЛС, ИМН и МТ участвует Национальный центр экспертизы лекарственных средств, изделий медицинского
- 13. Функции Проведение экспертизы лекарственных средств, изделий медицинского назначения и медицинской техники при государственной регистрации (монопольная) Осуществление
- 14. Система менеджмента качества (СМК) на предприятии В 2006г. Национальный центр получил сертификат на соответствие системы менеджмента
- 15. Стандартизация лекарственных средств По государственному заказу МЗ РК Национальным центром разработана Государственная фармакопея Республики Казахстан в
- 16. Стандартизация лекарственных средств продолжение С целью дальнейшего повышения и гармонизации требований к качеству ЛС: в 2010
- 17. Вступление в сеть официальных лабораторий по контролю качества ЛС Цель координация действий по проведению лекарственного контроля
- 18. Фармаконадзор в РК Республика Казахстан в 2008 году признана полноправной страной-участницей Международной программы ВОЗ по мониторингу
- 19. Фармаконадзор в РК продолжение Для эффективной работы в этом направлении необходимо решить следующие задачи совершенствовать государственную
- 20. Мониторинг побочных действий 2011 год Количество поступивших карт-сообщений – 574 из них имеющие серьезные побочные действия
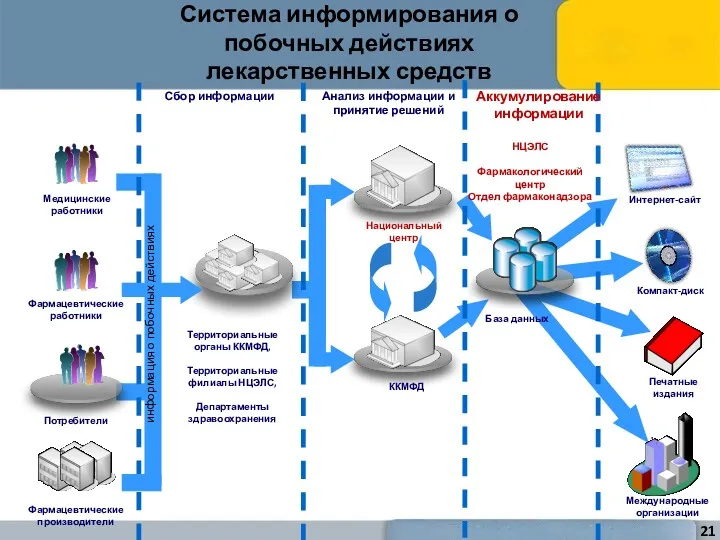
- 21. Система информирования о побочных действиях лекарственных средств Медицинские работники Фармацевтические работники Потребители Территориальные органы ККМФД, Территориальные
- 22. Фальсифицированные лекарственные препараты Представляют глобальный риск Истинный размер проблемы неизвестен Нет неуязвимых препаратов Нет абсолютно защищенных
- 23. Предпосылки для распространения фальсифицированных лекарственных средств несовершенное законодательство недостаточный контроль по обеспечению его соблюдения усложненные, относительно
- 24. Борьба с фальсифицированной фармацевтической продукцией Разработать государственную стратегию (концепцию) борьбы с обращением фальсифицированных лекарственных средств Создать
- 25. Передвижная экспресс-лаборатория Одним из способов выявления контрафактной продукции является своевременное проведение контроля качества. Испытательный центр оборудован
- 26. дефицит квалифицированных кадров, подготовленных для работы в соответствии со стандартами GMP ограниченный объем инвестиций в сектор
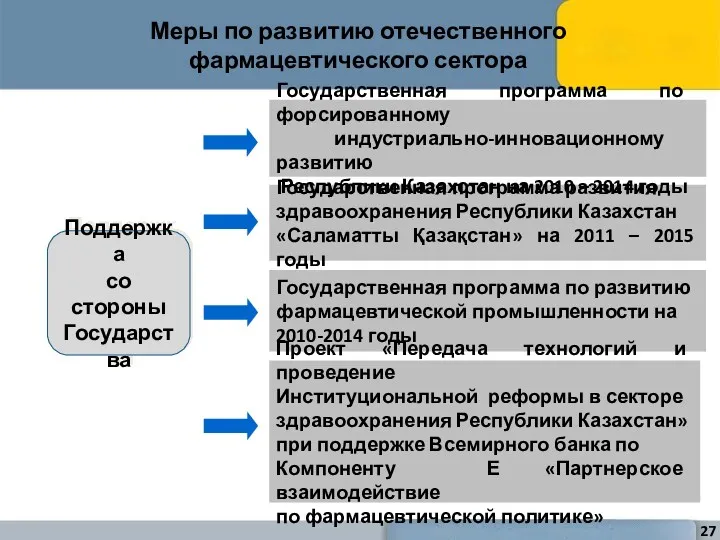
- 27. Меры по развитию отечественного фармацевтического сектора Поддержка со стороны Государства Государственная программа развития здравоохранения Республики Казахстан
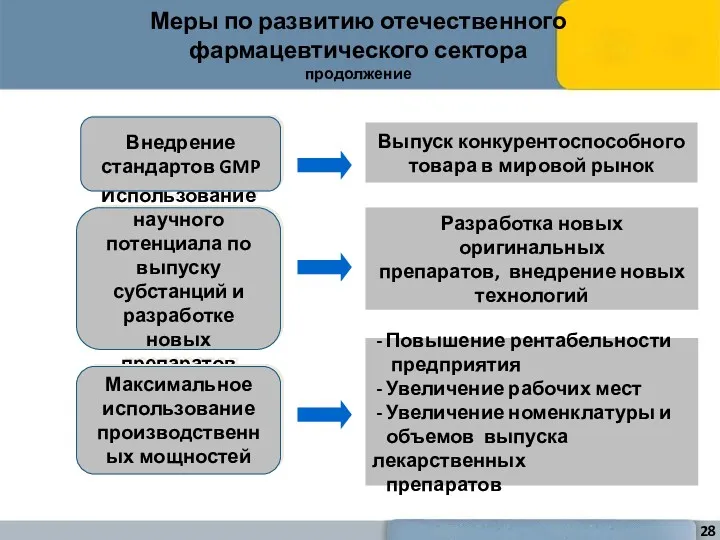
- 28. Использование научного потенциала по выпуску субстанций и разработке новых препаратов Разработка новых оригинальных препаратов, внедрение новых
- 29. Реализация Государственной программы развития здравоохранения РК «Саламатты Қазақстан» на 2011-2015 годы, разработка и принятие Национальной лекарственной
- 31. Скачать презентацию
























 Факторы патогенности микроорганизмов
Факторы патогенности микроорганизмов Анализ ассортимента и порядка отпуска антидепрессантов, используемых с целью злоупотребления
Анализ ассортимента и порядка отпуска антидепрессантов, используемых с целью злоупотребления Генетика пола. Наследование, сцепленное с полом
Генетика пола. Наследование, сцепленное с полом prezentatsiya_sibirskaya_yazva
prezentatsiya_sibirskaya_yazva Рак шейки матки и беременость
Рак шейки матки и беременость Ұлпа қабынуының этиологиясы мен патогенезі, патологиялық анатомиясы
Ұлпа қабынуының этиологиясы мен патогенезі, патологиялық анатомиясы Возбудитель сибирской язвы
Возбудитель сибирской язвы Үйреншікті жүктілікті көтере алмаушылық
Үйреншікті жүктілікті көтере алмаушылық Современные подходы к лечению эндометриоидных кист яичников
Современные подходы к лечению эндометриоидных кист яичников Некроз, Апоптоз
Некроз, Апоптоз Опухоли слюнных желез
Опухоли слюнных желез Ембріональний розвиток нервової системи
Ембріональний розвиток нервової системи Особенности визуального исследования органов кроветворения в детском возрасте
Особенности визуального исследования органов кроветворения в детском возрасте Аппендицит у беременных
Аппендицит у беременных Бешенство
Бешенство Вирусные заболевания слизистой полости рта у детей. Этиология патогенез. Методы диагностики, клиника
Вирусные заболевания слизистой полости рта у детей. Этиология патогенез. Методы диагностики, клиника Наркотические и ненаркотические анальгетики
Наркотические и ненаркотические анальгетики Бактериялық вагиноз (гарднереллалар)
Бактериялық вагиноз (гарднереллалар) Этика и деонтология в педиатрии. Периоды детского возраста. Особенности ухода за детьми различного возраста
Этика и деонтология в педиатрии. Периоды детского возраста. Особенности ухода за детьми различного возраста Чума́ (лат. pestis) — острое природно-очаговое инфекционное заболевание группы карантинных инфекций
Чума́ (лат. pestis) — острое природно-очаговое инфекционное заболевание группы карантинных инфекций Если хочешь быть здоровым - закаляйся
Если хочешь быть здоровым - закаляйся Клещевой энцефалит
Клещевой энцефалит Первая помощь при утоплении
Первая помощь при утоплении Вибриондар
Вибриондар Патофизиология эндокринной системы. (Лекция 34, 35)
Патофизиология эндокринной системы. (Лекция 34, 35) 3D моделирование в медицине
3D моделирование в медицине Коронавирусная инфекция
Коронавирусная инфекция Гиперпластические процессы эндометрия. Определение. Этиология. Патогенез
Гиперпластические процессы эндометрия. Определение. Этиология. Патогенез