Содержание
- 2. лекция2 Аналитическая химия 2. ФХМА Электрохимические методы анализа основаны на использовании процессов, протекающих на поверхности электрода
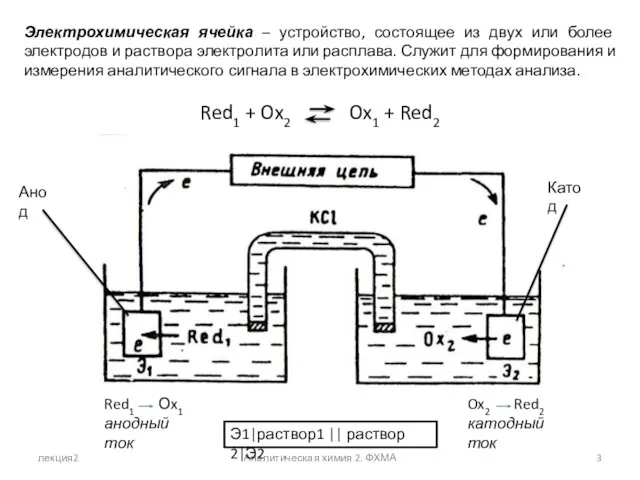
- 3. лекция2 Аналитическая химия 2. ФХМА Электрохимическая ячейка – устройство, состоящее из двух или более электродов и
- 4. Ячейки без жидкостного соединения (без переноса) – электроды помещены в один раствор Ячейки с жидкостным соединением
- 5. лекция2 Аналитическая химия 2. ФХМА Электроды нулевого рода (редокс-электроды) -электроды, состоящие из материала с электронной проводимостью,
- 6. лекция2 Аналитическая химия 2. ФХМА Индикаторный электрод – электрод, реагирующий на изменение концентрации аналита в растворе,
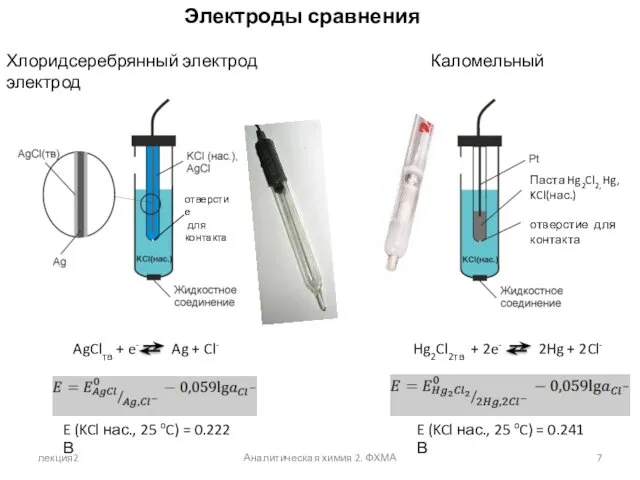
- 7. лекция2 Аналитическая химия 2. ФХМА Электроды сравнения Хлоридсеребрянный электрод Каломельный электрод E (KCl нас., 25 oC)
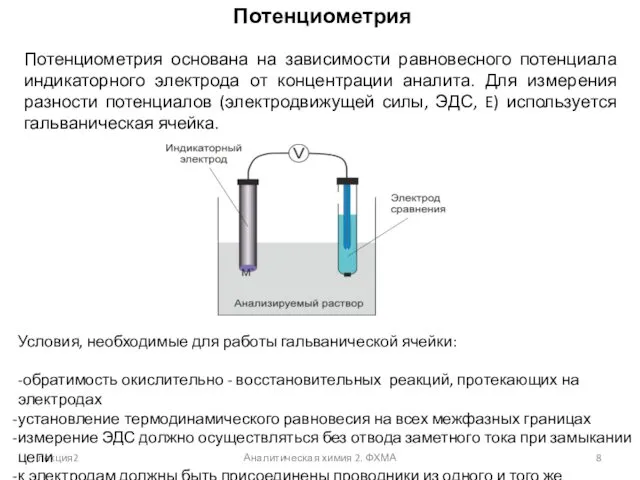
- 8. лекция2 Аналитическая химия 2. ФХМА Потенциометрия Потенциометрия основана на зависимости равновесного потенциала индикаторного электрода от концентрации
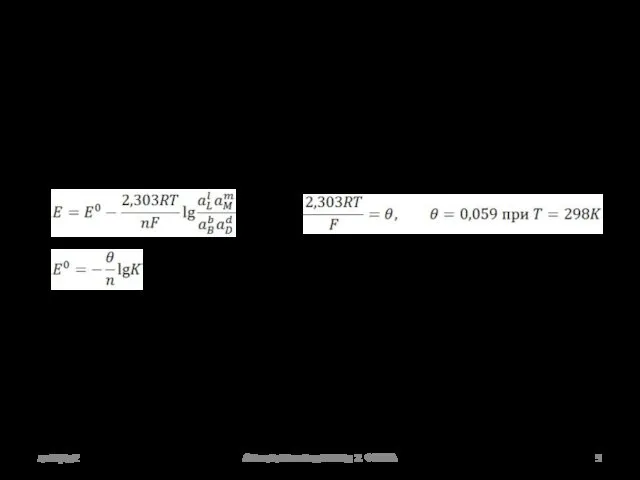
- 9. лекция2 Аналитическая химия 2. ФХМА Электродвижущая сила bB +dD lL + mM bB lL Red1 Ox1
- 10. лекция2 Аналитическая химия 2. ФХМА Индикаторные электроды – ионоселективные электроды - сенсоры (чувствительные элементы, датчики), потенциалы
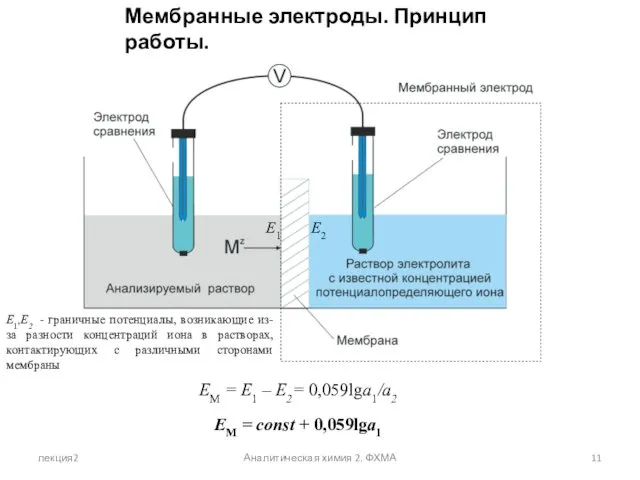
- 11. лекция2 Аналитическая химия 2. ФХМА Мембранные электроды. Принцип работы. EМ = E1 – E2= 0,059lga1/a2 EМ
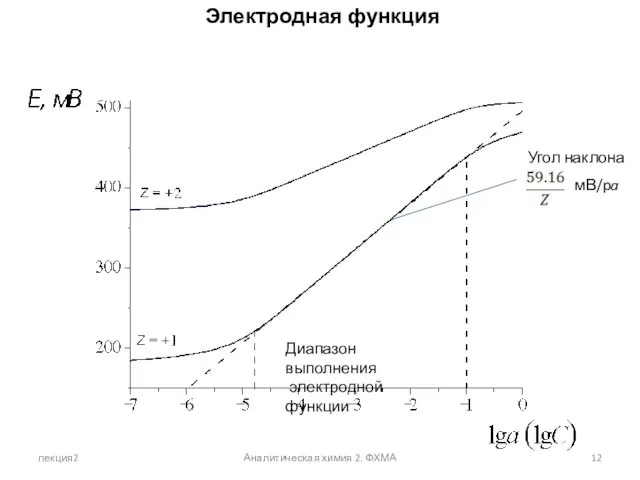
- 12. лекция2 Аналитическая химия 2. ФХМА Электродная функция Диапазон выполнения электродной функции Угол наклона мВ/pa
- 13. Селективность Селективность – мера относительной чувствительности электрода к потенциалопределяющим ионам по отношению к любым другим ионам,
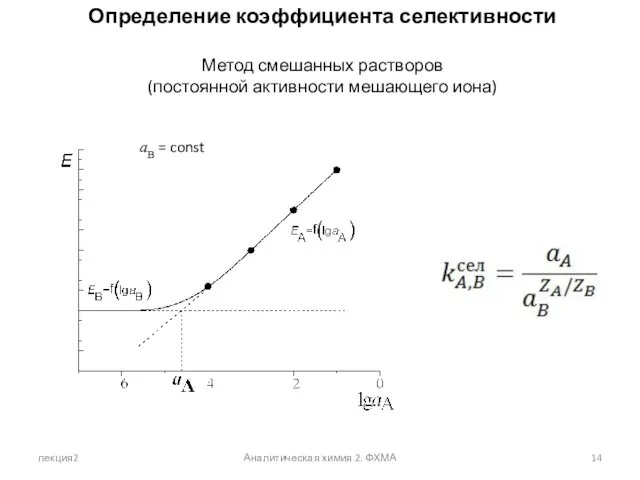
- 14. лекция2 Аналитическая химия 2. ФХМА Определение коэффициента селективности Метод смешанных растворов (постоянной активности мешающего иона) aB
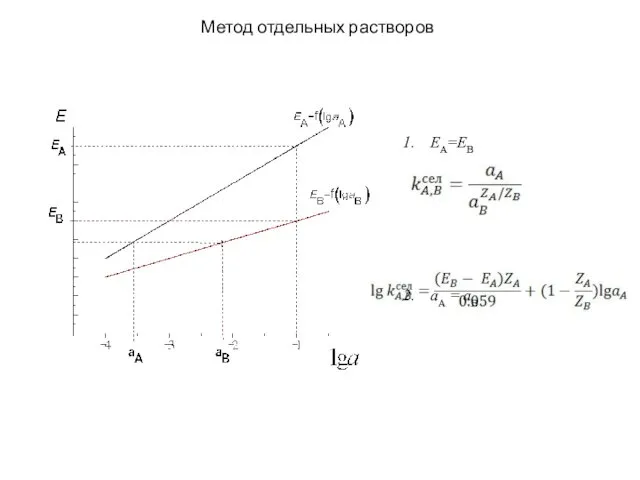
- 15. Метод отдельных растворов EA=EB aA = aB
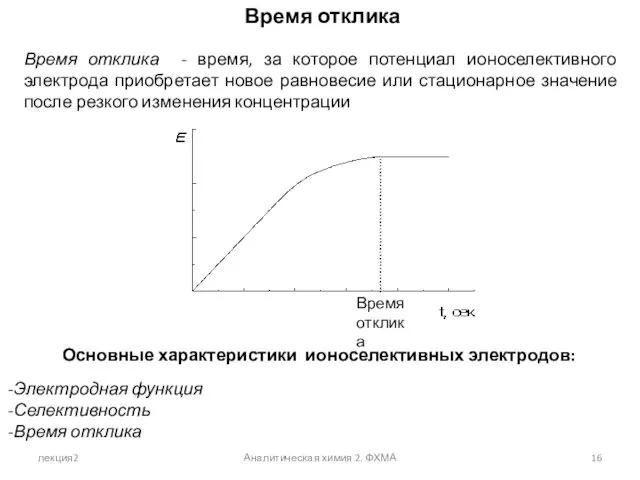
- 16. лекция2 Аналитическая химия 2. ФХМА Время отклика Время отклика - время, за которое потенциал ионоселективного электрода
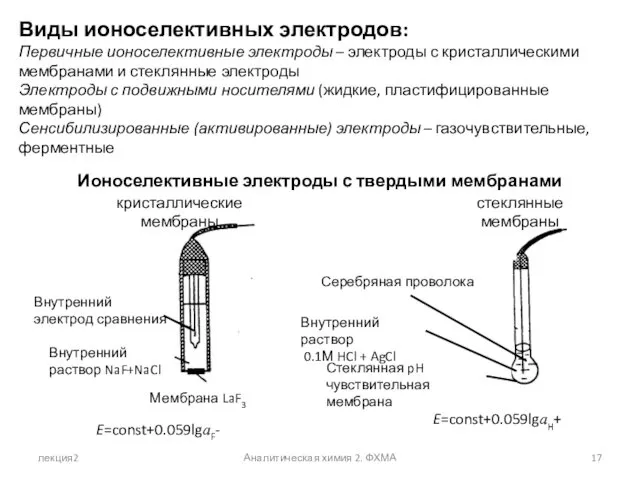
- 17. лекция2 Аналитическая химия 2. ФХМА Виды ионоселективных электродов: Первичные ионоселективные электроды – электроды с кристаллическими мембранами
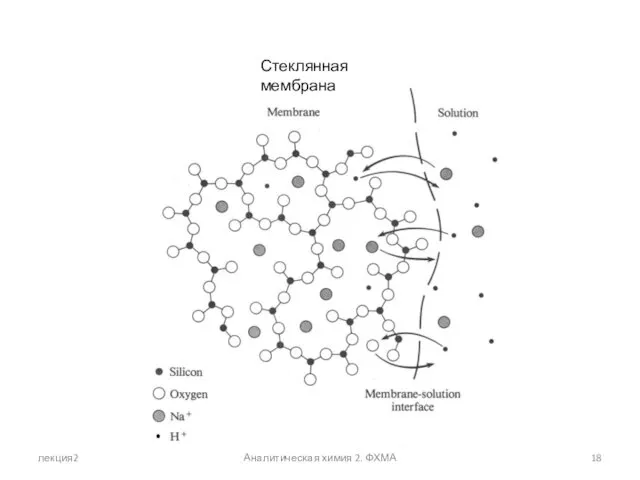
- 18. лекция2 Аналитическая химия 2. ФХМА Стеклянная мембрана
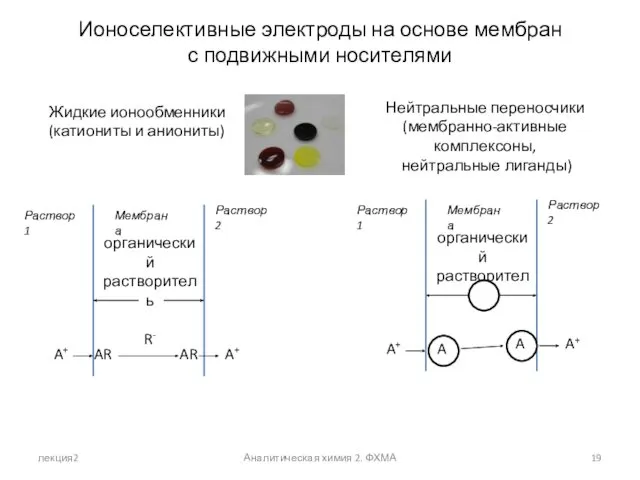
- 19. лекция2 Аналитическая химия 2. ФХМА Ионоселективные электроды на основе мембран с подвижными носителями Нейтральные переносчики (мембранно-активные
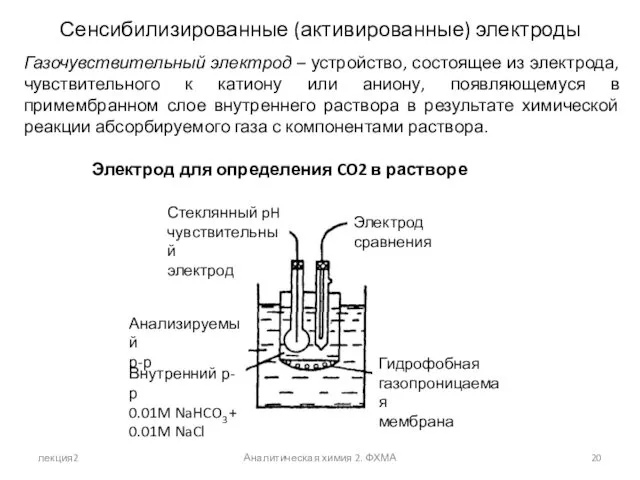
- 20. лекция2 Аналитическая химия 2. ФХМА Сенсибилизированные (активированные) электроды Газочувствительный электрод – устройство, состоящее из электрода, чувствительного
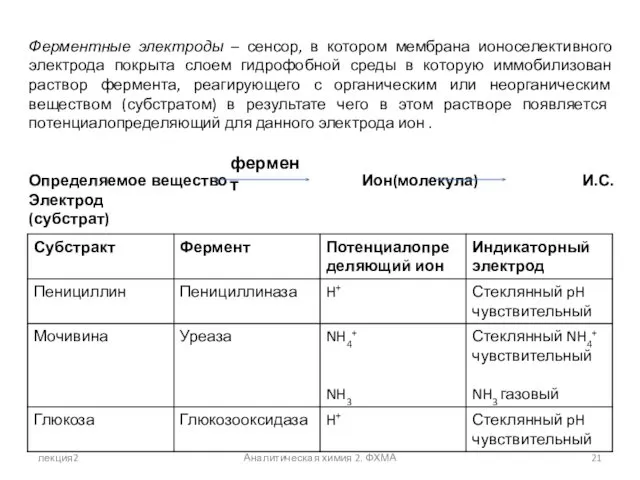
- 21. лекция2 Аналитическая химия 2. ФХМА Ферментные электроды – сенсор, в котором мембрана ионоселективного электрода покрыта слоем
- 22. лекция2 Аналитическая химия 2. ФХМА Ион-селективные полевые транзисторы – гибриды ион-селективных электродов и полевых транзисторов из
- 23. лекция2 Аналитическая химия 2. ФХМА Прямая потенциометрия (ионометрия) Метод градуировки электрода Метод градуировочного графика Метод добавок
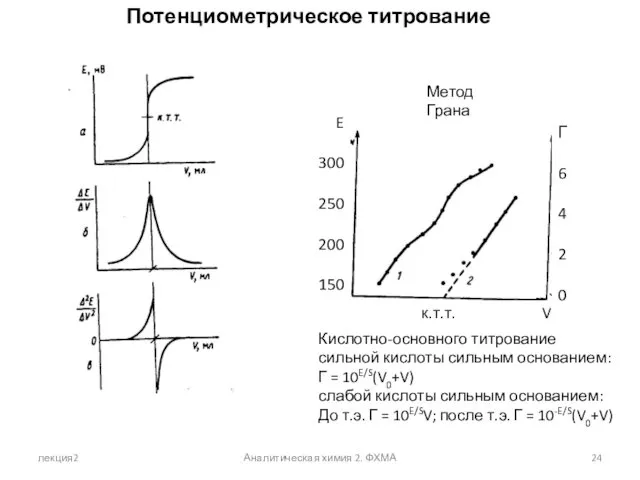
- 24. лекция2 Аналитическая химия 2. ФХМА Потенциометрическое титрование Метод Грана Г 6 4 2 0 E 300
- 25. лекция2 Аналитическая химия 2. ФХМА pH range from 0-12 to +0.5 accuracy • Conductivity from 0.05
- 26. лекция2 Аналитическая химия 2. ФХМА Микросенсор для мониторинга K в тканях животных, работающий в режиме реального
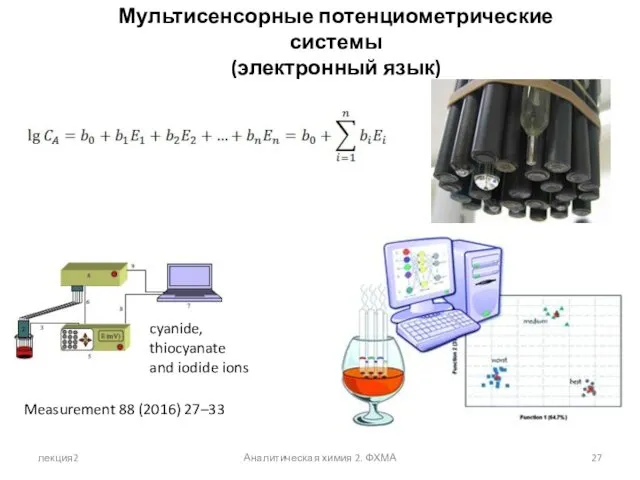
- 27. лекция2 Аналитическая химия 2. ФХМА Мультисенсорные потенциометрические системы (электронный язык) cyanide, thiocyanate and iodide ions Measurement
- 28. лекция2 Аналитическая химия 2. ФХМА Преимущества потенциометрии -Широкий диапазон доступных сенсорных материалов и датчиков. -Простота изменения
- 30. Скачать презентацию











 системно-деятельностный подход Диск
системно-деятельностный подход Диск Написание безударных суффиксов глагола в форме прошедшего времени
Написание безударных суффиксов глагола в форме прошедшего времени Кл. час 02.02.22 Достижения российской науки
Кл. час 02.02.22 Достижения российской науки Ауыру. Оның құрылымы, механизмі, өткізу жолдары, ағзаның ауыру сезіміне реакциясы
Ауыру. Оның құрылымы, механизмі, өткізу жолдары, ағзаның ауыру сезіміне реакциясы Специфика работы с детьми с ЗПР в условиях общеобразовательной школы
Специфика работы с детьми с ЗПР в условиях общеобразовательной школы Ароматические углеводороды
Ароматические углеводороды Термодинамические и газодинамические основы теории турбомашин
Термодинамические и газодинамические основы теории турбомашин Многофункциональное пособие
Многофункциональное пособие Жизнь на Земле
Жизнь на Земле ОАО Автоваз. Финансовая политика
ОАО Автоваз. Финансовая политика Лекция 1. Введение в бизнес-планирование
Лекция 1. Введение в бизнес-планирование Презентация к выступлению:Совершенствование языковой и речевой компетенции педагогов.
Презентация к выступлению:Совершенствование языковой и речевой компетенции педагогов. Основы технологии сушки керамического кирпича-сырца
Основы технологии сушки керамического кирпича-сырца Дидактические игры по УМК своими руками
Дидактические игры по УМК своими руками Оснастка обсадных колонн. (Лекция 2)
Оснастка обсадных колонн. (Лекция 2) Проект развития застройки городской территории. Реконструкция квартала
Проект развития застройки городской территории. Реконструкция квартала Жедел бүйрек жеткіліксіздігі
Жедел бүйрек жеткіліксіздігі Считывание и фильтрация данных с платы TRB3
Считывание и фильтрация данных с платы TRB3 Электрические машины постоянного тока (продолжение)
Электрические машины постоянного тока (продолжение) Открытое акционерное общество Борисовский завод агрегатов
Открытое акционерное общество Борисовский завод агрегатов Особенности организации проектной деятельности в детском саду.
Особенности организации проектной деятельности в детском саду. Общественный контроль, как механизм противодействия коррупций
Общественный контроль, как механизм противодействия коррупций Компетентностно - ориентированные задания.
Компетентностно - ориентированные задания. Внеклассное мерприятие Особенности поведения зимой в лесу
Внеклассное мерприятие Особенности поведения зимой в лесу Карта России
Карта России Электронная игра Подбери по форме и цвету
Электронная игра Подбери по форме и цвету Классный час Россия - Родина моя. Символы России.
Классный час Россия - Родина моя. Символы России. Опасность сигарет
Опасность сигарет