Содержание
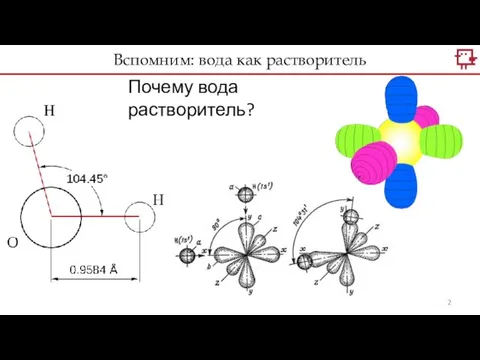
- 2. Почему вода растворитель? Вспомним: вода как растворитель
- 3. Подобное растворяется в подобном, то есть полярный растворитель подходит к полярному веществу. Вода как растворитель
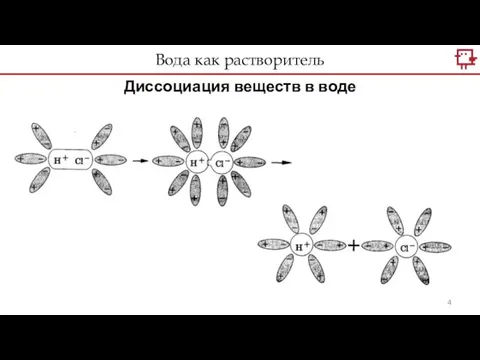
- 4. Диссоциация веществ в воде Вода как растворитель
- 5. Гидратация – присоединение воды к ионам, атомам или молекулам. Продукты такого процесса называют гидратами. Обратная реакция
- 6. Кристаллогидраты – кристаллические вещества, в состав которых входит химически связанная вода. Такую воду называют кристаллизационной водой.
- 7. Основные положения теории электролитической диссоциации: Электролиты при растворении или плавлении распадаются на ионы (диссоциируют) – положительные
- 8. Диссоциировать в водных растворах могут соли, кислоты, щелочи. Наиболее хорошо диссоциируют вещества с ионной связью (большой
- 9. Кислоты – такие вещества, при диссоциации в водных растворах которых в качестве катиона отщепляется только водород
- 10. H2SO4 HSO4- + H+ HSO4- SO42- + H+ H3PO4 H+ +H2PO4- H2PO4- H+ +HPO42- HPO42- H+
- 11. Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы (OH -). 2H2O H+
- 13. Скачать презентацию








 The production base of the group of companies is located in Ukraine LTD “Novator Pallet”
The production base of the group of companies is located in Ukraine LTD “Novator Pallet” Урок-сказка Колобок
Урок-сказка Колобок Гигиена воды и водоснабжения. (Лекция 7-8)
Гигиена воды и водоснабжения. (Лекция 7-8) Механизация очистного участка 3-38 в условиях ООО Шахта Алардинская
Механизация очистного участка 3-38 в условиях ООО Шахта Алардинская Projektowanie systemów informacyjnych
Projektowanie systemów informacyjnych Презентация Защита педагогической системы на аттестации
Презентация Защита педагогической системы на аттестации Розрахунково-експериментальний метод побудови алгоритму відключення циліндрів стаціонарного дизель-генератора
Розрахунково-експериментальний метод побудови алгоритму відключення циліндрів стаціонарного дизель-генератора Арт-проект Друзья птиц (декорирование скворечников).
Арт-проект Друзья птиц (декорирование скворечников). Музыка на все времена
Музыка на все времена Схемы света для студийной фотосъёмки
Схемы света для студийной фотосъёмки Ремонт кабинета № 13
Ремонт кабинета № 13 Давление грунта на подпорные стенки
Давление грунта на подпорные стенки Космическая литургия. Миросозерцание Максима Исповедника
Космическая литургия. Миросозерцание Максима Исповедника Формирование карты - схемы электроэнергетической системы Таджикистана
Формирование карты - схемы электроэнергетической системы Таджикистана Правила технической эксплуатации железных дорог Российской Федерации, часть 1
Правила технической эксплуатации железных дорог Российской Федерации, часть 1 Плесневые грибы. Дрожжи
Плесневые грибы. Дрожжи Российское право в контексте истории страны
Российское право в контексте истории страны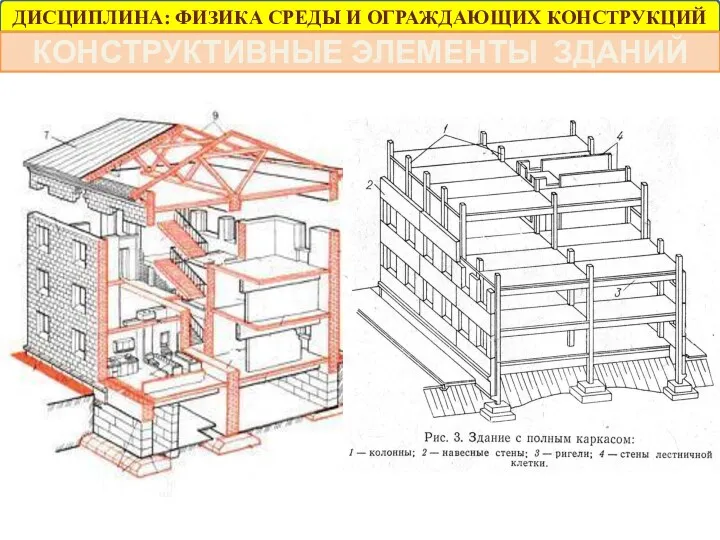 Конструктивные элементы зданий
Конструктивные элементы зданий ВКР Маркин
ВКР Маркин Красная книга Челябинской области
Красная книга Челябинской области The body
The body Теремкәй әкияте.
Теремкәй әкияте. Закаливание детей раннего возраста
Закаливание детей раннего возраста Труд в изобразительном искусстве
Труд в изобразительном искусстве 10 класс. Япония
10 класс. Япония Выпускники техникума – Герои ВОВ
Выпускники техникума – Герои ВОВ Персонифицированное финансирование дополнительного образования детей (информация для родителей)
Персонифицированное финансирование дополнительного образования детей (информация для родителей) День матери
День матери